光学相干断层扫描在视网膜缺血再灌注动物模型中的应用及评价△
李娟娟 李燕 汤志伟
光学相干断层扫描在视网膜缺血再灌注动物模型中的应用及评价△
李娟娟 李燕 汤志伟
光学相干断层扫描;缺血再灌注损伤;HE染色;视网膜厚度
目的观察视网膜缺血再灌注损伤动物模型构建后不同时间视网膜组织光学相干断层扫描(optical coherence tomography,OCT)影像学的变化及相应组织病理学改变的特点。方法采用成年SD大鼠,通过前房灌注法建立视网膜缺血再灌注损伤的动物模型,模型建立后0 h(正常对照组)、2 h、12 h、24 h、48 h、168 h分别行视网膜OCT检查及HE染色检查,并使用OCT测量大鼠视网膜厚度,进行统计学分析。结果与正常对照组相比,缺血再灌注2 h组OCT显示各层次结构相对正常;缺血再灌注12 h、 24 h组视网膜神经上皮层水肿、厚度增加,各层结构的分界已不能清晰显示,呈逐渐加重趋势;48 h组水肿达高峰,至168 h组,各层结构显示不清。缺血再灌注12 h、 24 h、48 h、168 h组视网膜厚度与正常对照组差异均有统计学意义(均为P<0.05),168 h组视网膜厚度明显减少,萎缩明显。HE染色检查提示正常对照组各层视网膜组织排列整齐;缺血再灌注2 h组,视网膜轻度水肿,偶见视网膜神经节细胞层和内核层空泡变性;缺血再灌注12 h及24 h组视网膜神经纤维层、神经节细胞层均出现大量空泡,厚度增加;缺血再灌注48 h组水肿到达高峰;168 h组神经节细胞层核浓缩,缺血再灌注明显增加,细胞数量减少、视网膜变薄。结论OCT与传统的组织病理学检查相比较,虽然不能够提供更为详尽的组织学资料,但在活体组织中OCT可显示缺血再灌注损伤发生后视网膜组织结构整体的变化,无创简便,在动物实验及临床运用上均有一定的价值。
[眼科新进展,2014,34(7):616-619,623]
视网膜缺血病变包括视网膜血管阻塞、糖尿病视网膜病变、青光眼、眼外伤等,这类疾病导致视网膜血供中断、视网膜各层组织缺氧,当缺血因素解除、血流再灌注发生时,带来过量的氧自由基、并造成过度的炎症反应,启动坏死、凋亡、自噬等多种途径,造成视网膜神经节细胞的损伤[1]。为了更好地研究视网膜缺血再灌注后的病理损伤机制,我们通过前房灌注法建立视网膜缺血再灌注损伤的动物模型[2],并采用频域光学相干断层扫描技术(special domain optical coherence tomography,SD-OCT)结合视网膜病理组织技术对缺血再灌注损伤后不同时间段的视网膜形态学变化进行动态观察,探讨光学相干断层扫描(optical coherence tomography,OCT)在视网膜缺血再灌注损伤疾病中的应用价值。
1 材料与方法
1.1实验动物选择4~6周龄的SD雄性大鼠30只60眼(其中实验组25只,正常对照组5只),体质量200~250 g,实验前检查双眼前节和眼底均正常。实验动物及实验使用条件均符合《实验动物管理条例》。实验组25只大鼠再随机分为缺血再灌注2 h组、12 h组、24 h组、48 h组、168 h组,每组5只,分笼喂养。
1.2动物模型建立腹腔内注射15 g·L-1戊巴比妥钠(15~20 mg·kg-1,昆明南天化工药业)行全身麻醉;眼部滴布比卡因行局部麻醉。将麻醉成功的大鼠采取俯卧位固定于自制的大鼠固定器上,使用复方托吡卡胺散大瞳孔,5号头皮针与生理盐水瓶连接,将头皮针刺入前房固定针头,缓慢升高生理盐水瓶使液面高至150 cm,眼压升高至110 mmHg(1 kPa=7.5 mmHg),持续60 min后逐渐降低输液瓶高度至动物眼球水平,拔出前房灌注针头,恢复视网膜血供。眼压升高后可见大鼠角膜逐渐水肿,虹膜颜色变浅,间接检眼镜眼底观察可见视网膜血供减少,视网膜血管阻断。拔出针头后可见大鼠角膜逐渐恢复透明,虹膜颜色逐渐恢复,视网膜逐渐恢复红润,实现再灌注。视网膜出现上述表现证明造模成功。
1.3大鼠视网膜OCT检查分别于视网膜缺血再灌注动物模型建立后0 h(即正常对照组)、2 h、12 h、24 h、48 h、168 h(每个时间段5只大鼠)对大鼠进行腹腔麻醉,之后用复方托吡卡胺散瞳,将大鼠眼部固定于OCT扫描仪(Heidelberg HRA2,德国)下颌架前合适位置,并使用显微有齿镊夹住结膜,调整瞳孔至合适位置,行视网膜SD-OCT扫描。扫描参数为:扫描长度2~8 mm,扫描深度2~4 mm,扫描部位为视盘颞侧、鼻侧、上方、下方1个视盘直径处视网膜。每只动物重复扫描5次,选择图像质量与位置较佳者进行标记保存,分析不同时间段缺血再灌注大鼠动物模型中视网膜OCT影像学图像变化特征。运用OCT扫描仪测量上述四个部位视网膜厚度,每个点测量3次后取平均值,与正常大鼠视网膜进行对照。
1.4大鼠视网膜病理切片检查视网膜缺血再灌注2 h、12 h、24 h、48 h、168 h组于OCT检查之后行腹腔注射过量麻醉药物处死大鼠,摘除眼球、标记方向。将眼球置于福尔马林溶液内固定48 h,去除角膜和晶状体;依次梯度酒精脱水、二甲苯透明、浸蜡包埋。修整蜡块,作平行于晶状体前后表面经线方向的切片,切片厚4~5 μm。去除含有视神经的切片,每个标本选择两个切片行常规HE染色。脱蜡、苏木素染色、伊红染色、梯度酒精脱水,二甲苯透明,中性树胶封片。光学显微镜下观察视网膜组织病理变化,重点观察神经节细胞的损伤情况。与正常对照组大鼠及上述OCT检查结果进行对比分析。
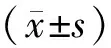
2 结果
2.1大鼠视网膜缺血再灌注损伤模型建立情况实验组大鼠经眼底间接检眼镜对虹膜和视网膜的观察证实所有大鼠均实现了视网膜缺血再灌注(图1-图3),成功率达100%,无屈光介质受损、感染、实验动物死亡等并发症的发生。
2.2各组大鼠视网膜OCT检查结果分析正常对照组大鼠视网膜OCT图像:可以较为清晰地显示视网膜神经上皮层及RPE细胞层,其中神经上皮层中各层结构清晰、形态正常(图4A)。实验组大鼠视网膜OCT图像:缺血再灌注2 h组OCT显示各层次结构较正常对照组清晰,但整个神经上皮层的厚度增厚,以内丛状层及内核层的增厚最为明显,两层之间的分界仍然清晰可见(图4B)。缺血再灌注12 h组及24 h组,OCT显示视网膜神经上皮层继续变得水肿、厚度增加,这两组神经上皮层间各层结构的分界已不能清晰显示(图4C-图4D)。缺血再灌注48 h组水肿达到高峰,至168 h时,视网膜神经上皮层的厚度明显变薄,其间各层结构仍然显示不清(图4E-图4F)。
2.3视网膜厚度的统计学分析OCT所测各组大鼠视网膜厚度见表1。总体变化规律为缺血再灌注2 h至24 h组视网膜厚度和正常对照组相比均增加,48 h组到达高峰,168 h组低于正常对照组。缺血再灌注2 h组与正常对照组视网膜厚度差异无统计学意义(P>0.05);缺血再灌注12 h、24 h、48 h、168 h组与正常对照组视网膜厚度差异均有统计学意义(均为P<0.05)。
2.4各组大鼠视网膜组织病理检查结果分析正常对照组大鼠视网膜HE染色结果显示,大鼠视网膜结构分为十层,各层视网膜组织排列整齐,主要分界清楚的三层细胞为:视网膜神经节细胞、内核层细胞、外核层细胞,其中视网膜神经节细胞为最内层的单层细胞,细胞核较大,染色较淡;内核层和外核层形态较为相似,均为多层细胞构成,细胞核小且圆、核染色较深(图5A)。实验组大鼠视网膜HE染色结果显示:与正常对照组相比,缺血再灌注2 h组大鼠视网膜轻度水肿,偶见视网膜神经节细胞层和内核层空泡变性、间质疏松;总体而言结构完整,未见显著差异(图5B)。缺血再灌注12 h及24 h组:视网膜神经纤维层、神经节细胞层出现大量空泡;内外丛状层明显疏松、厚度增加,神经节细胞数量减少;内核层排列不规整,细胞间疏松排列(图5C-图5D)。缺血再灌注48 h组:视网膜神经纤维层、内丛状层空泡明显,水肿到达高峰;视网膜神经节细胞层开始出现核浓缩,数量明显减少;内核层排列紊乱,细胞数量减少;外核层也开始出现排列不规则、数量减少;视网膜可观察到炎性细胞浸润(图5E)。缺血再灌注168 h组:神经纤维层水肿减轻、厚度变薄,神经节细胞数十分稀少、散在分布,各层细胞核浓缩明显增加,细胞排列紊乱,视网膜正常结构层次基本消失(图5F)。
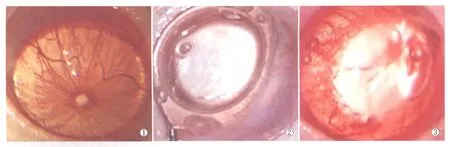
Figure 1 Iris blood vessels in normal rats was reticular distributed,the vascular morphology was normal and distributed to the pupil.Figure 2 Most of the iris vessels following anterior chamber perfusion became occlusion,only a few larger vessels was seen and conjunctival tissue was pale.Figure 3 Iris vessels after reperfusion was reperfused,vascular was significant engorgement with hyperemia 图1 正常实验组大鼠虹膜血管分布:可见虹膜血管呈网状均匀分布,血管形态正常,向瞳孔区走形。图2 前房灌注下虹膜血管:大部分虹膜血管闭塞,仅隐见数支较大血管,整个虹膜组织及球结膜组织苍白。图3 再灌注后虹膜血管:可见虹膜血管重新充盈,血管怒张,充血状态明显
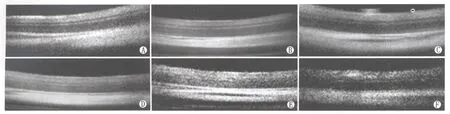
Figure 4 OCT images of rat retinal in each group.A:Normal rat;B:2 hours after ischemia-reperfusion group;C:12 hours after ischemia-reperfusion group;D:24 hours after ischemia-reperfusion group;E:48 hours after ischemia-reperfusion group;F:168 hours after ischemia-reperfusion group 各组大鼠视网膜OCT图像。A:正常对照组;B:缺血再灌注2 h组;C:缺血再灌注12 h组;D:缺血再灌注24 h组;E:缺血再灌注损伤48 h组;F:缺血再灌注损伤168 h组
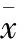
表1 各组视网膜厚度Table 1 Retinal thickness in each group(±s,l/μm)
3 讨论
OCT是上世纪90年代发展起来的一种光学仪器,可提供分辨活体组织的断层图像,并可以依靠所知或推断的组织反射来测量组织的厚度或距离[3]。OCT作为一种非侵入、非接触、高分辨率的定性定量检测方法,在视网膜疾病的评估方面有着特别的应用价值[4],而目前文献尚无运用OCT技术检测缺血再灌注损伤性视网膜疾病的报道。本研究通过前房灌注法建立视网膜缺血再灌注动物损伤模型[5],在损伤后不同时间使用OCT测量视网膜厚度,同时使用传统病理检查技术对比分析视网膜组织病理变化。初步探讨OCT技术在缺血再灌注损伤疾病中的应用价值。
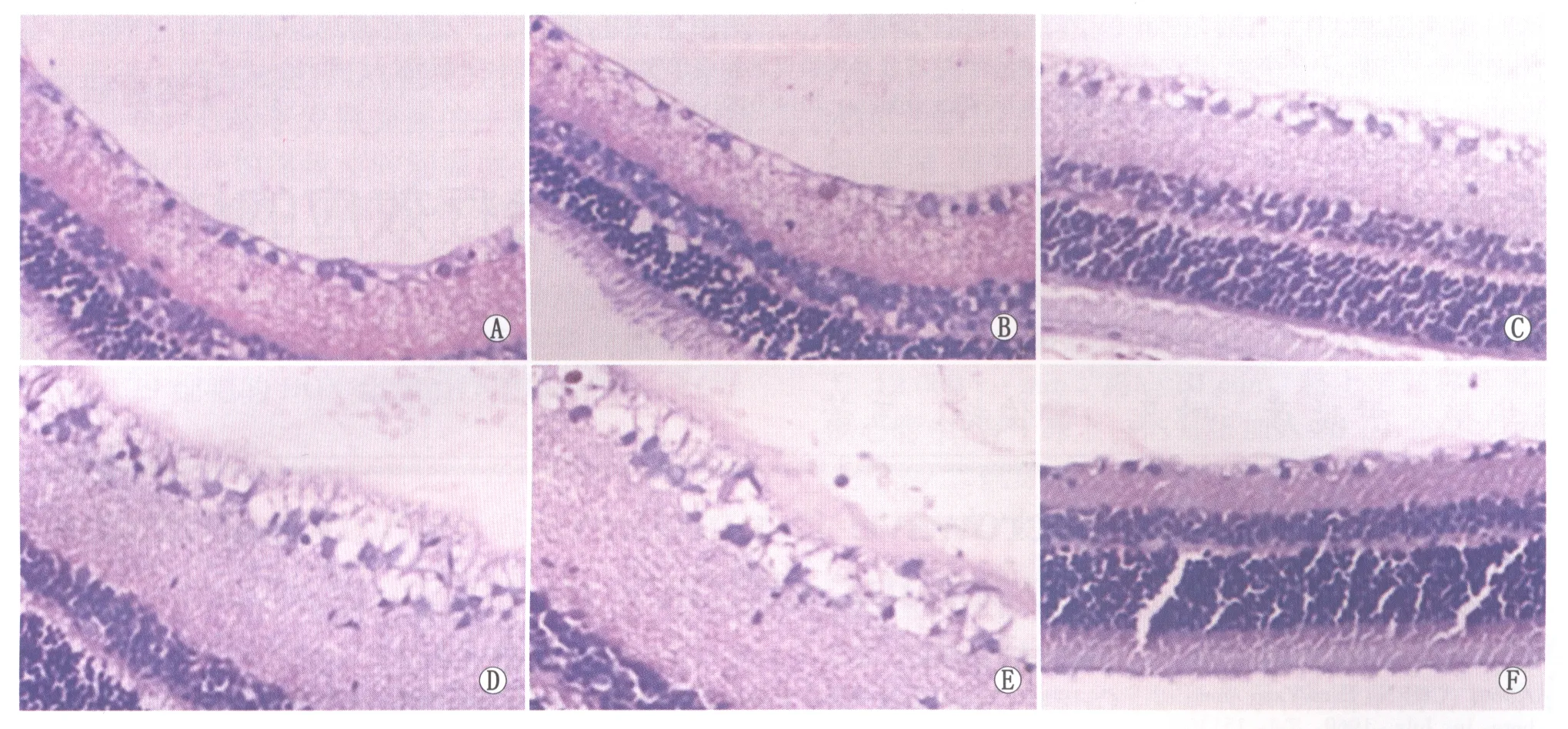
Figure 5 Optical microscopy images of rat retina(HE,×200).A:Normal rat;B:2 hours after ischemia-reperfusion group;C:12 hours after ischemia-reperfusion group;D:24 hours after ischemia-reperfusion group;E:48 hours after ischemia-reperfusion group;F:168 hours after ischemia-reperfusion group 各组大鼠视网膜光学显微镜图像(HE,×200)。A:正常对照组;B:缺血再灌注 2 h组;C:缺血再灌注 12 h组;D:缺血再灌注 24 h组;E:缺血再灌注 48 h组;F:缺血再灌注 168 h组
视网膜缺血再灌注损伤不同时间OCT扫描结果显示:正常对照组大鼠视网膜OCT图像可以较为清晰地显示视网膜的神经上皮层、RPE细胞层,神经上皮层结构清晰、形态正常[6]。缺血再灌注2 h组OCT显示各层次结构相对正常对照组而言基本可以分辨清楚,但整个神经上皮层的厚度轻微增厚,以内丛状层及内核层的增厚较为明显,两层之间的分界仍然清晰可见;结合该时间组大鼠视网膜病理切片观察到的结果,缺血再灌注损伤发生后2 h,内丛状层及内核层开始出现空泡样变,间质疏松。以上研究证实在缺血再灌注损伤早期,即开始出现视网膜组织的病理损害,组织结构以水肿为主要表现,损伤部位主要发生在视网膜内层[7]。
随着病变的进展,缺血再灌注损伤发生后12 h及24 h,OCT显示视网膜神经上皮层继续变得水肿、厚度增加,神经上皮层间各层结构的分界已不能清晰显示;结合这两个时间点的组织病理切片结果发现,视网膜神经纤维层、神经节细胞层均出现大量空泡,内外丛状层明显疏松、厚度增加,48 h时视网膜厚度继续增加,而结构也不能清晰显示的原因可能是由于此时多种途径产生的大量氧自由基诱导出一系列链式反应,通过破坏细胞膜屏障、改变细胞膜渗透性、降低酶活性等多种途径对视网膜组织和细胞造成结构和功能的显著改变,氧自由基的积蓄、炎症反应的程度都达到缺血再灌注损伤过程的最高点[8-9]。因此我们认为,缺血再灌注发生24 h是损害作用产生的高峰期,这一研究结果将用于下部分干预实验中。
当病变进入48 h后,OCT扫描结果显示在缺血再灌注损伤48 h、168 h时,视网膜神经上皮层的厚度开始变薄,其间各层结构仍然显示不清。病理检查结果显示,视网膜神经节细胞层开始出现核浓缩。在此阶段中氧自由基、炎症反应、兴奋性氨基酸的毒性作用、钙超载等启动了多途径的细胞坏死、凋亡,导致了最终的形态破坏及功能损伤[10]。
在缺血再灌注损伤各个时间点对视网膜色素上皮层厚度及形态的观察结果显示色素上皮层的变化并不明显,厚度测量无统计学差异、形态观察与正常对照组相比并未出现异常。视网膜色素上皮层病变不明显的原因考虑为:本模型通过前房灌注制造高眼压,高眼压主要影响视网膜中央动脉系统的血液供应,而视网膜中央动脉系统供应视网膜内层结构,视网膜色素上皮层属于视网膜外层,其供血主要来自脉络膜组织,故在此模型中,它的病变并不明显[11]。病理学检查结果也证实了这一结论。
我们对比观察了OCT与视网膜病理切片的检查结果,从病理形态的准确性及精确性而言,OCT所提供的影像学信息远远不能同病理切片相提并论,但我们认为作为一种无创性检查,OCT在临床上对于缺血再灌注损伤性疾病仍然有着其特有的使用价值:(1)OCT能精确测量视网膜厚度变化,从而提示病变进展的程度,是处于氧自由基和炎症反应的高峰期,还是已经进入病变的萎缩期,从而指导不同阶段的治疗策略,并对治疗效果进行监测;对于组织厚度的测量,OCT测量对象为活体,而病理方法测量标本经过脱水等处理环节,测量值相对变小,因此OCT更接近真实厚度[12];(2)OCT能在视网膜结构层次的改变方面提供影像学信息,帮助我们认识病变不同阶段造成视网膜损伤的部位、程度;(3)OCT无创伤、可重复性好,加上目前已经十分成熟的追踪系统,OCT可提供患者疾病的动态观察;(4)对于活体组织,进行精细的病理学检查并不可行,OCT虽不能提供精细的病变特征,仅能从整体上反映病变程度,但随着OCT技术的进展,它与病理学之间的差距将会越来越小,具有广阔的应用前景[13];(5)在实验动物的研究中,OCT可对一个研究对象提供连续的观察结果,改变了传统病理检查只能提供一个时间点的观察结果,减少了动物的使用量,避免了重复而繁琐的实验步骤,节省了成本,提高了效率。
1 Nucci C,Tartaglione R,Cerulli A,Mancino R,Spanò A,Cavaliere F,etal.Retinal damage caused by high intraocular pressure-induced transient ischemia is prevented by coenzyme Q10 in rat[J].IntRevNeurobiol,2007,82(9):397-406.
2 Vidal-Sanz M,Lafuente MP,Mayor S,de Imperial JM,Villegas-Pérez MP.Retinal ganglion cell death induced by retinal ischemia.Neuroprotective effects of two alpha-2 agonists[J].SurvOphthalmol,2001,45(3):s261-277.
3 Karahan E,Zengin MO,Tuncer I.Correlation of choroidal thickness with outer and inner retinal layers[J].OphthalmicSurgLasersImagingRetina,2013,24(6):1-4.
4 Aaker GD,Gracia L,Myung JS,Borcherding V,Banfelder JR,D’Amico DJ,etal.Volumetric three-dimensional reconstruction and segmentation of spectral-domain OCT[J].OphthalmicSurgLasersImaging,2011,42(4):s116-120.
5 Ishizuka F,Shimazawa M,Inoue Y,Nakano Y,Ogishima H,Nakamuras,etal.Toll-like Receptor 4 mediates retinal ischemia/reperfusion injury through nuclear factor-κB and spleen tyrosine kinase activation[J].InvestOphthalmolVisSci,2013,54(8):5807-5816.
6 Huang P,Huo Y,Lou LX,Li H,Barnstable CJ,Zhang C,etal.CD4 positive T helper cells contribute to retinal ganglion cell death in mouse model of ischemia reperfusion injury[J].ExpEyeRes,2013,115(10):131-139.
7 Varga B,Gesztelyi R,Bombicz M,Haines D,Szabo AM,Kemeny-Beke A,etal.Protective effect of alpha-melanocyte-stimulating hormone(α-MSH)on the recovery of ischemia/reperfusion(I/R)-induced retinal damage in a rat model[J].JMolNeurosci,2013,50(3):558-570.
8 Kamioka Y,Fujikawa C,Ogai K,Sugitani K,Watanabe S,Kato S,etal.Functional characterization of fish neuroglobin:zebrafish neuroglobin is highly expressed in amacrine cells after optic nerve injury and can translocate into ZF4 cells[J].BiochimBiophysActa,2013,1834(9):1779-1788.
9 Vin AP,Hu H,Zhai Y,Von Zee CL,Logeman A,Stubbs EB Jr,etal.Neuroprotective effect of resveratrol prophylaxis on experimental retinal ischemic injury[J].ExpEyeRes,2013,108(3):72-75.
10 Dorfman D,Fernandez DC,Chianelli M,Miranda M,Aranda ML,Rosenstein RE.Post-ischemic environmental enrichment protects the retina from ischemic damage in adult rats[J].ExpNeurol,2013,240(2):146-156.
11 Tong N,Zhang Z,Gong Y,Yin L,Wu X.Diosmin protects rat retina from ischemia reperfusion injury[J].JOculPharmacolTher,2012,28(5):459-466.
12 Schallner N,Fuchs M,Schwer CI,Loop T,Buerkle H,Lagrèze WA,etal.Postconditioning with inhaled carbon monoxide counteracts apoptosis and neuroinflammation in the ischemic rat retina[J].PLoSOne,2012,7(9):e46479.
13 Klein T,Wieser W,Reznicek L,Neubauer A,Kampik A,Huber R.Multi-MHz retinal OCT[J].BiomedOptExpress,2013,4(10):1890-1908.
date:Dec 17,2013
National Natural Science Foundation of China(No:81360204)From theDepartmentofOphthalmology,theFirstAffiliatedHospitalofKunmingMedicalUniversity(LI Juan-Juan,LI Yan),Kunming650031,YunnanProvince,China;DepartmentofNeurosurgery,theFirstAffiliatedHospitalofKunmingMedicalUniversity(TANG Zhi-Wei),Kunming650021,YunnanProvince,China
Application of optical coherence tomography in rat retinal ischemia reperfusion injury models
LI Juan-Juan,LI Yan,TANG Zhi-Wei
optical coherence tomography;retinal ischemic reperfusion injury;HE staining;retinal thickness
ObjectiveTo observe the changes of retinal morphology and pathologic characteristics in retinal ischemic reperfusion injury (RIRI) animal model by optical coherence tomography (OCT).MethodsTransient ischemia was induced in SD mice by raising intraocular pressure to 110 mmHg (1 kPa=7.5 mmHg) for 60 minutes followed by retinal reperfusion by restoring normal pressure.At 0 hour (normal control group),2 hours,12 hours,24 hours,48 hours and 168 hours after RIRI,retinal changes were monitored by histological assessment with HE staining and SD-OCT scanning.The retinal thickness was measured.ResultsOCT showed the each layer of retina was relatively normal at 2 hours after RIRI,the nerve epithelial layer was became edema and thickened at 12 hours and 24 hours after RIRI,and the boundary layers of the structure could not be shown clearly.The edema reached peak at 48 hours after RIRI,and each layer could not be shown clearly until 168 hours after RIRI.Compared with normal control group,there were statistical differences in retinal thickness at 12 hours,24 hours,48 hours and 168 hours after RIRI (allP<0.05),the retinal thickness at 168 hours was decreased and thinned obviously.Pathological examination showed the retinal edema and occasionally retinal ganglion cell layer and inner nuclear layer degeneration appeared,a large vacuoles in retinal nerve fiber layer and ganglion cell layer formed with increased thickness at 12 hours and 24 hours after RIRI,and the edema peaked at 48 hours after RIRI.With the disease retinal ganglion cell layer began nuclear enrichment,the nuclear enrichment significantly increased,the retinal cells were obviously decreased,and the retina became thinner at 168 hours after RIRI.ConclusionCompared with conventional histopathology,OCT can’t provide more detailed histological data,but in the living tissues OCT can disclose the changes in the overall organizational structure of retina after injury,as a non-invasive and easy method,OCT have some values in animal experiments and clinical application.
李娟娟,女,1980年出生,在读博士研究生。研究方向为玻璃体视网膜疾病。联系电话:0871-65156650-3084(O);E-mail:ljj800-502@163.com
AboutLIJuan-Juan:Female,born in 1980.Doctor degree.Tel:+86-871-65156650-3084(O);E-mail:ljj800502@163.com
2013-12-17
国家自然科学基金资助(编号:81360204)
650031 云南省昆明市,昆明医科大学第一附属医院眼科(李娟娟,李燕);650021 云南省昆明市,昆明医科大学第一附属医院神经外科(汤志伟)
李燕,E-mail:liyanr@hotmail.com
李娟娟,李燕,汤志伟.光学相干断层扫描在视网膜缺血再灌注动物模型中的应用及评价[J].眼科新进展,2014,34(7):616⁃619,623.
10.13389/j.cnki.rao.2014.0169
【实验研究】
修回日期:2014-02-28
本文编辑:付中静
Accepteddate:Feb 28,2014
Responsibleauthor:LI Yan,E-mail:liyanr@hotmail.com
[RecAdvOphthalmol,2014,34(7):616-619,623]

