CXCR3、IP-10对高糖诱导的人脐静脉内皮细胞凋亡的影响△
冯冬梅 朱鸿 施彩虹
CXCR3、IP-10对高糖诱导的人脐静脉内皮细胞凋亡的影响△
冯冬梅 朱鸿 施彩虹
CXCR3;IP-10;人脐静脉内皮细胞;凋亡;肽核酸;AMG487
目的研究CXCR3及IP-10对高糖诱导的人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)凋亡的影响,并对其机制进行初步探讨。方法HUVEC在高糖和正常糖DMEM培养液中分别培养24 h、48 h、72 h,流式细胞术检测凋亡率,Western blot检测CXCR3表达。反义肽核酸(asPNA)阻断高糖组细胞表达CXCR3后,Western blot检测CXCR3表达,流式细胞术检测凋亡率。CXCR3配体IP-10及拮抗剂AMG487干预高糖组细胞48 h后,流式细胞术检测凋亡率。结果高糖组48 h、72 h时细胞凋亡率(22.56±1.83)%、(25.33±2.34)%较对照组(3.01±0.27)%、(3.80±0.32)%增加显著(均为P<0.01)。高糖组48 h、72 h CXCR3表达量0.57±0.04、0.87±0.03较对照组48 h 0.36±0.02、0.71±0.02明显上调(P<0.01、<0.05)。1 μmol·L-1asPNA CXCR3组、2 μmol·L-1asPNA CXCR3组CXCR3表达量0.32±0.02、0.14±0.02均较空白对照组(0.61±0.02)及阴性对照组(0.59±0.03)显著下降(均为P<0.01)。同时,1 μmol·L-1asPNA CXCR3组、2 μmol·L-1asPNA CXCR3组细胞凋亡率(15.33±1.05)%、(9.00±0.76)%也较空白对照组(22.98±1.92)%及阴性对照组(21.34±1.73)%明显下降(均为P<0.01)。IP-10组细胞凋亡率(38.05±2.88)%较高糖对照组(21.11±2.02)%、IP-10+AMG487组(20.80±2.17)%及AMG487组(19.54±1.93)%显著增加(均为P<0.01)。结论CXCR3、IP-10促进高糖诱导的HUVEC凋亡,其促凋亡机制与IP-10/CXCR3轴有关。
[眼科新进展,2014,34(7):628-632]
糖尿病视网膜病变(diabetic retinopathy,DR)是一种由长期慢性高血糖作为始因,多种炎性细胞及炎性因子介导的慢性低度炎症性疾病[1]。DR中视网膜血管内皮功能紊乱及新生血管的发生是由促血管生成因子和抑制血管生成因子失衡引起的。CXC族趋化因子及其受体在调控DR的血管内皮功能及新生血管中起重要作用。CXC趋化因子受体3(CXC chemokine receptor 3,CXCR3)及其配体—干扰素诱导蛋白10(interferon induced protein 10,IP-10)是ELR-CXC趋化家族成员,是较强的血管稳定因子,它可以通过抑制ELR+CXC趋化家族对内皮细胞的趋向性,抑制血管生成[2]。CXCR3在脉络膜新生血管病中可抑制新生血管生成,CXCR3缺乏型小鼠其脉络膜新生血管程度明显较野生型严重[3]。视网膜血管内皮细胞凋亡贯穿DR的发生发展,但CXCR3及IP-10对内皮细胞凋亡的具体影响目前报道甚少。反义肽核酸(antisense peptide nucleic acid,asPNA)技术是应用序列互补的反义DNA(asDNA)或反义RNA(asRNA)下调特异基因表达的应用技术。本研究通过体外培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)来观察高糖对其凋亡及表达CXCR3的影响,通过asPNA技术阻断CXCR3表达,研究CXCR3对HUVEC凋亡的影响;通过加入CXCR3配体IP-10及拮抗剂AMG487,研究IP-10对高糖诱导的HUVEC凋亡的影响,及IP-10/CXCR3轴在调控HUVEC凋亡方面的作用,为探讨DR中视网膜血管内皮细胞功能紊乱及寻求控制DR后期新生血管方法可提供一定的实验依据。
1 材料与方法
1.1主要材料HUVEC细胞株(ATCC CRL-2873)购自中国上海细胞生物研究所;DMEM培养基(含葡萄糖5.5 mmol·L-1、30.0 mmol·L-1)、2.5 g·L-1胰蛋白酶均为美国Gibco公司产品;胎牛血清购自美国Hyclone公司;Annexin V-FITC/PI 双染细胞凋亡检测试剂盒购自瑞士Roche公司;CXCR3单抗购自美国Santa Cruz公司;CXCR3反义肽核酸(asPNA CXCR3)及随机错配肽核酸序列参照文献[4],委托成都派德生物技术有限公司合成,asPNA CXCR3序列为:884(5’-Tyr-ACGTGGCTTTTTCG-Lys-3’)871,随机错配肽核酸序列为:Tyr-TTTCCAGCTGCTTT-Lys;人重组IP-10购自英国Abcam公司;CXCR3拮抗剂AMG487为美国安进公司产品。
1.2方法
1.2.1细胞培养HUVEC常规培养在含5 mL体积分数10%胎牛血清的DMEM(葡萄糖5.5 mmol·L-1)培养液中,置于37℃、体积分数5%CO2饱和湿度培养箱内,细胞每2 d换液1次,每3~4 d传代1次,细胞融合80%左右时以2.5 g·L-1胰蛋白酶消化收集细胞,以14进行传代,取传3代左右的对数期细胞用于实验。
1.2.2AnnexinV-FITC/PI双染流式细胞术检测细胞凋亡率取处理后的细胞,2.5 g·L-1胰蛋白酶消化并离心收集细胞(1000 r·min-1),PBS 1 mL洗涤1次,离心,Annexin V-FITC/PI试剂盒中的缓冲液重悬细胞,调整细胞密度为106mL-1,取0.5 mL细胞悬液,按试剂盒说明分别加入Annexin V-FITC溶液和PI溶液,室温避光孵育20 min,于1 h内用流式细胞仪检测细胞凋亡率,汞激发波长488 nm,计数10 000个细胞。细胞凋亡率=早期凋亡细胞数/所测总细胞数×100%。实验重复3次,取平均值。
1.2.3Westernblot检测CXCR3蛋白的表达培养的细胞弃培养液,用PBS洗2遍。加入裂解液充分混匀,冰上裂解30 min。裂解细胞刮下后移入EP管中离心(4 ℃、12 000 r·min-1),弃沉淀,上清中加入Loading Buffer(与裂解液比为14),于100 ℃煮沸5 min,离心放置后备用。将提取的细胞总蛋白进行十二烷基硫酸钠—聚丙烯酰胺凝胶电泳。电泳结束后,取下凝胶,将电泳产物电转移至PVDF膜上。以含50 g·L-1脱脂奶粉的TBST液封闭2 h,加入CXCR3一抗(11000),4 ℃摇床孵育过夜;TBST洗膜3次,每次10 min,加入二抗(12000),室温孵育1 h;BST洗膜2次,各10 min,TBS洗1次10 min,加入增强化学发光试剂ECL,于暗室曝光仪中曝光显影。GAPDH作为内参照(14000)同时进行上述步骤。蛋白表达的灰度值用Quantity One软件进行分析。实验重复3次,取平均值。
1.2.4高糖对HUVEC凋亡及CXCR3表达的影响细胞以3×105mL-1接种至6 cm培养皿中,分为两组,分别用5.5 mmol·L-1葡萄糖(对照组)及30.0 mmol·L-1葡萄糖(高糖组)培养,于24 h、48 h、72 h后收集两组细胞。Annexin V-FITC/PI流式细胞术检测各组HUVEC的凋亡率,Western blot检测各组CXCR3蛋白的表达。
1.2.5asPNA阻断细胞表达CXCR3对HUVEC凋亡的影响对数生长期的HUVEC以3×105mL-1密度接种至6 cm培养皿中,待细胞融合达到80%左右时,分别给予下述分组处理:(1)空白对照组:加5 mL高糖培养液;(2)阴性对照组:5 mL高糖培养液中加入随机错配肽核酸(2 μmol·L-1);(3)asPNA CXCR3组:5 mL高糖培养液中分别加入不同剂量asPNA CXCR3:1 μmol·L-1(低剂量组)、2 μmol·L-1(高剂量组)。以上4组于37 ℃、体积分数5%CO2孵育箱内培养24 h后更换新鲜高糖培养液继续孵育24 h。Western blot检测CXCR3蛋白的表达,Annexin V-FITC/PI流式细胞术检测细胞凋亡率。
1.2.6加入IP-10及AMG487对高糖诱导的HUVEC凋亡的影响HUVEC以3×105mL-1密度接种于6 cm培养皿中,待细胞融合达到80%左右时,分别给予下述分组处理:(1)高糖对照组:5 mL高糖培养液;(2)IP-10组:5 mL高糖培养液中加入IP-10(5 μg·L-1);(3)IP-10+AMG487组:5 mL高糖培养液中加IP-10(5 μg·L-1)及AMG487(10 μg·L-1);(4)AMG487组:5 mL高糖培养液中加AMG487(10 μg·L-1)。以上4组孵育48 h后,Annexin V-FITC/PI流式细胞术检测细胞凋亡率。
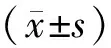
2 结果
2.1高糖对HUVEC凋亡及对CXCR3表达的影响流式散点图显示(图1):高糖组、对照组24 h HUVEC凋亡率分别为(5.78±0.43)%、(2.75±0.19)%;48 h分别为(22.56±1.83)%、(3.01±0.27)%;72 h分别为(25.33±2.34)%、(3.80±0.32)%。高糖组24 h较对照组细胞凋亡率稍增高,但差异无统计学意义(P>0.05);高糖组48 h、72 h与对照组相比,细胞凋亡率显著增加,差异均有统计学意义(均为P<0.01)。表明高糖促进HUVEC的凋亡,以作用48 h后显著。
Western blot结果显示(图2):高糖组、对照组24 h CXCR3的相对表达量分别为0.26±0.02、0.22±0.03;48 h分别为0.57±0.04、0.36±0.02;72 h分别为0.87±0.03、0.71±0.02;高糖组24 h较对照组CXCR3的相对表达量稍增高,但差异无统计学意义(P>0.05)。高糖组48 h、72 h与对照组相比,CXCR3的相对表达量显著增加,差异均有统计学意义(P<0.01、<0.05)。以上结果表明,高糖使CXCR3表达上调,且与上述高糖促进细胞凋亡趋势相同,提示CXCR3可能参与HUVEC凋亡的过程。
2.2asPNA阻断细胞表达CXCR3对HUVEC凋亡的影响Western blot结果显示(图3):空白对照组、阴性对照组、1 μmol·L-1asPNA CXCR3组CXCR3相对表达量分别为0.61±0.02、0.59±0.03、0.32±0.02、0.14±0.02。阴性对照组CXCR3相对表达量与空白对照组相比,差异不显著(P>0.05);asPNA CXCR3组较空白对照组及阴性对照组的CXCR3相对表达量下降,差异均有统计学意义(均为P<0.01)。且不同浓度(1 μmol·L-1、2 μmol·L-1)asPNA CXCR3干预后,CXCR3相对表达量呈下降趋势,两者差异有统计学意义(P<0.01)。说明asPNA CXCR3成功阻断CXCR3表达。
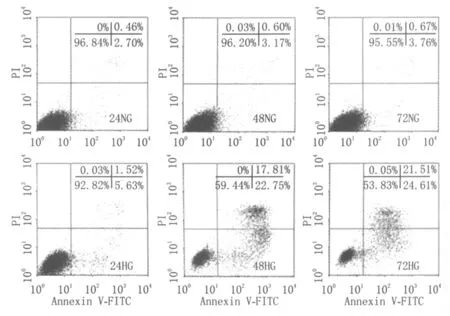
Figure 1 Effects of high glucose on apoptosis of HUVEC at different time 不同时间点高糖对HUVEC凋亡的影响
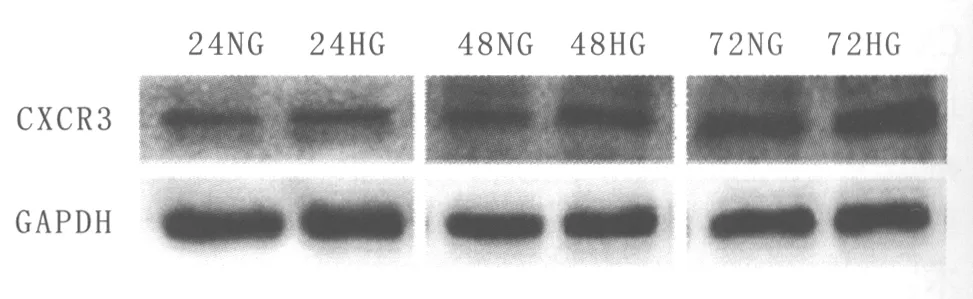
Figure 2 Effects of high glucose on CXCR3 expression of HUVEC at different time 不同时间点高糖对HUVEC 表达CXCR3的影响
Figure 3 asPNA CXCR3 blocking CXCR3 expression of HUVEC.A:Blank control group;B:Negative control group;C:1 μmol·L-1 as PNA CXCR3 group;D:2 μmol·L-1 as PNA CXCR3 group asPNA阻断HUVEC表达CXCR3。A:空白对照组;B:阴性对照组;C:1 μmol·L-1 asPNA CXCR3 组;D:2 μmol·L-1 asPNA CXCR3组
图4为流式散点图结果:空白对照组、阴性对照组、1 μmol·L-1asPNA CXCR3组、2 μmol·L-1asPNA CXCR3组的细胞凋亡率分别为(22.98±1.92)%、(21.34±1.73)%、(15.33±1.05)%、(9.00±0.76)%。阴性对照组与空白对照组比较,差异无统计学意义(P>0.05);asPNA CXCR3组的细胞凋亡率较空白对照组及阴性对照组下降,差异均有统计学意义(均为P<0.01);2 μmol·L-1asPNA CXCR3组较1 μmol·L-1asPNA CXCR3组细胞凋亡率下降,差异有统计学意义(P<0.01)。以上结果表明,asPNA CXCR3在下调CXCR3蛋白的同时伴有细胞凋亡率的降低,提示CXCR3表达与细胞凋亡呈正相关。
2.3IP-10及AMG487对高糖诱导的HUVEC凋亡的影响图5为流式散点图结果:高糖对照组、IP-10组、IP-10+AMG487组、AMG487组HUVEC的凋亡率分别为(21.11±2.02)%、(38.05±2.88)%、(20.80±2.17)%、(19.54±1.93)%。IP-10组较其他3组细胞凋亡率增加,差异均有统计学意义(均为P<0.01);IP-10+AMG487组、AMG487组及高糖对照组之间,差异均无统计学意义(均为P>0.05)。
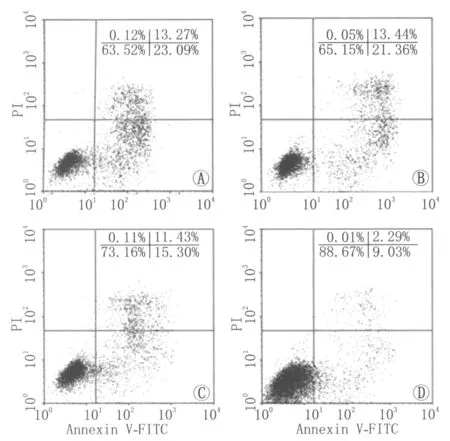
Figure 4 Effects of asPNA CXCR3 on apoptotic rate of HUVEC.A:Blank control group;B:Negative control group;C:1 μmol·L-1 as PNA CXCR3 group;D:2 μmol·L-1 as PNA CXCR3 group asPNA CXCR3对HUVEC凋亡率的影响。A:空白对照组;B:阴性对照组;C:1 μmol·L-1 asPNA CXCR3 组;D:2 μmol·L-1 asPNA CXCR3组
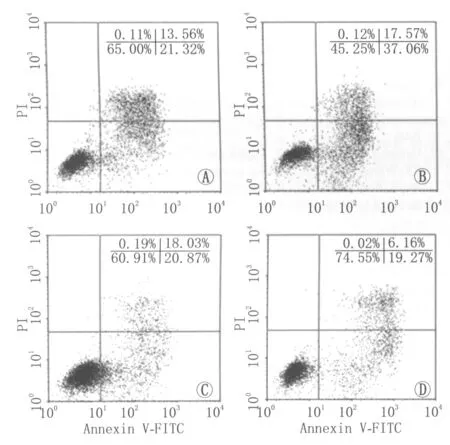
Figure 5 Effects of IP-10 and AMG487 on apoptosis of HUVEC induced by high glucose.A:High glucose control group;B:IP-10 group;C:IP-10+AMG487 group;D:AMG487 group IP-10及AMG487对高糖诱导的HUVEC凋亡的影响。A:高糖对照组;B:IP-10组;C:IP-10+AMG487组;D:AMG487组
3 讨论
血管内皮细胞体外培养是研究人体血管功能紊乱性疾病的重要手段。1973年Jaffe等[5]首次实施HUVEC的体外培养,现已成为国内外研究糖尿病血管并发症、新生血管性疾病及肿瘤的主要内皮细胞来源。本实验结果显示,高糖组HUVEC的凋亡率增加,且在 48 h后凋亡率增加明显,具有一定的时间依赖性,这与国内外众多研究结果一致[6-7],可见高浓度葡萄糖对HUVEC有毒性作用,而且具有一定的时间依赖性。Western blot结果显示各组HUVEC中CXCR3均有基础表达,在高糖组出现CXCR3表达上调。动物实验方面,El-Asrar等[8]在DR大鼠前膜中检测到CXCR3的高表达。本课题组前期研究证明糖尿病组大鼠视网膜中CXCR3蛋白表达量均高于对照组,同时免疫组织化学染色显示CXCR3在血管周围可见强阳性异染颗粒[9]。本研究中高浓度葡萄糖引起HUVEC的凋亡增加,同时高糖还触发CXCR3蛋白高表达,两者受高糖刺激变化趋势相同,推测CXCR3与细胞凋亡之间或许存在某种调控关系。
肽核酸是化学合成的、以肽键(NH-CO)替代核酸天然骨架3’,5’-磷酸二酯键的核酸类似物。由于细胞机制不能识别这种非自然的骨架,也不能将其降解,从而使其能长期、稳定地存在于细胞中。asPNA是核酸链互补的PNA,对基因的复制、转录和翻译有明显影响。asPNA CXCR3是针对CXCR3转录区的反义肽核酸,可抑制mRNA CXCR3的转录。本研究中将asPNA CXCR3加入高糖培养的HUVEC中,发现asPNA CXCR3在阻断HUVEC表达CXCR3蛋白的同时伴有细胞凋亡率下降,且随浓度增加CXCR3蛋白表达较少,细胞凋亡率有降低趋势。提示CXCR3表达与HUVEC的凋亡呈正相关,CXCR3可能是高糖调控内皮细胞凋亡的一个靶点,在凋亡中起重要作用。高糖引起CXCR3表达增高,继而引起内皮细胞凋亡增加,从某种程度上可解释DR早期视网膜血管通透性增加及血管渗漏现象。一般认为血管的通透性增高是由于内皮细胞内钙离子浓度增加后导致内皮细胞收缩所引起,Kockx等[10]研究表明:血管内皮细胞凋亡也是血管通透性增加的原因之一,内皮细胞凋亡在血管功能紊乱中起着重要作用,内皮细胞凋亡使血管结构异常,局部血管壁薄弱,在一定程度上也促进微动脉瘤的形成。Antonelli等[11]研究发现糖尿病患者和健康人相比,其血清CXCL10水平明显升高,而随访16个月后,明显降低。曾凤彦等[12]通过检测不同病程糖尿病患者血清CXCL10及CXCR3水平证实:CXCL10及CXCR3水平与糖尿病病程呈负相关。Goczalik等[13]报道PDR患者和大鼠的视网膜神经胶质细胞以及人的Müller细胞显著表达CXCR1和CXCR2,它们在增殖性视网膜微血管病变中参与新生血管的形成。Singh等[14]发现敲除CXCR1及CXCR2基因后,血管内皮细胞凋亡显著增加,推测CXCR1及CXCR2在血管新生中的作用可通过拮抗血管内皮细胞凋亡途径来实现。本课题组前期的研究也证实:ELR+CXC趋化因子家族的CXCR1、CXCR2、CXCR4及ELR-CXC趋化因子家族CXCR3在糖尿病大鼠的视网膜中均出现高表达[9],推测在DR的发展过程中,CXC趋化因子家族表达增加,初期ELR-CXC趋化因子家族表达增加占上峰,在趋化免疫细胞介导视网膜炎症反应的同时,也促进血管内皮细胞的凋亡,对血管的抑制调控大于增殖调控,表现为血管渗漏及微动脉瘤形成;随着疾病的进展,机体对长期高血糖刺激耐受,使机体长期处于慢性炎症状态,ELR+CXC趋化家族的高表达占上峰,血管生成大于抑制,形成新生血管,最终进展到PDR。
AMG487在多种生物中能有效阻断CXCR3的激活,据报道其浓度为0.008 μmol·L-1就能阻断50% IP-10与CXCR3的结合[15]。本实验中用IP-10干预高糖培养的内皮细胞,Annexin V-FITC/PI双染法显示IP-10可增加高糖环境中内皮细胞凋亡,这一现象可被CXCR3拮抗剂AMG487阻断。AMG487在拮抗了CXCR3受体时,IP-10对高糖环境下HUVEC凋亡的诱导作用也被阻断,提示IP-10是通过与CXCR3结合增加细胞凋亡的,IP-10/CXCR3轴参与调节高糖诱导的内皮细胞凋亡过程。Fujimura等[16]应用激光法诱导小鼠脉络膜产生新生血管,在此过程中发现CXCR3表达上调,应用免疫组织化学方法定位检测到CXCR3表达于脉络膜血管内皮上,予CXCR3和IP-10中和抗体干预并以Real-time法检测,发现新生血管面积增加,提示CXCR3及IP-10可抑制新生血管形成。Green等[17]研究发现,CXCR3中和抗体和基因沉默可抑制IP-10诱导的人及鼠的肺微血管内皮细胞凋亡,这充分说明IP-10需通过与CXCR3结合发挥抗血管作用,提示阻断IP-10/CXCR3轴可能是调控DR早期视网膜血管渗漏及血管瘤的新靶点。
1 Tang J,Kern TS.Inflammation in diabetic retinopathy[J].ProgRetinEyeRes,2011,30(5):343-358.
2 Balestrieri ML,Balestrieri A,Mancini FP,Napoil C.Understanding the immunoangiostatic CXC chemokine network[J].CardiovascRes,2008,78(2):250-256.
3 Fujimura S,Takahashi H,Yuda K,Ueta T,Iriyama A,Inoue T,etal.Angiostatic effect of CXCR3 expressed on choroidal neovascularization[J].InvestOphthalmolVisSci,2012,53(4):1999-2006.
4 Jiankuo M,Xingbing W,Baojun H,Xiongwin W,Zhuoya L,Ping X,etal.Peptide nucleic acid antisense prolongs skin allograft survival by means of blockade of CXCR3 expression directing T cells into graft[J].JImmunol,2003,170(3):1556-1565.
5 Jaffe EA,Nachman RL,Becker CG,Minick CR.Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria[J].JClinInvest,1973,52(11):2745-2756.
6 Knott RM,Muckersie E,Robertson M,Forrester JV.Glucose-dependent regulation of DNA synthesis in bovine retinal endothelial cells[J].CurrEyeRes,1998,17(1):1-8.
7 Kamal K,Du W,Mills I,Sumpio BE.Antiproliferative effect of elevated glucose in human microvascular endothelial cells[J].JCellBiochem,1998,71(4):491-501.
8 El-Asrar AMA,Struyf S,Kangave D,Geboes K,Van Damme J.Chemokines in proliferative diabetic retinopathy and proliferative vitreoretinopathy[J].EurCytokineNetw,2006,17(3):155-165.
9 曹海静,朱鸿,施彩虹.CXC族趋化因子受体在糖尿病大鼠视网膜中的表达研究[J].上海交通大学学报,2013,33(5):611-618.
10 Kockx MM,Knaapen MW.The role of apoptosis in vascular disease[J].JPathol,2000,190(3):267-280.
11 Antonelli A,Fallahi P,Ferrari SM,Pupilli C,d’Annunzio G,Lorini R,etal.Serum Th1(CXCL10)and Th2 (CCL2)chemokine levels in children with newly diagnosed Type 1 diabetes:a longitudinal study[J].DiabetMed,2008,25(11):1349-1353.
12 曾凤彦,宋文惠,陈晓娟,冯梅,闫冰梅,刘彩云,等.CXC趋化因子配体10及其受体在1型糖尿病患者血中水平的变化[J].中华内分泌代谢杂志,2013,29(1):35-36.
13 Goczalik I,Ulbricht E,Hollborn M,Raap M,Uhlmann S,Weick M,etal.Expression of CXCL8,CXCR1,and CXCR2 in neurons and glial cells of the human and rabbit retina[J].InvestOphthalmolVisSci,2008,49(10):4578-4589.
14 Singh S,Wu S,Varney M,Singh AP,Singh RK.CXCR1 and CXCR2 silencing modulates CXCL8-dependent endothelial cell proliferation,migration and capillary-like structure formation[J].MicrovascRes,2011,82(3):318-325.
15 Johnson M,Li AR,Liu J,Fu Z,Zhu L,Miao S,etal.Discovery and optimization of a series of quinazolinone-derived antagonists of CXCR3[J].BioorgMedChemLett,2007,17(12):3339-3343.
16 Fujimura S,Takahashi H,Yuda K,Ueta T,Iriyama A,Inoue T,etal.Angiostatic effect of CXCR3 expressed on choroidal neovascularization[J].InvestOphthalmolVisSci,2012,53(4):1999-2006.
17 Green LA,Petrusca D,Rajashekhar G,Gianaris T,Schweitzer KS,Wang L,etal.Cigarette smoke-induced CXCR3 receptor up-regulation mediates endothelial apoptosis[J].AmJRespCellMol,2012,47(6):807-814.
date:Feb 21,2014
Natural Science Foundation of Shanghai (No:10ZR-1418500);Shanghai Leading Academic Discipline Project (No:S30205)From theShanghai3rdPeople’sHospital,SchoolofMedicine,ShanghaiJiaotongUniversity(FENG Dong-Mei,SHI Cai-Hong),Shanghai201999,China;FirstPeople’sHospitalAffiliatedwithSchoolofMedicine,ShanghaiJiaotongUniversity(ZHU Hong),Shanghai200080,China
Effects of CXCR3 and IP-10 on apoptosis of human umbilical vein endothelial cells induced by high glucose
FENG Dong-Mei,ZHU Hong,SHI Cai-Hong
CXCR3;IP-10;human umbilical vein endothelial cell;apoptosis;peptide nucleic acid;AMG487
ObjectiveTo investigate the effects of CXC chemokine receptor 3(CXCR3) and interferon induced protein 10(IP-10) on apoptosis of human umbilical vein endothelial cells(HUVEC) induced by high glucose,and preliminary probe the apoptosis mechanism.MethodsHUVEC were cultured respectively in high glucose and normal glucose DMEM medium for 24 hours,48 hours and 72 hours.Flow cytometry was used to detect the apoptotic rate.The expression of CXCR3 was tested by Western blot.The expression of CXCR3 was blocked by antisense peptide nucleic acid (asPNA) in high glucose group,then expression of CXCR3 was tested by Western blot,flow cytometry was used to detect the apoptotic rate.HUVEC cultured in high glucose group were intervened with CXCR3’s ligand(IP-10)and antagonist(AMG487)for 48 hours,then flow cytometry was used to detect the apoptotic rate.ResultsThe apoptotic rate of high glucose group at 48 hours (22.56±1.83)% and 72 hours (25.33±2.34)% were significantly higher than (3.01±0.27)% and 72h group (3.80±0.32)% of normal glucose group (bothP<0.01).And CXCR3 expression of high glucose group at 48 hours (0.57±0.04) and 72 hours (0.87±0.03) were obviously higher than those of normal glucose group at 48 hours (0.36±0.02) and 72 hours (0.71±0.02) (P<0.01,<0.05).CXCR3 expression of asPNA CXCR3 1 μmol·L-1(0.32±0.02) and 2 μmol·L-1group (0.14±0.02) was drastically down-regulated (allP<0.01),compared with blank control (0.61±0.02) and negative control group (0.59±0.026).At the same time,the apoptotic rate of asPNA CXCR3 1 μmol·L-1(15.33±1.05)% and 2 μmol·L-1group (9.00±0.76)% was markedly lower than that of blank control (22.98±1.92)% and negative control group (21.34±1.73)% (allP<0.01).The apoptotic rate of IP-10 group (38.05±2.88)% was significantly higher than that of high glucose group (21.11±2.02)%,IP-10+AMG487 (20.80±2.17)% and AMG487 group (19.54 ±1.93)% (allP<0.01).ConclusionCXCR3 and IP-10 promote the apoptosis of HUVEC induced by high glucose,and the promoting apoptosis mechanism of them is related to IP-10/CXCR3 axis.
冯冬梅,女,1987年1月出生,江苏宿迁人,在读硕士研究生。联系电话:18817314163;E-mail:fdmsmile@163.com
AboutFENGDong-Mei:Female,born in January,1987.Postgraduate student.Tel:18817314163;E-mail:fdmsmile@163.com
2014-02-21
上海市科委自然科学基金资助(编号:10ZR1418500);上海市重点学科建设资助项目(编号:S30205)
201999 上海市,上海交通大学医学院附属第三人民医院(冯冬梅,施彩虹);200080 上海市,上海交通大学医学院附属第一人民医院(朱鸿)
施彩虹,E-mail:dr_caihong@126.com
冯冬梅,朱鸿,施彩虹.CXCR3、IP⁃10对高糖诱导的人脐静脉内皮细胞凋亡的影响[J].眼科新进展,2014,34(7):628⁃632.
10.13389/j.cnki.rao.2014.0172
【实验研究】
修回日期:2014-04-17
本文编辑:付中静
Accepteddate:Apr 17,2014
Responsibleauthor:SHI Cai-Hong,E-mail:dr_caihong@126.com
[RecAdvOphthalmol,2014,34(7):628-632]

