Bax、Bcl-2在丙烯醛诱导的ARPE-19细胞凋亡中的作用△
邹秀兰 王观峰 皮荣标 李文立 俞永珍 邹玉平
Bax、Bcl-2在丙烯醛诱导的ARPE-19细胞凋亡中的作用△
邹秀兰 王观峰 皮荣标 李文立 俞永珍 邹玉平
丙烯醛;ARPE-19细胞;细胞凋亡;Bax;Bcl-2;
目的观察Bax、Bcl-2蛋白在丙烯醛诱导的体外培养ARPE-19细胞凋亡中的作用。方法将培养的ARPE-19细胞置于含有体积分数10%胎牛血清的完全培养基中,于37 ℃、体积分数5%CO2培养箱孵育;用不同浓度(50 μmol·L-1、100 μmol·L-1)丙烯醛处理对数期培养的ARPE-19细胞24 h,设不加药的空白对照组,用流式细胞仪检测丙烯醛诱导ARPE-19细胞的凋亡情况,Western blot检测ARPE-19细胞中Bax、Bcl-2蛋白的表达情况。结果流式细胞仪显示,早期在空白对照组中细胞凋亡率为2.97%,50 μmol·L-1丙烯醛处理组中为4.67%,100 μmol·L-1丙烯醛处理组中为50.07%;晚期凋亡细胞在空白对照组中细胞凋亡率为1.66%,50 μmol·L-1丙烯醛处理组中为24.24%,100 μmol·L-1丙烯醛处理组中为6.77%。Western blot显示空白对照组的Bax/Bcl-2蛋白表达的比值为0.293 9,50 μmol·L-1丙烯醛处理组的Bax/Bcl-2蛋白表达的比值为1.389 2,100 μmol·L-1丙烯醛处理组的Bax/Bcl-2蛋白表达的比值为1.496 1。结论丙烯醛可以通过激活凋亡蛋白Bax及抑制抗凋亡蛋白Bcl-2的表达来导致ARPE-19细胞凋亡。
[眼科新进展,2014,34(7):633-636]
我们和其他研究人员前期研究发现,丙烯醛可以导致人视网膜色素上皮(human retinal pigment epithelial-19,ARPE-19)细胞数量明显减少、肿胀、坏死或染色体聚集、胞浆收缩、胞膜出芽等,目前的研究尚不能证明是何种路径介导这一损伤过程[1-7]。近期国内外研究发现丙烯醛可以激活大量活性氧簇(reactive oxygen species,ROS)、活性氧自由基,促进氧自由基反应干扰细胞内的氧化磷酸化过程,损伤生物膜系统、氨基酸、DNA、RNA等;氧自由基反应作为信号分子参与了凋亡基因的表达与凋亡蛋白的激活[8-12]。本研究在前期研究的基础上,拟通过丙烯醛诱导ARPE-19细胞的凋亡模型,初步探讨Bax、Bcl-2蛋白在该细胞凋亡中的作用。
1 材料与方法
1.1材料与仪器ARPE-19细胞株、丙烯醛由中山大学药学院提供;胰蛋白酶购自美国Sigma公司,改良Eagle培养基DMEM和胎牛血清购自美国Gibco公司;ECL化学发光试剂盒购自美国PIERCE公司,丙烯酰胺(Acrylamide)购自美国B.M.公司;四甲基乙二胺购自美国B.M.公司,POVEF膜购自美国BIO-RAD公司;X光片购自日本KODAK公司;其他仪器包括倒置相差显微镜(Leica,德国)、流式细胞仪(Beckman Coulter,美国)、Eppendorf恒温振荡仪(Eppendorf公司,美国)、MiniSpin台式离心机(Eppendorf公司,美国)、450型全波长多功能酶标仪(Eppendorf公司,美国)、Tanon凝胶成像系统(TANON公司,中国上海)。
1.2实验方法
1.2.1实验分组丙烯醛使用前要立即溶解到无血清的DMEM-F12培养液中。待培养板中的单层ARPE-19细胞长满底部约70%时,用不含血清的培养液继续培养24 h 后(即按血清饥饿法),将培养细胞分为:空白对照组,不加任何药物;不同浓度丙烯醛处理组,培养细胞中加入丙烯醛(终浓度为50 μmol·L-1、100 μmol·L-1)处理24 h。
1.2.2流式细胞仪检测凋亡细胞无菌超净台内进行ARPE-19细胞的培养及6孔板的铺板。将ARPE-19细胞以含体积分数10%胎牛血清的完全培养基重悬,调整细胞密度为109L-1,3 mL接种于6孔细胞培养板。第3天吸去原液,每孔再给予3 mL无血清DMEM-F12培养基。第4天每孔吸去原液,每孔再按上述实验分组给予不同浓度的药物处理。待药物丙烯醛作用24 h后,将细胞培养板中各组的培养基分别转移到位于冰上的15 mL锥形管内,用PBS溶液进行重悬,0.5 mL 2.5 g·L-1Trpsin(不含EDTA)消化细胞;收集各组培养板上的细胞,并用预冷的PBS缓冲液重悬,维持细胞密度在109L-1左右;每组离心管内取0.5 mL细胞重悬液,加入1.25 μL Annexin V-FITC,18~24 ℃室温避光反应15 min,室温下1000 r·min-1离心5 min,用0.5 mL预冷缓冲液轻轻重悬细胞,加入10 μL Propidium Iodide;立即将样品放入冰盒内保存,并送往检测中心进行检测。
1.2.3Westernblot检测Bax、Bcl-2蛋白的表达按照说明书中的程序和方法检测Bax和Bcl-2蛋白的表达情况。
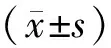
2 结果
2.1细胞凋亡情况正常细胞在空白对照组中所占比例94.80%,50 μmol·L-1丙烯醛处理组中为60.98%,100 μmol·L-1丙烯醛处理组中为42.58%;与正常对照组相比,50 μmol·L-1丙烯醛处理组中的正常细胞数明显下降(P=0.000 1)。早期空白对照组中细胞凋亡率为2.97%,50 μmol·L-1丙烯醛处理组中为4.67%,100 μmol·L-1丙烯醛处理组中为50.07%;与空白对照组相比,50 μmol·L-1丙烯醛处理组中的早期凋亡细胞数明显上升(P=0.001)。晚期空白对照组中细胞凋亡率为1.66%,50 μmol·L-1丙烯醛处理组中为24.24%,100 μmol·L-1丙烯醛处理组中为6.77%;与空白对照组相比,50 μmol·L-1丙烯醛处理组中的晚期凋亡细胞数明显上升(P=0.000 1)。总凋亡率在空白对照组中为4.63%,50 μmol·L-1丙烯醛处理组中为28.91%,100 μmol·L-1丙烯醛处理组中为56.84%;与空白对照组相比,50 μmol·L-1丙烯醛处理组中的总凋亡细胞数明显上升(P=0.000 1),见图1。

Figure 1 Apoptotic cells detected by flow cytometry.A:Blank control group;B:50 μmol·L-1 acrolein group for 24 hours;C:100 μmol·L-1 acrolein group for 24 hours 流式细胞仪检测凋亡细胞情况。A:空白对照组中ARPE-19凋亡细胞;B:50 μmol·L-1丙烯醛作用24 h后ARPE-19凋亡细胞;C:100 μmol·L-1丙烯醛作用24 h后ARPE-19凋亡细胞
2.2Westernblot检测ARPE-19细胞Bax、Bcl-2表达情况利用人源性多克隆抗体检测Bax与Bcl-2蛋白在ARPE-19细胞中的表达情况,结果如图2所示;空白对照组的Bax/Bcl-2蛋白表达的比值为0.293 9,50 μmol·L-1丙烯醛处理组的Bax/Bcl-2蛋白表达的比值为1.389 2,100 μmol·L-1丙烯醛处理组的Bax/Bcl-2蛋白表达的比值为1.496 1。与空白对照组相比,50 μmol·L-1丙烯醛处理组的Bax/Bcl-2蛋白表达显著升高。
3 讨论
在丙烯醛诱导ARPE-19细胞凋亡的研究中,国外学者就发现有大量ROS、氧自由基、一氧化氮(nitrogen monoxide,NO)等形成。我们在早期研究中已证实50 μmol·L-1丙烯醛可以导致ARPE-19细胞的大量损伤,其可能与以下因素有关:(1)ROS的增高可以降低细胞内抗氧化剂的量导致细胞凋亡形态学特征的出现,使用内源性或外源性抗氧化剂可以阻断细胞的凋亡过程,且细胞内ROS水平与细胞的凋亡水平成正相关。(2)在体内,氧自由基为含有很强活性的化学物质,能够损伤细胞内的蛋白质、核酸、脂肪等。基础研究表明,氧自由基反应是诸多生命化学反应的一个基本组成部分,同时也作为信号因子作用于凋亡信号通路来介导凋亡蛋白与凋亡基因的表达,从而影响细胞的代谢和细胞内环境。(3)作为氧自由基之一的NO就是一种神经转导信号因子。一氧化氮合酶(induce nitric oxide synthase,iNOS)的活化在NO诱导缺氧细胞发生凋亡上起着关键作用。在此病理过程中,iNOS的活化促进NO的生成及NO与O2·相互结合生成ONOO-。据此有学者认为NO和ONOO-可能是触发细胞凋亡的关键因子。(4)许多可以诱导细胞凋亡的其他理化因素同样也可以导致氧化应激的产生,如金属化合物、电离辐射和紫外线等[13-16]。

Figure 2 Expression of Bax and Bcl-2 protein detected by Western blot in each group Western blot检测各组Bax、Bcl-2蛋白表达情况
在后续实验中,我们发现随着丙烯醛浓度的升高,ARPE-19细胞的损伤增加,总凋亡细胞数也随之增高。我们认为作为真核生物细胞内氧化磷酸化和ATP合成,不仅为细胞提供能量,还参与了细胞分化、信息传递和凋亡等多种生命过程,且在调控细胞生长或转导、扩大细胞凋亡信号过程起到决定作用。作为细胞凋亡的内源性途径的上游,线粒体与半胱氨酸蛋白水解酶、下游的效应器之间连接。多种理化刺激因子均可以激活此凋亡途径。国外学者研究均发现丙烯醛可以介导线粒体跨膜电位的破坏,而后者已被公认是细胞凋亡级联反应发生的先兆之一。线粒体跨膜电位的破坏,也可以被看成是线粒体膜固有特性(如通透性等)的改变,继而使得线粒体内的多种氧自由基和其他活性物质进入细胞质内,导致“瀑布”样的凋亡过程[17-19]。我们的研究实验组50 μmol·L-1丙烯醛即可造成Bax/Bcl-2蛋白表达比值的显著提高,据此我们认为丙烯醛可能通过作用于多种理化因子,激活和上调Bcl-2族基因Bax/Bak凋亡蛋白的表达,影响甚至于逆转线粒体跨膜电位,导致细胞色素C的异常分泌。而后者可以激活细胞质内的凋亡蛋白酶激活因子、脱氧三磷酸腺苷等caspase前体激活物。这些前体激活物可以激活凋亡通路下游的caspases-3及caspases-7,最终使细胞产生凋亡。另外,丙烯醛也可以干扰转录因子NF-κB的生成,后者可以调节如抗凋亡Bcl-2家族、cLAP等抗凋亡基因的表达。我们考虑这种改变可能是由于相关凋亡蛋白的改变介导的线粒体“内源性”细胞凋亡。实验中我们还发现随着丙烯醛浓度提高,Bax/Bcl-2蛋白表达比值也进一步升高,但差异无统计学意义。这可能与50 μmol·L-1丙烯醛已经激活了“瀑布”样的细胞凋亡过程,而100 μmol·L-1丙烯醛在此基础上又引发了多种导致细胞死亡或凋亡信号通路有关。本研究目前仅从蛋白水平说明丙烯醛通过Bax/Bcl-2线粒体凋亡途径导致ARPE-19细胞损伤,为进一步探寻丙烯醛诱导ARPE-19细胞损伤的机理今后拟从基因水平及凋亡信号调节路径等进行深入研究。
1 王观峰,李文立,邹秀兰,邹玉平,皮荣标,姚敏.硫辛酸烟酸二联体对丙烯醛损伤ARPE-19细胞的保护作用[J].眼科新进展,2013,33(2):106-109.
2 Pons M,Marin-castano ME.Nicotine increases the VEGF/PEDF ratio in retinal pigment epithelium:a possible mechanism for CNV in passive smokers with AMD[J].InvestOphthalmolVisSci,2011,52(6):3824-3853.
3 Rabuka D,Rush JS,deHart GW,Wu P,Bertozzi CR.Site-specific chemical protein conjugation using genetically encoded aldehyde tags[J].NatProtoc,2012,7(6):1052-1067.
4 Perez JM,Arenas FA,Pradenas GA,Sandoval JM,Vasquez CC.Escherichia coli YqhD exhibits aldehyde reductase activity and protects from the harmful effect of lipid peroxidation-derived aldehydes[J].JBiolChem,2008,283(12):7346-7353.
5 Cassee FR,Groten JP,Feron VJ.Changes in the nasal epithelium of rats exposed by inhalation to mixtures of formaldehyde,acetaldehyde,and acrolein[J].FundamApplToxicol,1996,29(2):208-218.
6 Cassee FR,de Burbure CY,Rambali B,Vleeming W,van de Kuil A,van Steeq H,etal.Subchronic inhalation of mixtures of cigarette smoke constituents in Xpa-/-p53+/-knock-out mice:a comparison of intermittent with semi-continuous exposure to acetaldehyde,formaldehyde,and acrolein[J].FoodChemToxicol,2008,46(2):527-536.
7 Espinosa-Heidmann DG,Suner IJ,Catanuto P,Hernandez EP,Marin-Castano ME,Cousins SW.Cigarette smoke-related oxidants and the development of sub-RPE deposists in an experimental animal model of dry AMD[J].InvestOphthalmolVisSci,2006,47(2):729-737.
8 Zhang SY,Villalta PW,Wang MY,Hecht SS.Dection and quantitation of acrolein-derived1,N2-propanodeoxyguanosine adducts in human lung by liquid chromatography-electrospray ionization-tandem mass spectrometry[J].ChemResToxical,2007,20(6):565-571.
9 Pawiowicz AJ,Munter T,Klika KD,Kronberq L.Reaction of acrolein with 2′-deoxyadenosine and 9-ethyladenine-Formation of cyclic adducts[J].BiorganChem,2006,34(1):39-48.
10 Liu Z,Sun L,Zhu L,Jia X,Li X,Jia H,etal.Hydroxytyrosol protects retinal pigment epithelial cells from acrolein-induced oxidative stress and mitochondrial dysfunction[J].JNeurochem,2007,103(6):2690-2700.
11 Sheu SJ,Liu NC,Chen JL.Resveratrol protects human retinal pigment epithelial cells from acrolein-induced damage[J].JOculPharmacolTher,2010,26(3):231-236.
12 Feng Z,Liu Z,Li X,Jia H,Sun L,Tian C,etal.α-Tocopherol is an effective Phase Ⅱ enzyme inducer:protective effects on acrolein-induced oxidative stress and mitochondrial dysfunction in human retinal pigment epithelial cells[J].NutrBiochem,2010,21(12):1222-1231.
13 Macallister SL,Martin-Brisac N,Lau V,Yang K,O’Brien PJ.Acrolein and chloroacetaldehyde:An examination of the cell and cell-free biomarkers of toxicity[J].ChemBiolInteract,2013,202(1-3):259-266.
14 Borchers MT,Wessenlkamper SC,Deshmukh H,Beckman E,Medvedovic M,Sartor M,etal.The role of cells in the regulation of acrolein-induced pulmonary inflammation and epithelial-cell pathology[J].ResRepHealthEffInst,2009,146(1):5-29.
15 Lambert C,McCue J,Portas M,Ouyang Y,Li J,Rosano TG,etal.Acrolein in cigarette smoke inhibits T-cell responses[J].JAllergyClinImmunol,2005,116(4):916-922.
16 Swystun LL,Mukherjee S,Levine M,Liaw PC.The chemotherapy metabolite acrolein upregulates thrombin generation and impairs the protein C anticoagulant pathway in animal-based and cell-based models[J].JThrombHaemost,2011,9(4):767-775.
17 Yang ES,Woo SM,Choi KS,Kwon TK.Acrolein sensitizes human renal cancer Caki cells to TRAIL-induced apoptosis via ROS-mediated up-regulation of death receptro-5(DR5) and down-regulation of Bcl-2[J].ExpCellRes,2011,317(18):2592-2601.
18 Ozer H,Yenicesu G,Arici S,Cetin M,Tuncer E,Cetin A.Immunohistochemistry with apoptotic-antiapoptotic proteins(p53,p21,bax,bcl-2),c-kit,telomerase,and metallothionein as a diagnostic aid in benign,borderline,and malignant serous and mucinous ovarian tumors[J].DiaqnPathol,2012,7(1):124.
19 Zhai D,Jin C,Huang Z,Satterthwait AC,Reed JC.Differential regulation of Bax and Bak by anti-apoptotic Bcl-2 family proteins Bcl-B and Mcl-1[J].JBiolChem,2008,283(15):9580-9586.
date:Feb 27,2014
Guangdong Province Science and Technology Project(No:20120314)From theDepartmentofOphthalmology,GuangzhouGeneralHospitalofGuangzhouMilitaryCommand(ZOU Xiu-Lan,YU Yong-Zhen,ZOU Yu-Ping),Guangzhou510010,GuangdongProvince,China;DepartmentofOphthalmology,theThirdAffiliatedHospitalofGuangzhouMedicalUniversity(WANG Guan-Feng),Guangzhou510150,GuangdongProvince,China;DepartmentofPharmacologyandToxicology,SchoolofPharmaceuticalSciences,SunYat-SenUniversity(PI Rong-Biao),Guangzhou510006,GuangdongProvince,China;DiseasePreventionandControlCenterofGuangdongProvince(LI Wen-Li),Guangzhou510300,GuangdongProvince,China
Roles of Bax and Bcl-2 in ARPE-19 cell apoptosis induced by acrolein
ZOU Xiu-Lan,WANG Guan-Feng,PI Rong-Biao,LI Wen-Li,YU Yong-Zhen,ZOU Yu-Ping
acrolein;ARPE-19 cell;cell apoptosis;Bax;Bcl-2
ObjectiveTo observe the roles of Bax and Bcl-2 in ARPE-19 cells apoptosis induced by acrolein.MethodsThe ARPE-19 cells were cultured in medium,containing volumn fraction 10% fetal bovine serum,2.48 g·L-1sodium bicarbonate,100 U·mL-1penicillin and 100 μg·mL-1streptomycin,in the 37 ℃ incubator with volumn fraction 5% CO2.The cells were treated with acrolein (0 μmol·L-1,50 μmol·L-1and 100 μmol·L-1) for 24 hours,then the apoptotic cells was detected by flow cytometry,and the expression of Bcl-2 and Bax protein were detected by Western blot.ResultsEarly apoptosis cell rate was 2.97% in blank control group,4.67% in 50 μmol·L-1acrolein group and 50.07% in 100 μmol·L-1acrolein group.Late apoptotic cell rate were 1.66%,24.24%,6.77% in blank control group,50 μmol·L-1acrolein group and 100 μmol·L-1acrolein group,respectively.The ratio expression of Bax/Bcl-2 was 0.293 9,1.389 2,1.496 1 in blank control group,50 μmol·L-1acrolein group and 100 μmol·L-1acrolein group,respectively.ConclusionThe apoptosis of ARPE-19 cells are induced by the up-expression of Bax and down-expression of Bcl-2 activated by acrolein.
邹秀兰,女,1967年10月出生,江西人,副主任医师兼科副主任。联系电话:15323363967;E-mail:xlzou 2003@yahoo.com.cn
作者简介:王观峰,男,1988年2月出生,江西人,住院医师。联系电话:13711090644;E-mail:306841512@qq.com
2014-02-27
广东省科技计划项目(编号:20120314)
510010 广东省广州市,广州军区广州总医院眼科(邹秀兰,俞永珍,邹玉平);510150 广东省广州市,广州医科大学附属第三医院眼科(王观峰);510006 广东省广州市,中山大学药学院药理学和毒理学研究室(皮荣标);510300 广东省广州市,广东省疾病预防控制中心(李文立)
邹玉平,E-mail:xlzou2003@yahoo.com.cn
邹秀兰,王观峰,皮荣标,李文立,俞永珍,邹玉平.Bax、Bcl⁃2在丙烯醛诱导的ARPE⁃19细胞凋亡中的作用[J].眼科新进展,2014,34(7):633⁃636.
10.13389/j.cnki.rao.2014.0173
【实验研究】
AboutZOUXiu-Lan:Female,born in October,1967.Tel:15323363967;E-mail:xlzou2003@yahoo.com.cn
AboutWANGGuan-Feng:Male,born in February,1988.Tel:13711090644;E-mail:306841512@qq.com
修回日期:2014-04-10
本文编辑:董建军
Accepteddate:Apr 10,2014
Responsibleauthor:ZOU Yu-Ping,E-mail:xlzou2003@yahoo.com.cn
[RecAdvOphthalmol,2014,34(7):633-636]

