雷公藤氯内酯醇对大鼠海马背侧注射Aβ25-35后胶质细胞及p38MAPK激活的抑制作用
王元伟,郑关毅,陈晓春,张 静,黄天文,叶 洪,潘晓东
(1.福建医科大学附属协和医院福建省老年医学研究所,福建福州 350001;2.江苏省沭阳县人民医院,江苏沭阳 223600)
阿尔采末病(Alzheimer’s disease,AD)的病因和发病机制尚未完全阐明,其中β淀粉样肽(Betaamyloid,Aβ)是 AD 形成和发展的关键因素[1],Aβ异常沉积导致的胶质细胞的活化及炎症反应可能在AD病理损伤中起着重要的作用。
雷公藤内酯醇是雷公藤的主要有效成分之一,是从卫矛科植物雷公藤分离出的一种环氧化二萜内酯化合物,有较强的抗炎及免疫抑制活性,雷公藤氯内酯醇(tripchlorolide,T4)是雷公藤内酯醇氯化后的产物,药理作用和雷公藤内酯醇相似,但是其不良反应较低,无致突变作用,且能通过血脑屏障[2],因而很可能有治疗AD的潜在价值。Aβ是由39~43个氨基酸组成的一种蛋白,其发挥毒性的主要部位在第25 -35氨基酸之间(Aβ25-35),Aβ25-35具有神经毒性,可使海马和隔区神经元发生凋亡[3]。因此本研究应用神经毒性较强的Aβ25-35片段海马背侧注射的方法建立大鼠模型,结合免疫组化、蛋白印迹、ELISA、Nissl染色和TUNEL染色等技术,探讨T4保护注射Aβ25-35后大鼠海马神经元损伤的作用与抑制小胶质细胞(microglia,MG)、星形胶质细胞(astrocyte,AS)和丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)中p38MAPK激活的关系。
1 材料与方法
1.1 动物 实验动物,♂ Sprauge-Dawley大鼠,由中国科学院上海实验动物中心提供(合格证号:SCXK沪2003-0003)。体质量220~270 g,自由饮食,室温22~25℃,每日光照12 h。
1.2 试剂及抗体 Aβ25-35购自 Sigma公司,β-actin单克隆抗体购自NeoMarkers公司,ox-42单克隆抗体购自德国Acris公司,GFAP单克隆抗体购自Neo-Markers公司,p-p38MAPK抗体购自 Santa Cruz公司,细胞凋亡检测试剂盒购自德国罗氏公司,TNF-α,IL-1β双抗夹心ELISA Kit及ELISA裂解液购自武汉博士德生物科技有限公司,即用型免疫组化试剂盒购自LAB VISION公司,Western blot化学发光检测试剂盒购自KPL公司。其他试剂均为国产分析纯。
1.3 凝聚态Aβ25-35的制备 1 mg Aβ25-35溶于100 μl灭菌生理盐水中,制成10 g·L-1浓度,密封后置于37℃细胞培养箱中5 d成凝聚态。
1.4 动物模型的建立与分组 实验随机分为,Aβ25-35模型组:在10%氯胺酮腹腔注射麻醉下,用脑立体定位仪(Stoelting USA)固定大鼠,取平颅头位,根据大鼠脑立体定位图谱,确定右(左)侧前囟后-3.8 mm、中线旁2.5 mm、颅骨表面下3.0 mm为右(左)海马背侧部,用1μl微量注射器5min内缓慢注入 Aβ25-351μl,予以留针5 min。术后给予青霉素钠盐10万单位肌注,分别于 d 1、d 2、d 4、d 7处死大鼠。T4处理组:模型制备前先腹腔内注射T4,每天1次,连续3 d,d 4海马背测注射 Aβ25-35制备模型,模型制备同时及其后继续给予腹腔内注射T4,每天 1 次,直到所规定的时间段 1、2、4、7 d 标本收集时为止。处理组依 T4剂量的不同(分别为5.0、10.0 和 20.0 μg·kg-1)分为 3 组。生理盐水注射组:腹腔内注射生理盐水。正常对照组:不做任何处理。本实验共分为对照组,生理盐水注射组,模型1 d、2 d、4 d、7 d组,每组 21 只,共 126 只;T4(5.0、10.0 和20.0 μg·kg-1)组,根据 Aβ25-35注射后取材时间的不同分为4个亚组,每组21只,共252只。以上各组各分总数的1/3大鼠用于相关染色计数阳性细胞,1/3用于蛋白印迹,1/3用于ELISA测定。正常组和假注组在d 1取材,余各组在规定的时间点 1、2、4、7 d 取材。
1.5 标本收集
1.5.1 组织学标本 大鼠用10%氯胺酮深麻醉,然后4%多聚甲醛300 ml进行左室快速注射内固定,取出脑组织,冠状切取视交叉和乳头体,留取中间组织块,继续浸泡于4%多聚甲醛中24 h。组织块经常规脱水、透明、浸蜡、包埋成蜡块,冠状切成厚2 μm薄片,主要用于免疫组织化学染色,Nissl染色和TUNEL染色。
1.5.2 组织匀浆的制备 大鼠经10%氯胺酮深麻醉后,以4℃生理盐水50 ml行左室灌洗,即刻断头取出海马。用于蛋白免疫印迹的标本,按1∶6加入匀浆缓冲液研磨成组织匀浆,10 000×g离心10 min,取上清,置-20℃冰箱贮存;用于 ELISA的标本,按1∶10加入ELISA裂解液研磨成组织匀浆,10 000×g离心10 min,取上清,置-20℃冰箱贮存。
1.5.3 TUNEL染色 细胞凋亡检测试剂盒购自德国罗氏公司。切片常规处理后,按说明书操作,细胞核呈棕黄色者为阳性细胞。
1.5.4 Nissl染色 组织切片常规脱蜡、逐级乙醇脱水及水洗,加入亚甲蓝染液浸泡10 min,0.2 mol·L-1乙酸盐(pH 4.6)分色2 min,阳性染色者胞核染色淡,胞质蓝染,即为存活的正常神经元。
1.5.5 免疫组织化学 切片常规脱蜡,3%H2O2阻断内源性过氧化物酶10 min,一抗(ox-42 1∶50、GFAP 1 ∶200、p-p38MAPK 1 ∶100)4℃孵育过夜,在室温下以生物素标记的二抗和SABC试剂(Ultravision Detection System)各浸泡30min,DAB显色,苏木精复染,脱水、透明、最后用中性树胶封固。阴性对照组PBS代替一抗进行上述操作。阳性细胞为胞质和突起呈棕黄色。
1.5.6 蛋白免疫印迹 用Bradford法对提取的标本进行蛋白定量。然后各取等量样品,加入等体积的2×上样缓冲液混匀,于100℃沸水中煮120 s,以10%SDS-聚丙烯酰胺凝胶电泳进行蛋白分离,分离的蛋白用半干电转移法转到PVDF膜,用封闭液(Protein detector Western blot kit,KPL 公司,USA)室温下封闭1 h,加入封闭液稀释的(1∶1 000)一抗pp38MAPK 4℃孵育过夜;洗涤液洗3×5 min,1×10 min;辣根过氧化物酶标记的二抗(1∶1 000稀释)孵育2 h,用化学发光法显色,X线底片曝光。以βactin为内参照。
1.5.7 ELISA 大鼠海马匀浆离心后取上清,根据试剂盒说明书所示的操作方法,用酶标仪测定样品在450 mm的吸光值(A450值),根据标准品的结果绘制标准曲线,直线回归分析,得出其直线回归方程。将测得的不同待检标本的A值代入相应的直线回归方程中,即可得TNF-α、IL-1β的含量。
1.6 统计学处理 阳性细胞计数:在高倍镜下计数海马CA1区5个非连续视野阳性细胞数之和为每例阳性细胞数,每组7例。实验结果以±s表示,SPSS 11.0软件包行单因素方差分析,方差齐者组间比较用LSD检验,方差不齐者用Games-Howell检验。
2 结果
2.1 T4对大鼠海马组织神经胶质细胞激活的影响如Fig 1所示,在模型组可观察到活化的小胶质细胞,随时间延长逐渐增多,以d 7数量最多,T4干预后,大鼠海马组织活化的小胶质细胞数量明显减少(7 d),以20 μg·kg-1组为明显,阳性细胞计数结果见Tab 1,说明T4对注射Aβ25-35后小胶质细胞的激活有抑制作用。
2.2 T4对大鼠海马组织星形胶质细胞激活的影响如Fig 2所示,在模型组可观察到活化的星形胶质细胞,胞体增大,突起变粗,染色较深,随时间延长逐渐增多,以d 7数量最多,T4干预后,大鼠海马组织活化的小胶质细胞数量明显减少(7 d),以20 μg·kg-1组明显,阳性细胞计数结果见Tab 1,说明T4对注射Aβ25-35后星形胶质细胞的激活有抑制作用。

Fig 1 Immunohistochemistry of rat hippocampal sections(CA1 area)with ox-42 antibody(×400)

Fig 2 Immunohistochemistry of rat hippocampal sections(CA1 area)with GFAP antibody(×400)

Tab 1 Positive results of ox-42,GFAP,p-p38MAPK
2.3 T4对大鼠海马组织p38MAPK激活的影响
2.3.1 免疫组织化学 如Fig 3所示,与正常组和生理盐水假注射组相比较模型组观察到大量的pp38MAPK阳性细胞,以d 7模型组数量最多,T4处理后,与模型组相比,大鼠海马组织p-p38MAPK阳性细胞数量逐渐减少(7 d),以 20 μg·kg-1组为明显,阳性细胞计数结果见Tab 1,说明T4在此剂量范围内以时间-剂量依赖的方式抑制p38MAPK激活。
2.3.2 蛋白免疫印迹 从 Fig 4可以观察到 pp38MAPK的表达高峰在7 d,T4干预处理后 pp38MAPK条带密度有降低的趋势,以20 μg·kg-1较明显。说明T4能抑制Aβ25-35注射后p-p38MAPK的表达。

Fig 3 Immunohistochemistry of rat hippocampal sections(CA1 area)with p-p38MAPK antibody(×400)

Fig 4 Western blot of p-p38MAPK protein
2.4 T4对大鼠海马组织神经元损伤的影响TUNEL及Nissl染色如Fig 5所示,模型组TUNEL阳性神经元数量随时间延长逐渐增多,并于7 d达到高峰,T4干预后,TUNEL阳性神经元数量明显减少(7 d),以20 μg·kg-1组明显;如 Fig 6 所示,模型组随着时间的延长,海马CA1区锥体神经元数量逐渐变的稀少且排列紊乱,可见有尼氏体碎裂,胞质中央尼氏体消失或胞质低嗜碱性染色,Nissl阳性神经元明显减少(7 d),T4干预后,Nissl阳性神经元数量明显增多,以 20μg·kg-1组明显,说明 T4对注射Aβ25-35后海马神经元有保护作用。阳性细胞计数结果见Tab 2。
2.5 ELISA检测T4处理对海马内TNF-α和IL-1β的含量变化的影响 T4可以明显的抑制TNF-α(Tab 3)和 IL-1β(Tab 4)的分泌,以 T4(20 μg·kg-1)组效果最明显,与模型组相比,T4(20 μg·kg-1)组在d 1就可以明显的抑制此二者的升高(P<0.05),d 7效果更明显(P<0.01)。

Fig 5 Rat hippocampal sections(CA1 area)with TUNEL staining(×400)
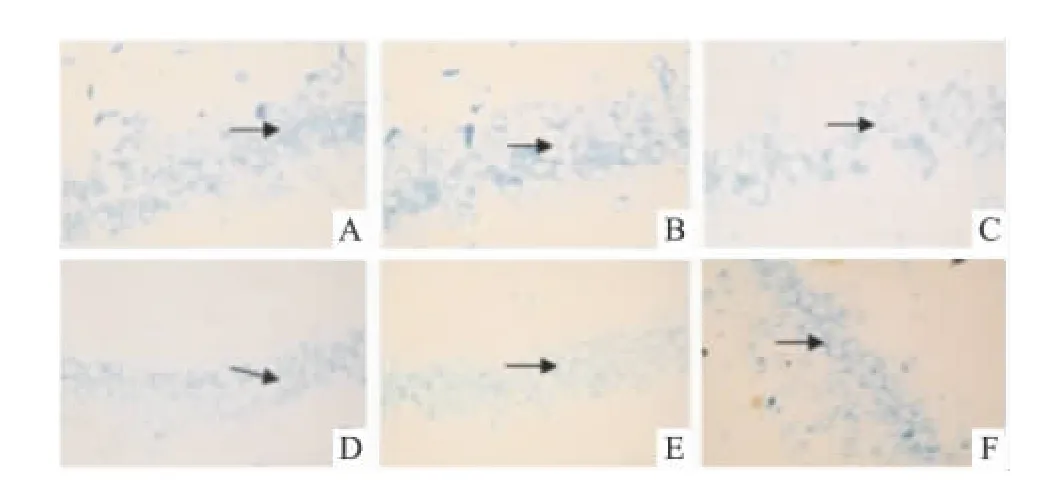
Fig 6 Rat hippocampal sections(CA1 area)with Nissl staining(×400)

Tab 2 Positive results of Nissl,TUNEL staining

Tab 3 Inhibitory effect of T4on Aβ25-35induced increase of TNF-α level in rat hippocampus

Tab 4 Inhibitory effect of T4on Aβ25-35induced increase of IL-1β in rat hippocampus
3 讨论
AD中Aβ周围出现神经胶质细胞的激活,促炎细胞因子、神经毒性物质的释放,细胞内钙超载等一系列生化改变,其中包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素 1β(interleukin-1β,IL-1β)的释放,细胞内信号转导通路的激活,并诱导多种凋亡基因的表达,最终导致神经元死亡的瀑布效应。
本研究表明,MG、AS、p38MAPK激活或表达在Aβ诱导的神经元凋亡中起着重要的作用。针对上述靶点的药物被证实有神经保护作用。Giovannini等[4]发现在AD模型中消炎药布洛芬可以明显抑制胶质细胞和p38MAPK的激活,降低IL-1β的水平发挥保护胆碱能神经元的作用。
T4能通过激活Wnt/β-catenin通路减轻寡聚态Aβ1-42诱导的神经元凋亡[5]。本研究表明,在Aβ25-35引起的大鼠海马神经元损伤模型中,经T4处理后,海马神经元凋亡在d 7明显减少,证实了T4有一定的神经元保护作用。且随着T4剂量的增加,保护作用更强。Aβ可直接激活小胶质细胞,诱发其产生白介素-1(interleukin-1,IL-1)、IL-6、TNF-α 等多种炎性细胞因子,并诱导补体系统,补体系统随着IL-1的表达,进一步活化小胶质细胞释放细胞因子或毒性物质[6-9],同时小胶质细胞可以释放 IL-1β[10-11],继发活化 AS,促进其增殖,释放多种免疫活性因子启动炎症反应[12]。这种交互作用促成了慢性炎症反应的形成和炎性产物水平持续升高,导致神经元变性坏死,退变死亡的神经元碎片及有毒物质反过来又刺激其他胶质细胞释放神经毒性物质和炎性细胞因子,这样在脑内就形成一个不断增强的自身毒性环路,使炎症反应不断加强。T4还可以抑制Aβ所致小胶质细胞活化,改善AD大鼠的学习记忆能力[13]。本研究亦表明,Aβ25-35可以激活小胶质细胞分泌TNF-α及IL-1β,予一定剂量的T4处理后,小胶质细胞激活受到抑制,并且TNF-α和IL-1β的含量降低,以20 μg·kg-1最明显,呈剂量 - 时间效应;同时星型胶质细胞的激活也被抑制,同小胶质细胞的变化趋势一致。更大的剂量对胶质细胞是否有更好的抑制作用有待于进一步研究。
Nagila等[14]发现p38MAPK通路的激活可导致神经元凋亡。p38MAPK一旦被激活,迅速从胞质内移位到细胞核,激活转录因子[15],引起大量凋亡因子及相关炎症介质的表达,从而引起神经元凋亡。Pan等[16]在小胶质细胞培养基中发现寡聚态Aβ1-42激活 JNK、NF-κB 信号通路而不是 p38MAPK通路诱导炎症反应;T4能抑制寡聚态Aβ1-42诱导的小胶质细胞内JNK和NF-κB炎症信号的激活水平保护神经元,但不影响p38MAPK的活化水平。在体内p38MAPK信号通路是否参与了Aβ诱导的炎症因子的释放,T4能否对p38MAPK的活化水平产生影响系本研究观察的重点。本研究观察到,Aβ作用后海马组织p38MAPK的表达明显增强,T4处理后,模型组的大鼠海马组织p38MAPK的表达明显降低,以20 μg·kg-1作用最明显。在 p38MAPK 表达降低的同时,TNF-α和IL-1β的水平也有明显的降低。因此T4对Aβ25-35引起的大鼠海马神经元损伤的保护作用,可能是通过抑制p38MAPK信号通路,减少炎症细胞因子水平来实现的。
本研究表明:T4可能通过抑制小胶质细胞及星形胶质细胞,p38MAPK信号通路的激活,降低TNF-α和IL-1β的水平,对Aβ25-35引起的大鼠海马神经元损伤有保护作用。
[1] Lublin A,Link C.Alzheimer's disease drug discovery:In-vivo screening using C.elegans as a model for β-amyloid peptide-induced toxicity[J].Drug Discov Today Technol,2013,10(1):e115-e119.
[2] 杨光忠,陈 玉.雷公藤氯内酯醇研究进展[J].中药材,2006,29(2):200-3.
[2] Yang G Z,Chen Y.Tripchlorolide research progress[J].Chin Herb Med,2006,29(2):200 -3.
[3] 赵宇红,黄 韧,徐 杰,等.Aβ(25-35)对海马和隔区胆碱能神经元毒性的比较[J].广东药学院学报,2004,20(5):504-5,8.
[3] Zhao Y H,Huang R,Xu J,et al.Comparison of Aβ(25-35)on hippocampus and septal area cholinergic neuron toxicity[J].J Guangdong Pharm Univ,2004,20(5):504 -5,508.
[4] Giovannini M G,Scali C,Prosperi C,et al.Beta-amyloid-induced inflammation and cholinergic hypofunction in the rat brain in vivo:involvement of the p38MAPK pathway[J].Neurobiol Dis,2002,11(2):257 -74.
[5] 吴 明,朱元贵,潘晓东,等.雷公藤氯内酯醇通过激活Wnt/βcatenin通路减轻寡聚态Aβ1-42诱导的神经元凋亡[J].药学学报,2010,45(7):853 -9.
[5] Wu M,Zhu Y G,Pan X D,et al.Tripchlorolide through activation of Wnt/β-catenin pathway reduces neuronal apoptosis induced by the oligomeric state of Aβ1-42[J].Pharm J,2010,45(7):853-9.
[6] Fang F,Lue L F,Yan S,et al.RAGE-dependent signaling in microglia contributes to neuroinflammation,Abeta accumulation,and impaired learning/memory in a mouse model of Alzheimer's disease[J].FASEB J,2010,24(4):1043 -55.
[7] Weisman D,Hakimian E,Ho G J.Interleukins,inflammation,and mechanisms of Alzheimer's disease[J].Vitam Horm,2006,74:505-30.
[8] 武冬慧,胡金凤,宋修云,等.小胶质细胞表达的受体与阿尔采末病[J].中国药理学通报,2010,26(12):1550-3.
[8] Wu D H,Hu J F,Song X Y,et al.The receptors expression in microglia and Alzheimers disease [J].Chin Pharmacol Bull,2010,26(12):1550-3.
[9] 李 琴,张均田,唐民科.中枢神经系统核苷酸信号与小胶质细胞活动[J].中国药理学通报,2010,26(7):854-7.
[9] Li Q,Zhang J T,Tang M K.Nucleotide signals in the central nervous system and microglia activity[J].Chin Pharmacol Bull,2010,26(7):854-7.
[10] Shaftel S S,Griffin W S,O'Banion M K.The role of interleukin-1 in neuroinflammation and Alzheimer disease:an evolving perspective[J].J Neuroinflammation,2008,5:7.
[11]潘晓东,陈晓春,朱元贵,等.寡聚态β-淀粉样肽1-42可通过胶质-炎症反应损伤神经元[J].解剖学报,2008(6):804-9.
[11] Pan X D,Chen X C,Zhu Y G,et al.The oligomeric state of beta amyloid peptide 1-42 injury neurons by glial inflammation[J].Acta Anatom Sin,2008(6):804-9.
[12] Mrak R E.Neuropathology and the neuro inflammation idea[J].J Alzheimers Dis,2009,18(3):473 -81.
[13]陈龙飞,阮志芳,李智文,等.雷公藤氯内酯醇对阿尔茨海默病大鼠小胶质细胞活化的影响[J].解剖学杂志,2009,32(4):485-7.
[13] Chen L F,Ruan Z F,Li Z W,et al.Effect of Tripchlorolide on activation of rat microglia in Alzheimer's disease[J].Chin J A-natomy,2009,32(4):485-7.
[14] Nagila A,Netsawang J,Suttitheptumrong A,et al.Inhibition of p38MAPK and CD137 signaling reduce dengue virus-induced TNF-α secretion and apoptosis[J].Virol J,2013,10(1):105.
[15] Meldrum K K,Meldrum D R,Hile K L,et al.The strμggle for iron:gastrointe-stinal microbes modulate the host immune response during infection[J].J Leukoc Biol,2007,81(2):393 -400.
[16] Pan X D,Chen X C,Zhu Y G,et al.Tripchlorolide protects neuronal cells from microglia-mediated beta-amyloid neurotoxicity throμgh inhibiting NF-kappaB and JNK signaling[J].Glia,2009,57(11):1227 -38.

