色谱-质谱联用技术测定人体内类固醇激素的研究进展
钱 跹,赵 亮,吕 磊,张 海,李悦悦,张国庆 (第二军医大学东方肝胆外科医院药材科,上海 200438)
类固醇激素又称甾体激素,是内分泌细胞分泌的高效能生物化学物质。它们在维持生命、调节机体物质代谢、促进性器官发育和维持生育等方面起着重要作用。激素主要通过血液传递,以很小的剂量在靶细胞上与受体结合而发挥作用,具有极高的专属性。当体内类固醇激素水平下降或缺乏时,机体就会产生严重的症候群,甚至危及生命,因此临床上将测定类固醇激素水平作为很多疾病的诊断参考指标[1,2]。然而,内源性类固醇激素在人体内的含量很低,并且随年龄、性别的不同而异,一般在nmol/L和pmol/L数量级。这对于体内类固醇激素的超微量、高灵敏度、精确定量检测提出了重大挑战。目前测定类固醇激素的方法主要有生物法[3-7]和化学法[8-15],生物法包括放射免疫测定(RIA)、酶联免疫吸附(ELISA)等,化学法包括气相色谱-质谱(GC-MS、GC-MS/MS)、液相色谱-质谱(LC-MS/MS)等,其中质谱检测技术是当前的发展趋势。笔者分析了以上测定方法的优缺点及其发展应用,重点探究色谱-质谱联用技术在测定激素方面的研究进展,为其在诊断疾病方面的应用提供参考依据。
1 类固醇激素的分类及合成通路
人体内的类固醇激素按药理作用可分为肾上腺皮质类固醇激素和性激素两大类。肾上腺皮质激素包括盐皮质激素和糖皮质激素;性激素主要包括雌激素、雄激素、孕激素。类固醇激素按化学结构可分为雌甾烷(18C原子)、雄甾烷(19C原子)和孕甾烷(21C原子)3大类。
类固醇激素由胆固醇为母体合成,很多具有重要的临床作用[15,16]。合成过程主要在肾上腺皮质、性腺和胎盘细胞的线粒体和平滑内质网上完成,见图1。首先以胆固醇为前体,通过裂解酶的作用使侧链缩短,产生21碳的孕激素。孕激素一方面可以通过羟化酶的作用形成21碳的糖皮质激素和盐皮质激素,另一方面可以去侧链衍化为19碳的雄激素,雄激素可以通过A环的芳香化生成18碳的雌激素。合成过程需要多种羟化甾醇脱氢酶(HSD)和细胞色素P450(CYP)以及其他代谢复合酶的参与。
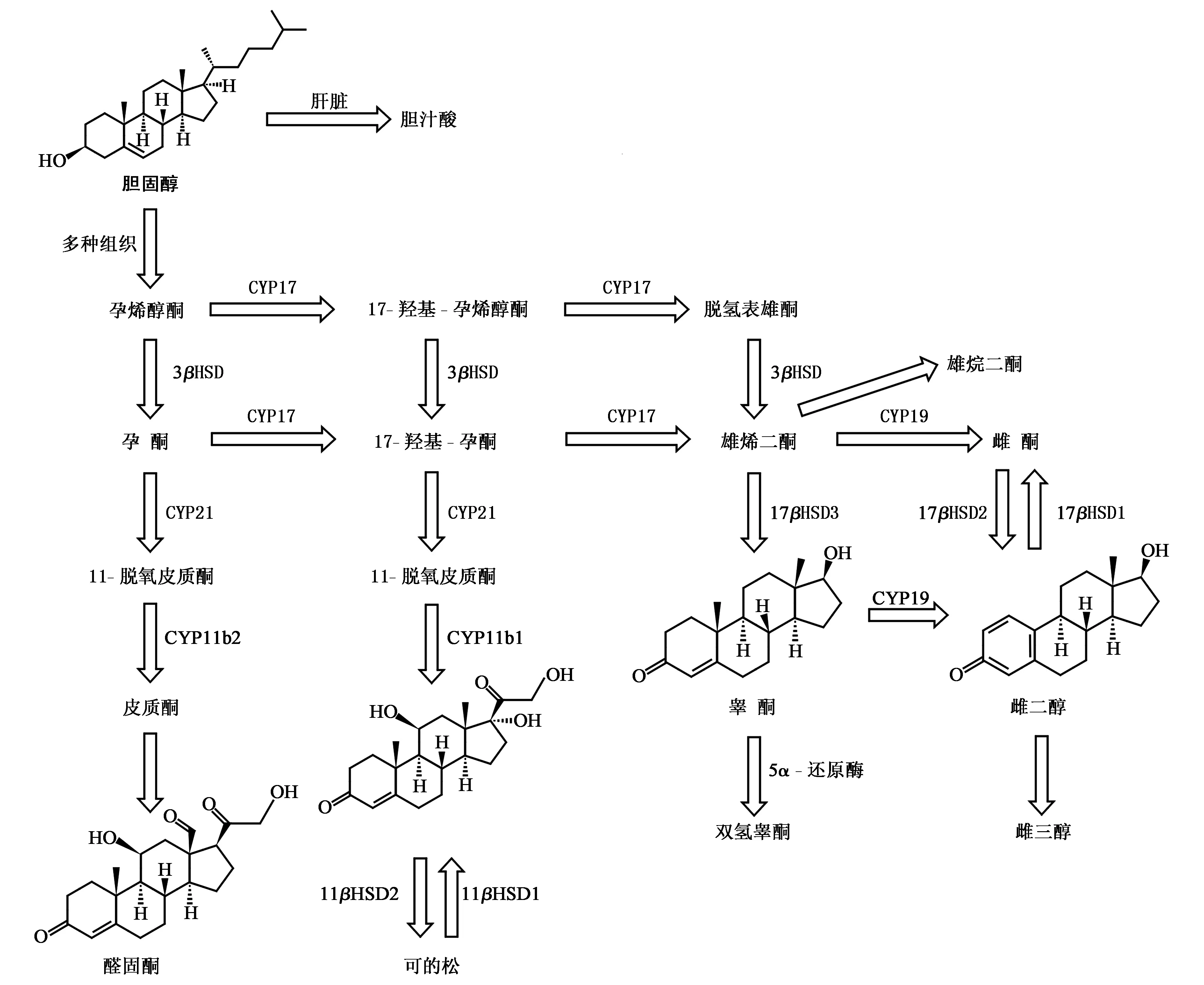
图1 类固醇激素的合成通路
2 生物法测定类固醇激素的含量
生物法如放射免疫法(RIA)和酶联免疫吸附法(ELISA)在过去被认为是测定生物样品中类固醇激素的理想方法。Abraham[7]于1969年发明RIA用于测定雌二醇(E2),采用的是有机溶剂提取和柱分离技术来消除物质间的交叉反应,该方法灵敏有效。后来,RIA得到发展用于测定更多关键的类固醇激素及其代谢物,如双向的免疫放射分析(IRMA)和免疫化学发光分析法(ICMA)提高了灵敏度和专属性, ICMA同时消除了放射的必要性。由于灵敏度很高,很多临床诊断实验室均采用生物法测定类固醇激素水平。但是现在的研究发现上述方法存在一定的缺陷:首先,一次只能分析一种被测物,因此测定一种类固醇激素的多种代谢物就需要多次测定。其次,类固醇激素代谢物在结构上具有很高的相似性。因此,使用免疫测定法很难控制生物基质中可能存在的结构相似物的干扰。第三,生物法不能对分析物进行结构确证。最后,并不是所有的目标类固醇代谢物都存在相应的抗血清以得到准确的免疫测定,这一点对于类固醇结合物的免疫测定尤为明显。
3 色谱-质谱联用技术测定类固醇激素的应用
近年来,质谱技术已发展成为分析内源性代谢物和药物的通用定量方法,通过与气相色谱(GC)或高效液相色谱(HPLC)联用,可以快速并准确地分离多种化合物,并且能在一定程度上完成自动化分析。色谱-质谱检测技术是当前的发展趋势,也是目前最为可靠的激素检测方法,同时可验证其他测定方法的准确性,并鉴定未知物质的结构。以下分别介绍有关激素分析的前处理技术、气相色谱-质谱和液相色谱-质谱联用技术在激素检测中的应用和发展。
3.1 前处理技术 由于人体内源性激素含量很低,且存在复杂的基质干扰。因此,样品测定前一般要对其进行提取、纯化和浓缩,选择合适的前处理方法对于类固醇激素的准确测定意义重大。目前常用的前处理方法包括液液萃取(LLE)、固相萃取(SPE)。提取技术取决于样品类型并且要有特异性,同时需满足高通量和灵敏度。通常为达到实际的检测需求,需要单独或协同使用不同的前处理方法。
3.1.1 液液萃取技术 LLE基于分析物在水相和有机相中的分配,该方法简单、快速、有效,通常是从生物基质中提取类固醇激素的首选方法。理想的萃取溶剂应能保证在高效提取被测物质时尽可能减少对样品中共存干扰物的提取。目前已报道的提取溶剂包括甲基叔丁基醚(MTBE)、二乙醚、二氯甲烷和一定比例乙酸乙酯与正己烷的混合物等。Rahkonen等[18]全面考察了MTBE、二乙醚、正己烷和2-甲基丁烷对血清样本中雄激素和孕激素的提取效率,结果表明,相对于其他溶剂,MTBE提取效率较高,被测7种类固醇激素的回收率均接近100%;二乙醚对于17-羟基孕酮、孕酮和孕烯醇酮的提取效率为MTBE的85%~95%;正己烷对睾酮、17-羟基孕酮的提取效率较低;2-甲基丁烷对孕烯醇酮和孕酮的提取率低于80%。而Rothman等[19]采用二乙醚提取生物样本中的雌激素(雌酮和雌三醇),平均提取效率接近100%。LLE的缺点在于操作上的难以自动化。
3.1.2 固相萃取技术 SPE属于吸附萃取技术,最大的特点是能在分离纯化的同时对被测物进行浓缩。用于内源类固醇激素纯化的SPE柱主要有离子交换柱Strata X、C18柱和混合模式的Oasis HLB柱。Kushnir等[20]采用Strata X柱处理4种类固醇激素(11-脱氧皮质醇、17-羟基孕酮、17-羟基孕烯醇酮、孕烯醇酮),萃取柱先用2 ml甲醇-水活化,上样后用3 ml水以及3 ml乙腈-水冲洗,最后用2 ml MTBE洗脱,4种激素的绝对回收率均大于89%,定量限为0.05~0.25 ng/ml,但该方法操作烦琐,耗时长,结果不稳定。Carvalho等[21]采用C18柱代替离子交换柱对人血清中的9种类固醇激素进行处理,实现了3种类型类固醇激素的同时测定,该方法简单易于操作且耗费低。Mc Whinney等[22]采用Oasis HLB柱分离纯化血浆、血浆超滤液、尿液和唾液等多种介质中的5种皮质醇类类固醇激素,结果显示该方法基质效应小,各组分的回收率均大于80%,适用于实验室的痕量分析。
在线固相萃取技术是固相萃取的新发展,它将化学键合相硅胶预柱与HPLC配合,通过切换阀可以实现柱切换HPLC分离分析,达到生物样品纯化、浓集、分离、测定的一体化和自动化。Guo等[15]将这项技术应用于血浆中睾酮、皮质醇、孕酮和雄烯二酮的含量测定。结果表明该方法操作简单,被测物回收率较高且基质效应较小。与离线提取过程相比,在线固相萃取具有相似的精密度和准确度,但能缩短样品前处理时间并提高灵敏度,同时自动化程度更高。
3.1.3 多种前处理方法结合 将PP、LLE和SPE结合使用可以降低样品的复杂性、基质效应并提高灵敏度。Rauh等[23]将PP与在线SPE结合分析17-羟基孕酮、睾酮和雄烯二酮,采用甲醇沉淀蛋白后,将上清液转移到自动进样器的96孔板中,提取柱(Oasis HLB)用水-甲醇(95:5V/V)以3 ml/min冲洗1 min后,转换柱切换阀进入分析柱(RP-C18),乙腈-甲醇(30:70V/V)以1 ml/min流速洗脱,总的分析时间为6 min,该法自动、快速、灵敏,定量限可达0.03~0.06 ng/ml。
3.2 气相色谱-质谱联用技术用于激素的检测 在20世纪70年代,GC-MS开始运用于分析尿液中的类固醇激素及其代谢物,由于内源性类固醇激素多含有极性基团,同时分泌物主要以硫酸盐和葡萄糖酸盐的形式存在,因此尿液中的类固醇激素在GC-MS进样前需要水解并衍生化,这一点限制了自动化操作并且增加了提取过程的复杂性。尽管如此,Shackleton等[24]还是开发了采用GC-MS同时测定尿液中多达40种类固醇激素的方法,虽然具有高通量的特点,但该方法中前处理步骤较为烦琐且被测物充分分离的时间较长。
串联质谱(MS/MS)可以降低背景干扰,提高单一MS的选择性从而得到更高的灵敏度,因此广泛应用于内源性激素的分析。Hansen等[25]采用SPE作为前处理方法,测定生物基质中的9种重要类固醇激素。该方法可以消除脂类(脂肪酸、磷脂、甘油酯)的干扰,血清样本体积仅需200 μl。衍生化后采用GC-MS/MS测定,得到雌激素、雄激素、孕激素的定量限分别为:0.08~0.16、0.20~0.36、0.36~0.43 ng/ml。Courant等[26]测定健康儿童血清性激素及其代谢物水平以寻求性别差异对激素水平的影响。该方法准确灵敏,样品经N-甲基-N-三甲基硅烷三氟乙酰胺衍生化后,SPE ChromP柱吸附纯化,进入GC-MS/MS分析,得到的雄激素定量限为0.07 pmol/L,雌激素为3.7 pmol/L,满足痕量分析的需求。
衍生化在气质联用分析中应用较多,主要目的是提高类固醇激素的挥发性和热稳定性。常用的衍生化方法包括丹酰化、氧化、烷烃化和硅烷化等,选择的衍生化反应一般要求简单、快速、重现性好,且过量的衍生化试剂应易于除去。Courant等[26]的研究表明分别对雌激素和雄激素采用五氟苄基溴(PFBBr)和N-甲基-N-三甲基硅烷三氟乙酰胺(MSTFA)硅烷化与对两种激素同时用MSTFA衍生化相比,能得到更低的检测限。这表明,雌激素优选PFBBr衍生化,而雄激素优选MSTFA衍生化。但该方法的缺点在于需要更长的色谱分析时间。
在气质联用分析类固醇激素的研究中,通常采用内标法克服样品纯化过程中被测激素损失而造成的误差[27,28],其中最理想的内标物为同位素标记的内源性激素。在生物样品提取一开始就加入已知量的内标物,使其与被测激素经过相同的分离、纯化过程,最后在GC-MS或GC-MS/MS分析中分离,根据谱图所得的峰强度比,求出被测激素的含量。在普通的气相色谱上,由于同位素内标与待测的内源性激素有相似的保留,在保留时间上很难区分开,但MS中的选择离子检测(SIM)和多反应选择监测(MRM)功能,能根据其碎片离子的质量偏差,选择合适的监测离子,将两种物质明显区分并定量。目前,大多数内源性激素的质谱定量分析均采用内标法定量,可以减少样品提取、纯化时回收率的损失以及仪器的误差。
3.3 液相色谱-质谱联用技术用于激素的检测 LC-MS/MS用于内源性激素检测通常不需要烦琐的衍生化步骤,大大减少样品和试剂的损耗以及前处理的时间,同时避免了衍生化步骤中副反应或反应不完全造成的损失。因此,采用液质联用测定类固醇激素含量的研究远多于气质联用分析[29]。该方法可以对内源性激素进行结构分析,并通过MRM提高选择性和检测限。Koal等[30]建立了标准化的HPLC-MS/MS方法测定人血清样本中的16种类固醇激素,在96孔板中进行SPE前处理,定量限可达0.01~32 ng/ml,回收率为68%~99%,同时将该方法与免疫法比较,发现其准确度更高。Naessen等[31]建立了用HPLC-MS/MS测定11种类固醇激素水平用于评估70岁老人的心血管疾病发病率,其中雌激素采用丹酰化衍生物分析,酮类固醇用氧化衍生物分析,该方法灵敏度较高,且定量准确。结果显示未患病的受试者体内含有较高的雌二醇,而患者体内具有较低的孕激素水平以及更高的雌酮/雄烯二酮、雌二醇/睾酮浓度比值。
与HPLC相比,最新发展的UPLC(超高效液相色谱)运用亚2 μm的小粒径填料可以增加柱效,同时能耐较高的压力,使用更高的流速从而得到更短的分离时间。Rossi等[32]测定人血清中的7种类固醇激素用于肾上腺增生的诊断,该方法提取过程简单,采用UPLC-MS/MS检测可实现快速分析。采用MTBE提取类固醇激素,质谱条件为正离子模式下的电喷雾离子化多反应监测。该方法可以在5 min内分离定量与肾上腺增生相关的7种类固醇,所得结果在临床分析范围内,线性、灵敏度和精密性良好。Kulle等[33]采用UPLC-MS/MS同时测定血浆雄激素(睾酮、雄烯二酮、双氢睾酮)浓度,并报道了0~18岁儿童在不同年龄、性别、发育阶段的雄激素水平参考范围。该方法简单、灵敏、准确并具有高通量的特点,定量限为2.9 ng/ml,在3 min内各激素得到充分分离,没有受到其他类固醇干扰物的影响,所得的参考数据可以应用于临床监测和实验研究。
在液质联用技术中,质谱仪的选择对于激素的准确定量起着重要作用。目前分析类固醇激素的质谱仪有串联三重四极杆(QQQ)、线性离子阱-四极杆串联(QTrap)、飞行时间质谱(TOF)等。其中应用最多的质谱仪是QQQ,它具有灵敏度高和重现性好的特点,通常是内源性成分含量测定的首选仪器。Koal等[30]采用QTrap检测人体内的多种激素,QTrap将离子阱的高灵敏度和三重四极杆的高选择性结合起来。但结果显示该方法与传统的三重四极杆相比并未得到更高的灵敏度。雄激素通过QQQ可以得到低于0.1 pg/ml的定量限,但使用QTrap的最低定量限为10 pg/ml。Rousu等[34]将11种类固醇激素添加到人血浆中,采用SPE前处理后分别进入QQQ和TOF分析比较,TOF的优势在于具有较高的线性范围和质谱分辨率及准确度,采用TOF测定血浆中激素成分的定量限为0.5~20 ng/ml,而QQQ可以达到0.5~5 ng/ml。可见,对于激素分析,三重四极杆串联质谱比TOF具有更高的检测灵敏度。
质谱选用的离子化方式对于类固醇激素的响应也有着较大影响,目前常用的离子化方式包括电喷雾离子化(ESI)、大气压光电电离(APPI)和大气压化学电离(APCI)。其中ESI源是使用最为广泛的离子源,在LC-MS/MS中表现出较高的分析灵敏度。Ceglarek等[35]对离子化方式的选择进行深入探究,发现其与质谱仪类型、分析物和正负离子模式相关。对于睾酮的测定,传统的QQQ检测时采用APPI具有最高的信噪比,而使用QTrap检测时选择ESI所得灵敏度更高。该研究还显示,在正离子模式下测定雌酮和雌二醇,采用APCI源具有更高的信噪比;当采用负离子模式检测时,APPI响应更高。而对于孕酮的测定,优先选择APPI源。
4 总结与展望
内源性类固醇激素在人体的各种生理活动中起着重要的调节作用。因此,对其进行精确的定量检测一直都是学界关注的焦点之一[36,37]。GC-MS和GC-MS/MS以其高灵敏度、能同时进行定性定量分析等优势,成为分析内源性激素的方法之一,但复杂的样品提取、纯化和衍生化过程在很大程度上制约了它的发展。LC-MS/MS适用于分析极性大、不易挥发和热不稳定的内源性激素,通常无须烦琐的衍生化步骤,其高选择性和灵敏度也降低了对样品前处理的要求。因此,LC-MS/MS在测定不同种类的内源性激素中应用更为广泛。今后,通过色谱-质谱联用技术对甾体激素进行精确灵敏的定量分析,并结合其在多种疾病发展中的变化,可以找到更为精确的诊断指标,为临床诊断和实验研究提供参考。
【参考文献】
[1] Holst JP,Soldin OP,Guo T,etal. Steroid hormones: relevance and measurement in the clinical laboratory[J].Clin Lab Med,2004,24(1):105-118.
[2] Dorgan JF,Fears TR,McMahon RP,etal. Measurement of steroid sex hormones in serum: a comparison of radioimmunoassay and mass spectrometry[J].Steroids,2002,67(3-4):151-158.
[3] Carter GD,Carter R,Jones J,etal. How accurate are assays for 25-hydroxyvitamin D-Data from the international vitamin D external quality assessment scheme[J].Clin Chem,2004,50(11):2195-2197.
[4] Hollis BW,Kamerud JQ,Kurkowski A,etal. Quantification of circulating 1,25-dihydroxyvitamin D by radioimmunoassay with 125 I-labeled tracer[J].Clin Chem,1996,42(4):586-592.
[5] Hsing AW,Stanczyk FZ,Belanger A,etal. Reproducibility of serum sex steroid assays in men by RIA and mass spectrometry[J].Cancer Epidemiol Biomarkers Prev,2007,16(5):1004-1008.
[6] Poulson K,Sancho J,Haber E. A simplified radioimmunoassay for plasma aldosterone employing an antibody of unique specificity[J].Clin Immunol,1974,2(3):373-380.
[7] Schioler V,Thode J. Six direct radioimmunoassays of estradiol evaluated[J].Clin Chem,1988,34(5):949-952.
[8] Xu X,Roman JM,Issaq HJ,etal.Quantitative measurement of endogenous estrogens and estrogen metabolites in human serum by liquid chromatography-tandem mass spectrometry[J].Anal Chem,2007,79(20):7813-7821.
[9] Santen RJ,Demers L,Ohorodnik S,etal. Superiority of gas chromatography/tandem mass spectrometry assay (GC/MS/MS) for estradiol for monitoring of aromatase inhibitor therapy[J].Steroids,2007,72(8):666-671.
[10] Wolthers BG,Kraan GP. Clinical applications of gas chromatography and gas chromatographymass spectrometry of steroids[J].J Chromatogr A,1999,843(1-2):247-274.
[11] Draisci R,Palleschi L,Ferretti E,etal.Quantitation of anabolic hormones and their metabolites in bovine serum and urine by liquid chromatography-tandem mass spectrometry[J].J Chromatogr A,2000,870(1-2):511-522.
[12] Guo T,Chan M,Soldin SJ. Steroid profiles using liquid chromatography-tandem mass spectrometry with atmospheric pressure photoionization source[J].Arch Pathol Lab Med,2004,128(4):469-475.
[13] Guo T,Gu J,Soldin OP,etal.Rapid measurement of estrogens and their metabolites in human serum by liquid chromatographytandem mass spectrometry without derivatization[J].Clin Biochem,2008,41(9):736-741.
[14] Nelson RE,Grebe SK,Kane DJ,etal. Liquid chromatography-tandem mass spectrometry assay for simultaneous measurement of estradiol and estrone in human plasma[J].Clin Chem,2004,50(2):373-384.
[15] Guo T,Taylor RL,Singh RJ,etal. Simultaneous determination of 12 steroids by isotope dilution liquid chromatography-photospray ionization tandem mass spectrometry[J].Clin Chim Acta,2006,372(1-2):76-82.
[16] Andrew R. Clinical measurement of steroid metabolism[J].Best Pract Res Clin Endocrinol Metab,2001,15(1):1-16.
[17] Abraham GE. Solid-phase radioimmunoassay of 17β-estradiol[J].J Clin Endocrinol Metab, 1969,29(6):866-870.
[18] Rahkonena PK,Huhtinenb K,Poutanenb M,etal. Fast and sensitive liquid chromatography-mass spectrometry assay for seven androgenic and progestagenic steroids in human serum[J].J Steroid Biochem Mol Biol,2011,127(3-5):396-404.
[19] Rothman MS,Carlson NE,Xu M,etal. Reexamination of testosterone, dihydrotestosterone, estradiol and estrone levels across the menstrual cycle and in postmenopausal women measured by liquid chromatography-tandem mass spectrometry[J].Steroids,2011,76(1-2):177-182.
[20] Kushnir MM,Rockwood AL,Roberts WL,etal. Development and performance evaluation of a tandem mass spectrometry assay for 4 adrenal steroids[J].Clin Chem,2006,52(8):1559-1567.
[21] Carvalho VM,Nakamura OH,Vieira JG. Simultaneous quantitation of seven endogenous C-21 adrenal steroids by liquid chromatography tandem mass spectrometry in human serum[J].J Chromatogr B Analyt Technol Biomed Life Sci,2008,872(1-2):154-161.
[22] McWhinney BC,Briscoe SE,Ungerer JP. Pretorius CJ.Measurement of cortisol, cortisone, prednisolone, dexamethasone and 11-deoxycortisol with ultra high performance liquid chromatography-tandem mass spectrometry: application for plasma, plasma ultrafiltrate, urine and saliva in a routine laboratory[J].J Chromatogr B Analyt Technol Biomed Life Sci,2010,878(28):2863-2869.
[23] Rauh M,Gröschl M,Rascher W,etal.Automated, fast and sensitive quantification of 17 alpha-hydroxy-progesterone, androstenedione and testosteroneby tandem mass spectrometry with on-line extraction[J].Steroids,2006,71(6):450-458.
[24] Shackleton CH. Mass spectrometry: application to steroid and peptide research[J].Endocr Rev,1985,6(3):441-486.
[25] Hansen M,Jacobsen NW,Nielsen FK,etal. Determination of steroid hormones in blood by GC-MS/MS[J]. Anal Bioanal Chem,2011,400(10):3409-3417.
[26] Courant F,Aksglaede L,Antignac JP,etal. Assessment of circulating sex steroid levels in prepubertal and pubertal boys and girls by a novel ultrasensitive gas chromatography-tandem mass spectrometry method [J].J Steroid Biochem Mol Biol,2010,95(1):82-92.
[27] Steven JS,Soldin OP. Steroid hormone analysis by tandem mass spectrometry[J].Clin Chem,2009,55(6):1061-1066.
[28] McDonald JG,Matthew S,Richard J. Steroid profiling by gas chromatography-mass spectrometry and high performance liquid chromatography-mass spectrometry for adrenal diseases[J].Horm Cancer,2011,2(6):324-332.
[29] Kushnir MM,Rockwood AL,William L,etal. Liquid chromatography tandem mass spectrometry for analysis of steroids in clinical laboratories[J].Clin Biochem,2011,44 (1) :77-88.
[30] Koal T,Schmiederer D,Rauh M. Standardized LC-MS/MS based steroid hormone profile-analysis[J].J Steroid Biochem Mol Biol,2012,129(3-5):129-138.
[31] Naessen T,Sjogren U,Bergquist J,etal. Endogenous steroids measured by high-specificity liquid chromatography-tandem mass spectrometry and prevalent cardiovascular disease in 70-year-old men and women[J].J Clin Endocrinol Metab,2010,95(4):1889-1897.
[32] Rossi C,Calton L,Hammond G,etal. Serum steroid profiling for congenital adrenal hyperplasia using liquid chromatography-tandem mass spectrometry[J].Clin Chim Acta,2010,411(3-4):222-228.
[33] Kulle AE,Riepe FG,Melchior D,etal. A novel ultrapressure liquid chromatography tandem mass spectrometry method for the simultaneous determination of androstenedione, testosterone, and dihydrotestosterone in pediatric blood samples: age-and sex-specific reference data[J].J Clin Endocrinol Metab,2010,95(5):2399-2409.
[34] Rousu T,Tolonen A. Comparison of unit resolution SRM and TOF-MS at 12,000 mass resolution for quantitative bioanalysis of 11 steroids from human plasma[J].Bioanalysis,2012,4(5):555-563.
[35] Ceglarek U,Kortz L,Leichtle A,etal. Rapid quantification of steroid patterns in human serum by on-line solid phase extraction combined with liquid chromatography-triple quadrupole linear ion trap mass spectrometry[J].Clin Chim Acta,2009,401(1-2):114-118.
[36] Higashi T,Shimada K. Derivatization of neutral steroids to enhance their detection characteristics in liquid chromatography-mass spectrometry[J].Anal Bioanal Chem,2004,378(4):875-882.
[37] Maidana P, Bruno OD, Mesch V. A critical analysis of cortisol measurements: an update[J]. Medicina (B Aires),2013,73(6):579-584.

