鹿茸多肽对人胶质瘤细胞生长抑制率及细胞周期的影响
徐 岩,许佳明,何 璐,姬朝光,黄晓巍*
(1.长春中医药大学,长春 130117;2.吉林大学基础医学院,长春 130021)
鹿茸多肽是从新鲜鹿茸中提取的一类多肽类物质,具较强的生物活性,鹿茸多肽具促进细胞修复,诱导细胞分化等多重作用[1],并具有抗肿瘤等作用[2]。尽管鹿茸多肽抗肿瘤的确切机制尚不十分清楚,但研究表明,鹿茸多肽的抗肿瘤作用可能通过不同的信号传导通路,抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡,抑制肿瘤新生血管形成,抑制肿瘤细胞侵袭和转移。鹿茸多肽对人胶质瘤细胞的增殖抑制作用及细胞周期调节作用未见报道。
1 材料与方法
1.1 材料 细胞系,人胶质瘤细胞(U251)肿瘤细胞系由吉林大学免疫学系保存;鹿茸多肽,长春中医药大学附属医院实验中心提供;碘化丙啶PI(美国Sigma公司),以PBS配制成1.0 mg/mL浓度,过滤除菌后避光备用;MTT(美国Gibco公司),临用前以PBS配制成5 mg/mL浓度,过滤除菌后避光备用;二甲基亚砜DMSO和0.25%胰蛋白酶(美国Amresco公司);RPMI-1640(美国Gibco公司);标准胎牛血清(杭州四季青生物科技有限公司)。
1.2 仪器 标准超净工作台(苏净集团安泰公司);MCO-17AIC型CO2孵箱(日本三洋公司);DT5-3型低速自动平衡离心机(北京医用离心机厂);倒置显微镜(日本OLYMPUS公司);Multiskan Ascent酶标仪(芬兰Labsystems公司);BD FACSCanto II流式细胞仪(美国BD Biosciences)。
1.3 方法
1.3.1 U251细胞株传代培养条件 U251细胞贴壁生长在含有10%胎牛血清、青霉素100 U/mL、链霉素100 mg/L的RPMI 1640完全培养液中。在37 ℃,5%CO2细胞培养箱内传代培养,0.25%胰蛋白酶消化,每2~3天消化1次,取对数生长期细胞用于实验。
1.3.2 试剂的配制 将鹿茸多肽溶解在PBS配制成1.0 mg/mL浓度,过滤除菌后,分装后-20 ℃备用。实验当日用不完全培养基配制鹿茸多肽工作液。
1.3.3 细胞生长抑制率测定(MTT法) 取对数生长期U251肿瘤细胞,用0.25%胰蛋白酶消化后,用完全培养基制成1×107细胞悬液。加入96孔细胞培养板,每孔100 μL,在37 ℃,5%CO2培养24 h后,更换含有50,100,200,400,800 μg/mL鹿茸多肽的培养液,对照组为完全培养基,每组设12个复孔,培养48 h后倾去培养液,每孔加入MTT溶液(5 mg/mL)10 μL,继续孵育4 h,倾去MTT溶液,每孔加DMSO 100 μL,振荡10 min然后在酶标仪上570 nm波长处测吸光度(OD值)。
1.3.4 细胞周期变化的检测(FCM法) 取对数生长期U251细胞接种至50 mL培养瓶中,细胞浓度为5×106个/瓶。培养24 h后,更换含有50,100,200,400,800 μg/mL鹿茸多肽的培养液,继续培养48 h,对照组为完全培养基。然后用0.25%胰酶消化细胞,离心(1 000 r/min,5 min),PBS漂洗并重悬;用终浓度50%冷乙醇4 ℃固定过夜,用PBS洗脱乙醇2次,3 000 r/min,10 min;加碘化丙啶(PI)染色,终浓度为50 μg/mL,4 ℃避光染色30 min,用FACS Calibur流式细胞仪进行细胞周期分析。
2 实验结果
2.1 鹿茸多肽对U251肿瘤细胞的增殖作用的影响 MTT法检测结果表明,与对照组比较,鹿茸多肽组肿瘤细胞抑制率显著增加,抑制率随药物浓度的增加,呈现浓度依赖性。表明鹿茸多肽对肿瘤细胞的增殖有明显的抑制效应。结果见表1。
表1 不同剂量鹿茸多肽对肿瘤细胞增殖抑制作用的比较(n=12)
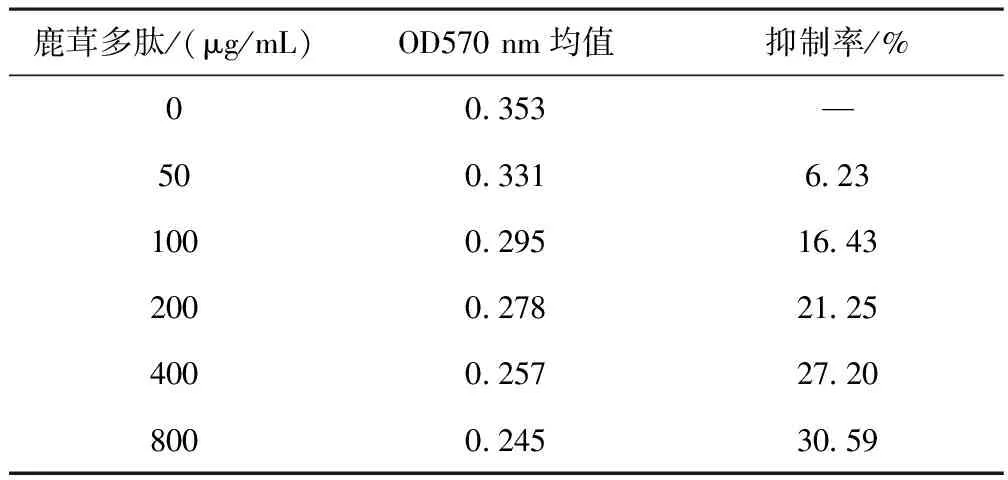
鹿茸多肽/(μg/mL)OD570 nm均值抑制率/% 00.353 — 500.331 6.231000.29516.432000.27821.254000.25727.208000.24530.59
2.2 鹿茸多肽对U251肿瘤细胞周期的变化的影响 流式细胞仪检测结果表明,从图1中可以看到在二倍体峰前出现了一个凋亡峰,凋亡峰所占的百分比分别为0.57%、0.68%,1.42%,1.82%,2.23%。可见到使大量处于增殖期的细胞阻滞于G0/G1期,不能进行增殖而表现为G0/G1期比例增高,部分细胞发生凋亡,其凋亡峰是低无到高,且逐渐增高,与对照组相比有一定差异,见表2。

表2 不同剂量鹿茸多肽对U251肿瘤细胞细胞周期的影响
3 讨论
细胞凋亡是肿瘤细胞抑制的重要路径之一,许多抗肿瘤药物通过诱导肿瘤细胞凋亡而起作用[3]。诱导肿瘤细的机制研究受到了人们的广泛关注。 细胞凋亡[4]指在一定生理和病理情况下机体为维护内外环境的稳定,通过基因调控,诱导、启动来实施细胞凋亡,是自身细胞的主动死亡过程。细胞凋亡与增殖是一对并存的矛盾,正常状况两者维持动态平衡,当细胞增殖与死亡的速度平衡失调时,则会增加肿瘤发生的可能性。 许多抗肿瘤药物可以通过干扰肿瘤细胞生长、代谢、增殖等过程,最终触发肿瘤细胞发生凋亡,从而达到治疗肿瘤的目的。 研究表明,许多中药的抑瘤作用[5]通过诱导肿瘤细胞凋亡机制实现的,因此中药抗肿瘤作用机制的研究有助于人们寻找适合的药物治疗肿瘤,同时更能进一步提示凋亡机制的发生[6-7]。 鹿茸多肽是从新鲜鹿茸中提取的一类多肽类物质,具较强的生物活性[8],鹿茸多肽对骨组织、神经纤维损伤的修复有明显的促进作用[9]。对细胞的增殖和分化有明显的调节作用。 细胞发生中一个密切而又独立的危险事件就是细胞周期变化,药物在诱导肿瘤细胞凋亡时多伴有细胞周期的阻滞,通过阻止细胞从G1期进入S期,使细胞阻滞于G1期,并使G1期细胞凋亡。 本实验研究了鹿茸多肽对肿瘤细胞生长增殖的抑制及其诱导细胞凋亡作用。通过对鹿茸多肽作用于细胞48 h后的细胞形态的观察和MTT法细胞生长抑制率[10]的测定及流式细胞仪[11]检测细胞周期。结果表明,大量处于增殖期的细胞阻滞于G0/G1期,不能进行增殖而表现为G0/Gl期比例增高,部分细胞发生凋亡,凋亡峰随着浓度的增加而增高,说明鹿茸多肽诱导肿瘤细胞凋亡作用存在着浓度依赖性。
[1]宗颖,刘侗,王志颖,等.鹿茸多肽成分及其药理作用研究[J].吉林中医药,2013,33(11):1135.
[2]范玉琳,邢增涛,卫功庆,等.鹿茸蛋白的提取分离及其抗肿瘤活性[J].经济动物学报,1998,2(1):27-31.
[3]闫华超,李林尉.抗肿瘤药物诱导肿瘤细胞凋亡机制的研究进展[J].聊城大学学报,2009,22(3):43-46.
[4]李文艺.细胞凋亡研究进展[J].畜牧与饲料科学,2010,31(11/12):17-19.
[5]姜殿君,刘阳,李全健,等.中药抑制肿瘤血管新生及其作用机制的研究进展[J].中国医药导刊,2012,14(3):462.
[6]代二庆,张明华,赵占考,等.中药调控肿瘤细胞凋亡机制研究[J].武警医学院学报,2008,17(11):1009-1012.
[7]金岩,李海波,关洪全,等.中药诱导肿瘤细胞凋亡机制的研究进展[J].中医研究,2005,18(3):52-56.
[8]张郑瑶,段冷昕,周秋丽,等.梅花鹿茸多肽的化学结构及生物活性[J].高等学校化学学报,2012,33(9):2000-2004.
[9]修忠标,江陟郝,孙磊.鹿茸多肽干预膝骨性关节炎软骨细胞的增殖[J].中国组织科学研究与临床康复,2011,15(24):4448-4452.
[10]何浪,李国军,刘光波,等.MTT法和WST-8法检测三羟异黄酮对SW480细胞生长抑制的比较[J].重庆医学,2011,40(26):2671-2672.
[11]赵书涛,武晓东,王策,等.流式细胞仪的原理、应用及最新进展[J].现代医学生物进展,2011,11(22):4378-4381.

