响应曲面法优化梅花鹿鹿角盘胶原蛋白提取工艺
刘少华,范 宁,李 梁,李慧萍,赵 岩,卫功庆,
(吉林农业大学中药材学院野生动物系,长春 130118)
“鹿角为鹿科动物马鹿(CgrvuselaphusLinnaeus)或梅花鹿(CervusnipponTemminck)已骨化的角或锯茸后翌年春季脱落的角基”[1]。据《神农本草经》记载,鹿角盘具有温补肝肾、活血消肿、治阴症疮疡、乳痈初起、瘀血肿痛等功效。现代研究表明,鹿角盘具有抗氧化[2]、抗疲劳、免疫调节、抗肿瘤、抗炎镇痛[3]、治疗骨质疏松[4]、乳腺增生等[5]作用。鹿角盘中含有大量的胶原蛋白,是其主要功效成分之一,但是,由于鹿角盘是鹿茸骨化后的产物,质地非常坚硬,不易粉碎,使得提取、分离较为困难,直接影响了人们对它的深入研究,因此,市场上关于鹿角盘的加工制品较为罕见[6]。笔者以梅花鹿鹿角盘为原料,研究响应曲面法优化酶解法提取鹿角盘胶原蛋白技术,为鹿科动物产品的综合开发和深度利用提供技术支撑。
1 材料与方法
1.1 材料 梅花鹿鹿角盘,购于吉林省长春市双阳区鹿乡镇;胃蛋白酶(1∶3 000)、对二甲氨基苯甲醛、L-羟脯氨酸,购于国药集团化学试剂有限公司;冰醋酸、浓盐酸、浓硫酸、硼酸、硫酸铜、硫酸钾、氯胺T、高氯酸、异丙醇、氢氧化钠、醋酸钠、柠檬酸均为国产分析纯。
1.2 仪器 TG628A分析电子天平(上海皖衡电子仪器有限公司);UV-1800紫外可见分光光度计(上海美普达仪器有限公司);电热恒温水浴锅(北京国华医疗器械厂);SHA-C数显水浴恒温振荡器(金坛市江南仪器厂);DHG-9246A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);冷冻干燥机(北京博医康实验仪器有限公司);PHS-W系列微机型pH计(上海般特仪器有限公司)。
1.3 方法
1.3.1 梅花鹿鹿角盘粉常规成分测定 水分测定:直接干燥法(GB 5009.3-2010);灰分测定:马福炉法(GB 5009.4-2010)蛋白质测定:凯氏定氮法(GB 5009.5-2010);脂肪测定:索氏抽提法(GB 5009.6-2003)。
1.3.2 样品及水解液中胶原蛋白含量的测定 采用对二甲氨基苯甲醛比色测定羟脯氨酸的含量[7],以羟脯氨酸浓度C为横坐标、吸光度A为纵坐标,绘制标准曲线,通过羟脯氨酸标准曲线换算出样品中羟脯氨酸的质量浓度,再乘以相应的系数即可转换为样品中胶原蛋白的含量。
1.4 工艺流程 梅花鹿鹿角盘→粉碎(过100目筛)→脱钙→脱钙后的梅花鹿鹿角盘粉+0.5 mol/L乙酸+胃蛋白酶→酶解→灭酶→抽滤→酶促酸溶胶原蛋白(PSC)→盐析→透析→冷冻干燥→酶促酸溶胶原蛋白(PSC)粉。
1.5 鹿角盘胶原蛋白提取工艺的单因素试验设计 通过预试验及有关文献确定料液比、pH值、加酶量、酶解温度和酶解时间5个单因素的水平分别为:料液比1∶10、1∶15、1∶20、1∶25、1∶30 g/mL;pH值1.4,1.6,1.8,2.0,2.2;加酶量(E/S)分别为1%、2%、3%、4%、5%;酶解温度分别为31,33,35,37,39 ℃;酶解时间分别为2,4,6,8,10 h。每个水平重复2次取平均值,考察这5个单因素对鹿角盘胶原蛋白提取率的影响。
1.6 鹿角盘胶原蛋白响应曲面法试验设计 以单因素试验为基础,通过响应面分析法和中心组合试验设计,利用Design-Expert软件进行数据分析。分析因素与设计见表1。

表1 试验因素、水平及编码
1.7 数据统计 数据统计处理及图表绘制采用Excel 2003及Design-Expert 8.0.4软件。
2 结果与分析
2.1 梅花鹿鹿角盘粉常规成分 见表2。
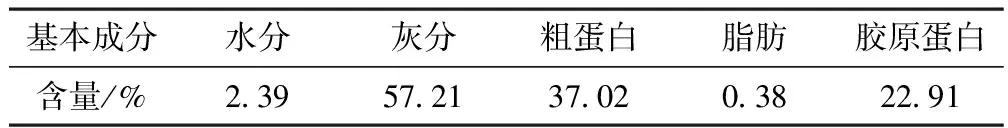
表2 梅花鹿鹿角盘粉基本成分
2.2 羟脯氨酸标准曲线 以羟脯氨酸浓度为横坐标,吸光值为纵坐标,绘制标准曲线。吸光度值和羟脯氨酸浓度的关系为:Y=0.086 8X+0.002,r2=0.999 3。
2.3 鹿角盘胶原蛋白提取工艺的单因素试验
2.3.1 料液比对鹿角盘胶原蛋白提取率的影响 当料液比达到1∶20时,胶原蛋白的提取率达到最大值80.70%,随后趋于平缓。在实验过程中可以发现,当料液比太低时,酶与底物不能充分结合,使反应不完全,从而得到较低的胶原蛋白提取率。随着料液比的增加,胶原蛋白溶出率增加,但料液比增加到一定程度时提取液中底物浓度减小,因此确定最适料液比为1∶20。
2.3.2 pH值对鹿角盘胶原蛋白提取率的影响 当pH<1.8时,胶原蛋白提取率随着pH值的增加而增加,pH1.8时达到最大值83.35%,当继续升高pH值时,胶原蛋白的提取率反而下降,这可能是由于不同的pH值可影响酶分子的催化能力及酶与底物的结合能力。极端的pH值可引起酶的变性失活,只有在适宜pH值范围内,酶才能显示其催化活性,因此确定最适pH值为1.8。
2.3.3 加酶量对鹿角盘胶原蛋白提取率的影响 当加酶量达到4%时,胶原蛋白提取率趋于平缓,分析原因可能当酶在反应体系中的总量趋于饱和后,继续增加加酶量,胶原蛋白提取率也没有得到显著提高,只会增加成本,因此确定最适加酶量为4%。
2.3.4 酶解温度对鹿角盘胶原蛋白提取率的影响 当酶解温度为37 ℃时,胶原蛋白提取率达到最大为82.01%,因此确定最佳酶解温度为37 ℃。
2.3.5 酶解时间对鹿角盘胶原蛋白提取率的影响 当酶解时间为6 h时胶原蛋白提取率达到最大为83.67%,随后胶原蛋白提取率逐渐降低,分析可能原因是在开始提取时,胶原还成聚合状态,没有被酶完全解链,随着时间的延长,大量的胶原分子解链,变成可溶性的胶原蛋白,但超过一定时间,胶原蛋白过度水解,导致胶原蛋白的流失,因此确定最佳酶解时间为6 h。
2.4 响应曲面法对鹿角盘胶原蛋白提取工艺的优化 选取pH值(A)、加酶量(B)、酶解温度(C)、酶解时间(D)4个因素,以梅花鹿角盘胶原蛋白提取率(Φ)作为评价指标对工艺参数进行优化,设计方案及结果,见表3。
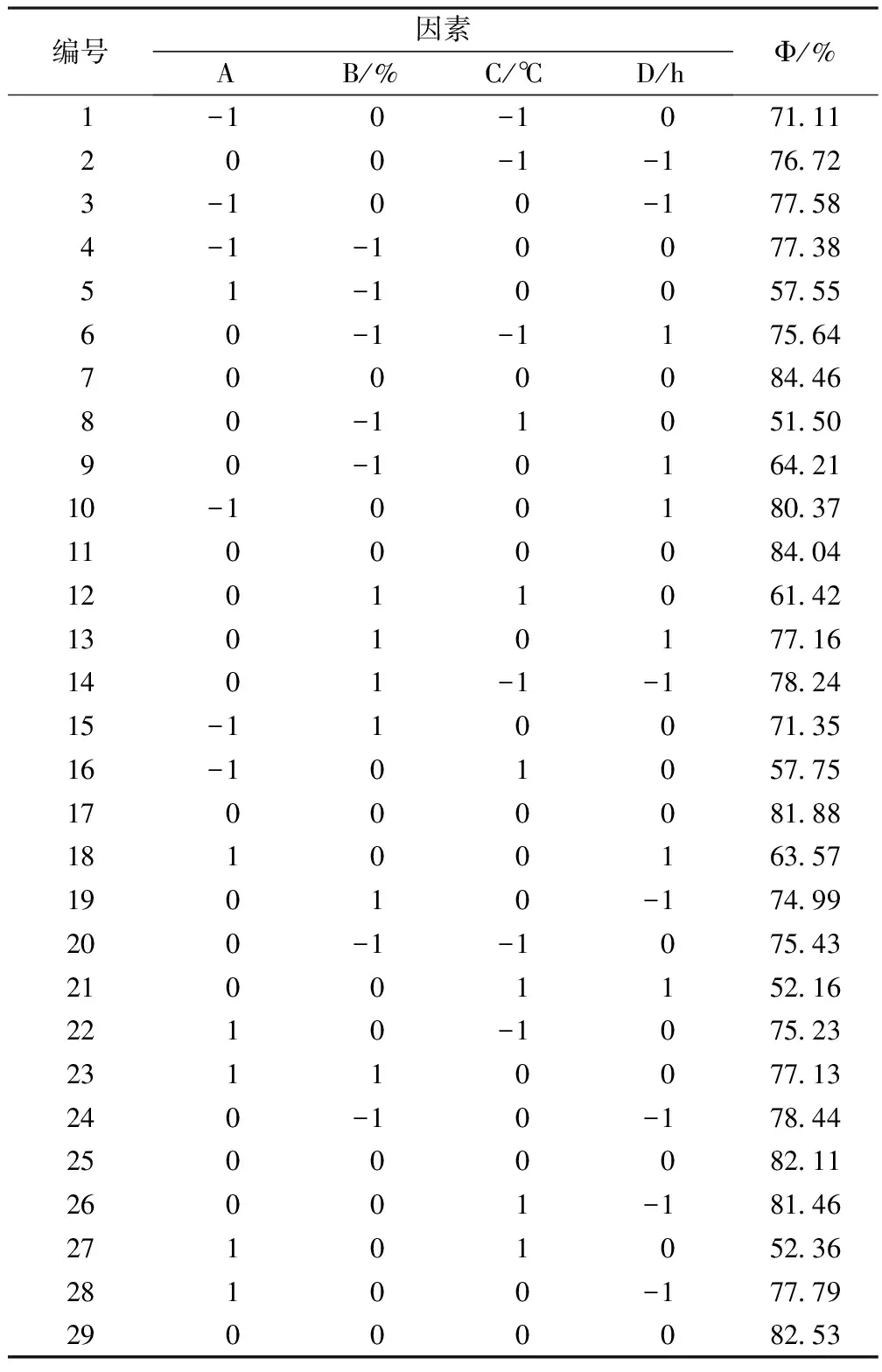
表3 响应曲面分析试验设计及结果
在以上29个试验中,7、11、17、25、29是中心试验,重复5次试验来估计试验误差。利用Design Expert软件对29个试验进行回归分析得出二次模型方差分析表。如表4所示。

表4 二次多项模型方差分析表
注:**表示P<0.01,表示有极显著差异;*表示P<0.05,表示有显著差异。
利用Design Expert软件,进行多元回归拟合,获得鹿角盘胶原蛋白提取率对编码自变量料液比、加酶量、酶解温度、酶解时间、pH值的二次多项回归方程:Φ=83.00-2.66A+2.98B-7.98C-4.49D+6.40AB-2.38AC-4.25AD+1.78BC+4.10BD-7.05CD-6.68A2-6.17B2-10.65C2-1.76D2。
由表4可知,该模型显著回归,应用该模型对试验真实值进行分析和预测是合理的。pH值、加酶量、酶解温度、酶解时间4个因素对胶原蛋白提取率影响的,主次顺序依次为:酶解温度>酶解时间>加酶量>pH值。失拟项的p值为0.011 5,说明失拟项不显著,模型的拟合性较好。RSN为12.048>4,因此,此模型可以对鹿角盘胶原蛋白提取工艺结果进行分析和预测。
在回归模型方差分析结果的基础上,根据得到的回归二次方程,利用Design Expert软件作pH值、加酶量、酶解温度、酶解时间对胶原蛋白提取率影响的响应曲面图,分析两个因素交互作用对鹿角盘胶原蛋白提取率的影响。
结果:各因素之间的交互作用对胶原蛋白提取率的影响的主次顺序为:CD>AB>AD>BD>AC>BC,其中CD、AB之间的交互作用有极显著差异,AD、BD之间的交互作用有显著差异,AC、BC之间的交互作用没有差异。
为确定最佳酶解工艺参数,对所得方程进行逐步回归,删除不显著项,然后求一阶偏导,并令其为0,可得胶原蛋白提取率达到最大值时的工艺条件:pH1.82、加酶量3.96%、酶解温度36.88 ℃、酶解时间4 h;考虑实际情况将其优化后的条件修正为pH 1.8、加酶量4%、酶解温度37 ℃、酶解时间4 h。
2.5 验证试验 称取10 g(精确到0.000 1 g)脱钙后的梅花鹿托盘粉3分,按照实际情况优化后的工艺条件pH 1.8、加酶量4%、酶解温度37 ℃、酶解时间4 h进行3次平行试验,得到鹿角盘胶原蛋白提取率为80.10%,与预测值基本一致,说明通过响应曲面法预测得到的优化工艺参数准确、可靠,具有一定的实用价值。
3 小结
笔者在以往研究[8-10]的基础上采用乙酸与胃蛋白酶相结合的方法提取鹿角盘中的胶原蛋白。
响应曲面法已成功应用于优化酶催化反应的处理条件如pH值、加酶量、酶解时间、酶解温度等。响应曲面法在评估有效因素和数学模型等方面能够准确描述相互作用的独立变量之间的相关关系[11-12]。李莉等[13]采用响应面法优化酶法提取大鲵皮胶原蛋白工艺,得出大鲵皮胶原蛋白提取率可达到66.99%。严子军等[14]采用响应面优化酶溶性罗非鱼鳞胶原蛋白的提取工艺,得出胶原蛋白的提取率为13.12%。任国艳等[15]采用响应面法优化胃蛋白酶提取草鱼鱼鳔胶原蛋白,得出胶原蛋白实际提取率为17.82%。笔者利用Design Expert软件,应用响应曲面法,对梅花鹿鹿角脱盘粉的胶原蛋白提取工艺进行优化,得到的优化工艺参数:pH为1.82、加酶量为3.96%、酶解温度为36.88 ℃、酶解时间4 h;考虑实际情况,将其优化后的条件进行修正后,胶原蛋白提取率为80.10%。试验过程中得到的胶原蛋白仅为粗品,后续试验将对鹿角盘胶原蛋白的分离、纯化、理化性质及其酶解产物生物活性进一步研究。
[1]国家药典委员会.中国药典[M].北京:中国医药科技出版社,2010:302.
[2]于文影,郜玉钢,郝建勋,等.鹿角盘蛋白酶解工艺优化及其水解物抗氧化活性研究[J].时珍国医国药,2011,22(11):2699-2700.
[3]牛放,赵雨,杨菲,等.梅花鹿鹿角托盘提取物的抗炎镇痛作用[J].中国医院药学杂志,2011,31(10):789-791.
[4]牛放,赵雨,徐云凤,等.鹿角盘胶原蛋白对去卵巢所致骨质疏松大鼠的治疗作用[J].中国现代应用药学,2012,29(2):93-96.
[5]张宝香,姜英.鹿角盘蛋白质酶法水解作用研究[J].特产研究,2012,(4):13-15.
[6]Wu F F,Li H Q,Jin L J,et al.Deer antler base as a traditional Chinese medicine:A review of its traditional uses,chemistry and pharmacology[J].Journal of Ethnopharmacology,2013,145(2):403-415.
[7]蓝蔚青,王川,李燕,等.猪皮中羟脯氨酸含量的测定[J].中国食物与营养,2006(10):38-40.
[8]白海英,柯蕾芬,朱文赫,等.胶原蛋白应用的研究进展[J].吉林医药学院学报,2013,34(2):133-134.
[9]徐云凤,赵雨,张鹤,等.酶解法制备鹿角盘胶原蛋白的工艺[J].食品研究与开发,2011,32(1):13-16.
[10]张鹤.梅花鹿胶原蛋白制备及治疗骨质疏松症研究[D].长春:长春中医药大学,2011.
[11]Fang X B,Xie N N,Chen X E,et al.Optimization of antioxidant hydrolysate production from flying squid muscle protein using response surface methodology[J].Food and Bioproducts Processing,2012,90:676-682.
[12]Karina D.Martínez,Ana M.R.Pilosof.Relative visco elasticity of soy protein hydrolysate and polysaccharid es mixtures at cooling conditions analyzed by response surface methodology[J].Food Hydrocolloids,2012,26:318-322.
[13]李莉,顾赛麒,王锡昌,等.响应面法优化酶法提取大鲵皮胶原蛋白工艺[J].中国水产科学,2013,20(4):876-883.
[14]严子军,纪洁清,刘永,等.响应面优化酶溶性罗非鱼鳞胶原蛋白的提取工艺[J].广东农业科学,2013(18):86-88.
[15]任国艳,詹永献,郭金英,等.响应面优化草鱼鱼鳔酶溶胶原蛋白的提取工艺[J].食品科学,2012,33(22):154-157.

