人肺动脉平滑肌细胞中微小RNA-210通过MKP-1负性调节低氧下细胞的增殖*
靳有鹏, 庞婷婷, 王 伟, 王玉林
(山东大学附属省立医院儿科, 山东 济南 250021)
慢性低氧性肺动脉高压是临床许多心肺疾病发生发展过程中伴随或最终的病理生理环节,是一种严重的甚至危及生命的肺血管性疾病,临床上表现为肺动脉压力增高、肺血管阻力增加,右心室阻力负荷过重最终致右心衰竭,组织病理学改变为累及全层的血管炎,管壁的所有成分细胞均受累,最终肺血管及右室重塑。
微小RNA(microRNA,miRNA)是广泛存在于真核生物中的一类长度为20~24个核苷酸所构成的内源性非编码调控单链小分子RNA,它是由含有茎环结构的miRNA前体经Dicer剪切而成。越来越多的研究证实,miRNA作为重要的转录后调节基因,通过抑制靶信使mRNA 的翻译而起到重要的调控作用,参与细胞的分化、增殖、凋亡以及多种生物组织的发育调节过程[1]。研究表明哺乳动物中50%~60%的mRNA受miRNA调控[2]。
近年来的研究表明,miRNA在低氧下细胞进行生理性及病理性调节过程中发挥着举足轻重的作用。其中一些miRNA的表达显著地受低氧调节,因此被命名为“低氧相关的微小RNA(hypoxia-related miRNA)”[3]。MicroRNA-210(miR-210)是一种在低氧下表达显著上调的miRNA,它参与调节血管生成、细胞凋亡、增殖、分化、DNA修复、线粒体代谢以及肿瘤生长[4-7],其在肺动脉高压中的作用日益受到重视,有研究发现在慢性低氧所致肺动脉高压鼠的肺组织中miR-210表达上调[8], 但其在低氧性肺动脉高压中的作用仍不甚清楚。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)细胞内信号转导途径广泛存在。真核细胞中是由4种激酶组成的链式反应,其中,每种激酶都通过复杂的反应网络激活下游底物激酶,调节细胞生长、增殖、分化或凋亡,被广泛用于细胞信号转导的研究。它的级联反应实际上是分3步进行的:首先是MAPKK激酶(MAPKK kinase,MKKK)磷酸化激活MAPK激酶(MAPK kinase,MKK),后者活化后磷酸化激活MAPK,活化的MAPK再去激活一些转录因子,调控基因表达。活化的MAPK主要被其磷酸酶去磷酸化而失活,这其中丝裂原活化蛋白激酶磷酸酶1(mitogen-activated protein kinase phosphatase 1,MKP-1)的作用最为重要。研究发现, MKP-1可被低氧诱导[9],近年来,越来越多的研究发现其在肺动脉高压中起着重要作用。一项研究发现MKP-1缺失的小鼠易发展为重度肺动脉高压[10],也有研究证实西地那非通过诱导MKP-1在肺动脉平滑肌细胞中发挥细胞保护作用[11]。但关于miR-210通过调节MKP-1而参与肺动脉高压的相关研究,至今尚未见报道。
本文旨在研究低氧时人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cells, hPASMCs)miR-210和MKP-1的表达情况、它们之间的相互关系以及对肺动脉平滑肌细胞增殖的影响,为治疗低氧性肺动脉高压提供新的思路。
材 料 和 方 法
1 主要试剂
人肺动脉平滑肌细胞购于Lonza;RNA提取试剂Trizol和转染试剂购自Invitrogen;实时荧光定量PCR试剂盒、引物、miRNA抑制剂及增强剂均购自生命技术公司。
2 细胞培养和分组
将hPASMCs置于含4.9% FBS及多种生长因子的培养基中,当细胞贴壁生长至80%~90%融合时进行传代或用于实验分组接种,取4~8代细胞用于实验。每次实验前取状态良好的对数生长期细胞,经含0.02% EDTA/0.25%胰蛋白酶消化液消化,形成细胞悬液后分组接种,细胞于贴壁24 h后,换无血清培养基24 h使细胞生长同步化,再分别处理各实验组。实验分组:共分成12组,常氧处理(21% O2、5% CO2)6组和低氧处理(1% O2、5%CO2)6组,见表1。
3 主要方法
3.1实时荧光定量PCR法检测各组平滑肌细胞中miR-210和MKP-1 mRNA的表达 RNA提取试剂和转染试剂均购自Invitrogen。用Trizol试剂提取细胞总RNA并测定其浓度,逆转录成cDNA,再按说明书进行实时荧光定量PCR。以RNU48作为小RNA含量的内参照。PCR反应条件:95 ℃ 15 min热启动,然后94 ℃ 15 s,60 ℃ 30 s、72 ℃ 30 s,共40个循环。最后通过解链曲线分析扩增产物的特异性。 miRNA的相对表达量用2-ΔΔCt方法来表示。
3.2用Western blotting法比较各组MKP-1蛋白的表达 提取细胞总蛋白,取20 μg细胞总蛋白进行聚丙烯酰胺凝胶电泳,按湿转法将电泳产物转移到PVDF膜,5%脱脂奶粉4 ℃封闭2 h,滴加Ⅰ抗(1∶1 000)4 ℃过夜,TBST洗膜,滴加Ⅱ抗(1∶1 000)室温孵育2 h,TBST洗膜后显色,并用β-actin作为内参照。
3.3MTT法检测肺动脉平滑肌细胞的增殖 培养细胞中加入20 μL MTT溶液,继续37 ℃孵育4 h后,吸弃培养上清液,加入DMSO 150 μL,振荡10 min。在ELISA检测仪上测定各孔的A490值。
4 统计学处理
数据以均数±标准误 (mean±SEM) 来表示,两组间比较采用t检验,多组间比较采用方差分析,用SPSS 11.0统计软件处理,以P<0.05为差异有统计学意义。

表1 细胞培养和实验分组
结 果
1 低氧时hPASMCs miR-210的表达
hPASMCs分别放置于21% O2或1% O2的培养箱中48 h后,发现miR-210的表达水平明显增加,见图1。

Figure 1. The expression of miR-210 in the hPASMCs determined by quantitative real-time PCR analysis.The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h. miR-210 mRNA levels were normalized to RNU48 expression.Mean±SEM.n=3. **P<0.01 vs 21% O2.
2 低氧时hPASMCs MKP-1的表达
hPASMCs分别放置于21% O2或1% O2的培养箱中48 h后,发现MKP-1 mRNA和蛋白的表达明显增加,见图2。

Figure 2. Expression of MKP-1 mRNA (A) and protein (B) in the hPASMCs. The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h.Mean±SEM.n=3.**P<0.01 vs 21% O2.
3 抑制miR-210表达使MKP-1的表达增加并可抑制低氧诱导的细胞增殖
将miR-210抑制剂转染入hPASMCs内,再分别放置于21% O2或1% O2的培养箱中48 h后,发现常氧及低氧下,miR-210抑制剂明显抑制miR-210的表达,增加MKP-1的表达,但只有低氧下抑制miR-210的表达后hPASMCs的增殖受到抑制,常氧下却没有这种效应,见图3。
4 miR-210过表达可抑制低氧诱导的MKP-1表达上调但不影响细胞增殖
将miR-210增强剂转染入hPASMCs内,再分别放置于21% O2或1% O2的培养箱中48 h后,实验结果表明,miR-210过表达明显抑制低氧诱导的MKP-1表达上调,但常氧及低氧均未影响hPASMCs的增殖,见表2、图4。
5 MKP-1基因沉默后,低氧下miR-210抑制剂对细胞增殖的抑制作用消失
再将miR-210抑制剂转染入hPASMCs内,再分别放置于1% O2培养箱中48 h后,实验结果表明MKP-1基因沉默后,低氧下miR-210抑制剂对细胞增殖的抑制作用消失,见图5。
讨 论
2007年首次报道了通过微距阵的方法发现了低氧下miR-210的表达会上调,该作用可被低氧诱导因子 1α(hypoxia-inducible factor 1α,HIF-1α)或低氧诱导因子 2α(hypoxia-inducible factor 2α,HIF-2α)所诱导。本研究发现将hPASMCs置于低氧培养箱中48 h,miR-210的表达升高2.5倍左右,说明hPASMCs中miR-210的表达可被低氧所诱导。有研究发现,在急性缺氧的情况下,低氧诱导的miR-210通过下调铁硫蛋白1/2[12]或线粒体电子传递蛋白[13-14]的表达来保障细胞存活,然而,另一方面这又是引起慢性缺氧性疾病的病理生理基础。
MKP-1属于丝裂原活化蛋白激酶家族,是细胞内的一种丝氨酸/苏氨酸蛋白激酶。MKP-1的表达在多种因素刺激下均会增加,包括低氧、过氧化、糖皮质激素升高、热休克等。本研究同样发现低氧下的hPASMCs中MKP-1的表达增加。在多种细胞生理反应(如生长因子信号调节通路、细胞的炎症、分化及凋亡等)中,MKP-1都通过使丝裂原活化蛋白激酶去磷酸化而提供重要的负反馈调节机制。类似miR-210,在低氧状态下MKP-1也发挥着很多作用。研究表明MKP-1基因敲除的小鼠易表现为过度的炎症反应,易患自身免疫性疾病及代谢缺陷病[15-16]。
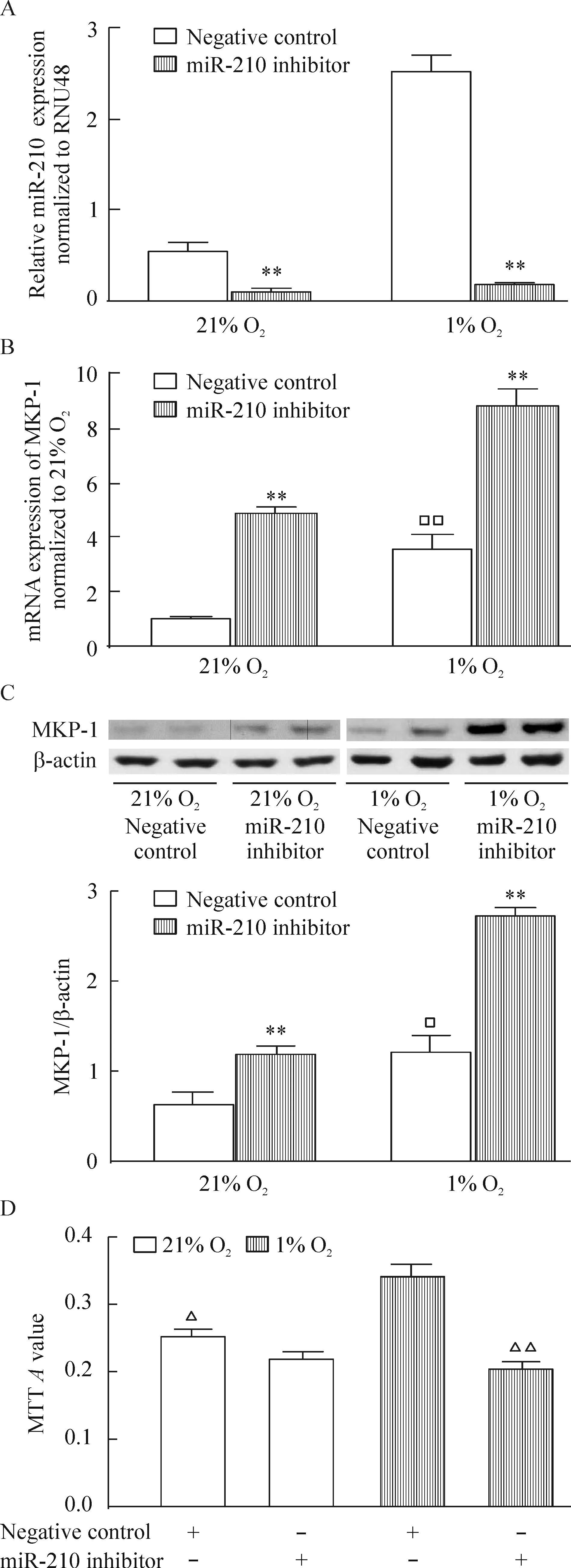
Figure 3. The effects of miR-210 inhibitor on hypoxia-induced MKP-1 expression and proliferation in the hPASMCs. The hPASMCs were exposed to 21% O2 (normoxia) or 1% O2 (hypoxia) for 48 h. A: miR-210 expression; B,C: MKP-1 mRNA and protein expression; D: proliferation of hPASMCs. Mean±SEM.n=3.**P<0.01 vs negative control;□P<0.05,□□P<0.01 vs 21% O2;△P<0.05,△△P<0.01 vs 1% O2+negative control.

表2 miR-210增强剂对miR-210表达的影响
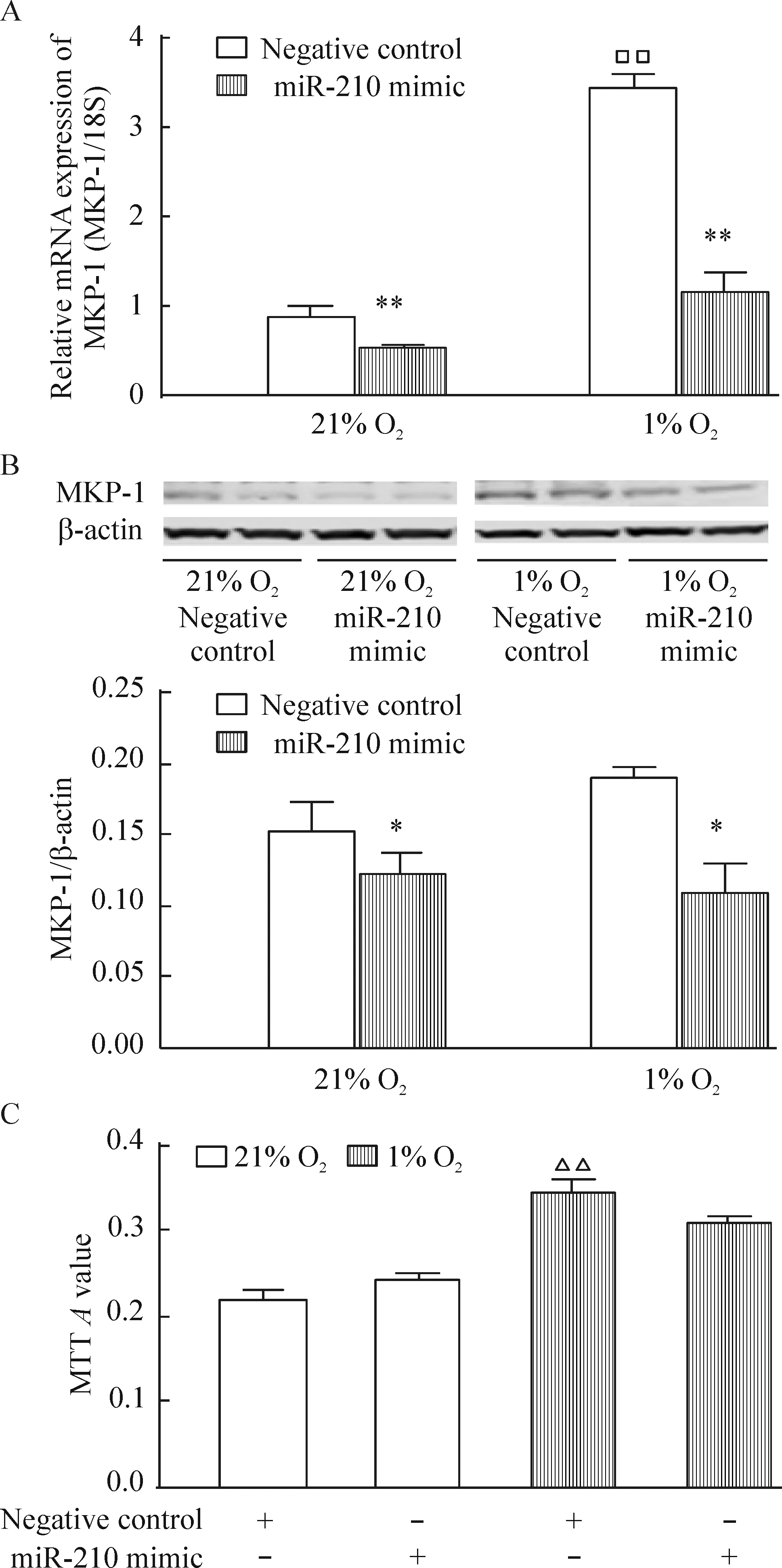
Figure 4. The effects of miR-210 mimic on MKP-1 expression (A,B) and proliferation (C) in the hPASMCs.The hPASMCs were exposed to 21%O2 (normoxia) or 1%O2 (hypoxia)for 48 h. Mean±SEM.n=3.*P<0.05,**P<0.01 vs negative control;□□P<0.01 vs 21% O2; △△P<0.01 vs 21% O2 negative control.
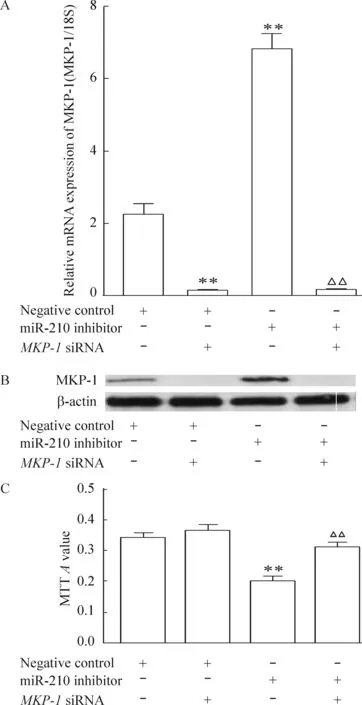
Figure 5. The effects of MKP-1 knockdown (A,B) on miR-210 inhibitor-decreased hPASMC proliferation (C) under hypoxia.Mean±SEM.n=3.**P<0.01 vs negative control; △△P<0.01 vs miR-210 inhibitor.
另有一项研究发现MKP-1缺失的小鼠在低氧下易患更严重的肺动脉高压,提示MKP-1在低氧性肺高压中发挥着重要作用[10]。
虽然miR-210和MKP-1在低氧性肺动脉高压的发生发展中均起着举足轻重的作用,但它们之间的相互关系仍不甚清楚。本研究结果显示不论是低氧下或常氧下的hPASMCs中,抑制miR-210的表达后,MKP-1转录后水平的表达均增加,而增加miR-210的表达后,MKP-1转录后水平的表达均下降。由此说明,hPASMCs的MKP-1是miR-210的靶基因。通常MKP-1通过MAPK起作用,且MKP-1的作用取决于其与MKK的相对活性,关于miR-210与MKK的关系尚未见报道,miR-210是否进一步通过调节MKK的活性来调节肺动脉平滑肌细胞的增殖尚不清楚,仍需进一步研究来证实。
本研究还发现在hPASMCs中,抑制miR-210的表达可以减少低氧诱导的细胞凋亡,但miR-210的过表达却并不影响细胞的增殖情况,由此说明,低氧下miR-210可负性调节hPASMCs的增殖,然而,近年来有另外一项研究报道[17],miR-210在hPASMCs中发挥抗凋亡的作用而并不影响细胞的增殖,这似与本研究结果有所不同,究其原因可能有如下两方面。一是,这2个实验所采用的培养细胞的氧浓度不同,本研究采用的氧浓度为1%,而另一研究采用的氧浓度为3%。二是,另有其它研究发现miRNA对靶基因呈非线性、剂量依赖性的选择性调节作用[18],本研究中miR-210抑制剂的量与另一研究中所采用的剂量也不同,这可能也是原因之一。而且,miR-210抑制剂对细胞增殖的负性调节作用需依靠MKP-1来发挥,具体机制仍需进一步研究。
综上所述,本研究发现在低氧下的hPASMCs中,MKP-1是miR-210的一个新的靶基因,MKP-1可以介导miR-210抑制剂对hPASMCs增殖的负性调节作用,这有望成为治疗低氧性动脉肺高压的新的靶点。
[参 考 文 献]
[1] Pushparaj PN, Aarthi JJ, Kumar SD, et al. RNAi and RNAa: the Yin and Yang of RNAome[J]. Bioinformation, 2008, 2(6): 235-237.
[2] Lodish HF, Zhou B, Liu G, et al. Micromanagement of the immune system by microRNAs[J]. Nat Rev Immunol, 2008, 8(2):120-130.
[3] Hale AE, White K, Chan SY. Hypoxamirs in pulmonary hypertension: breathing new life into pulmonary vascular research [J]. Cardiovasc Diagn Ther, 2012, 2(3):200-212.
[4] Huang X, Le QT, Giaccia AJ. MiR-210: micromanager of the hypoxia pathway [J]. Trends Mol Med, 2010, 16(5):230-237.
[5] Kulshreshtha R, Ferracin M, Wojcik S, et al. A microRNA signature of hypoxia [J]. Mol Cell Biol, 2007, 27(5):1859-1867.
[6] Fasanaro P, D’Alessandra Y, Di Stefano V, et al. MicroRNA-210 modulates endothelial cell response to hypoxia and inhibits the receptor tyrosine kinase ligand Ephrin-A3[J]. J Biol Chem, 2008, 283(23):15878-15883.
[7] Won Kim H, Haider HK, Jiang S, et al. Ischemic preconditioning augments survival of stem cells via miR-210 expression by targeting caspase-8-associated protein 2 [J]. J Biol Chem, 2009, 284(48):33161-33168.
[8] Yang S, Banerjee S, de Freitas A, et al. miR-21 regulates chronic hypoxia-induced pulmonary vascular remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(6): L521-L529.
[9] Seta KA, Kim R, Kim HW, et al. Hypoxia-induced regulation of MAPK phosphatase-1 as identified by subtractive suppression hybridization and cDNA microarray analysis [J]. J Biol Chem, 2001, 276(48):44405-44412.
[10] Jin Y, Calvert TJ, Chen B, et al. Mice deficient in Mkp-1 develop more severe pulmonary hypertension and greater lung protein levels of arginase in response to chronic hypoxia[J]. Am J Physiol Heart Circ Physiol, 2010, 298(5): H1518-H1528.
[11] Li B, Yang L, Shen J, et al. The antiproliferative effect of sildenafil on pulmonary artery smooth muscle cells is mediated via upregulation of mitogen-activated protein kinase phosphatase-1 and degradation of extracellular signal-regulated kinase 1/2 phosphorylation [J]. Anesth Analg, 2007, 105(4): 1034-1041.
[12] Chan SY, Zhang YY, Hemann C, et al. MicroRNA-210 controls mitochondrial metabolism during hypoxia by repressing the iron-sulfur cluster assembly proteins ISCU1/2[J]. Cell Metab, 2009, 10(4):273-284.
[13] Muralimanoharan S, Maloyan A, Mele J, et al. MIR-210 modulates mitochondrial respiration in placenta with preeclampsia[J]. Placenta, 2012, 33(10): 816-823.
[14] Puisségur MP, Mazure NM, Bertero T, et al. miR-210 is overexpressed in late stages of lung cancer and mediates mitochondrial alterations associated with modulation of HIF-1 activity[J]. Cell Death Differ, 2011, 18(3): 465-478.
[15] Bennett AM, Tonks NK. Regulation of distinct stages of skeletal muscle differentiation by mitogen-activated protein kinases[J]. Science, 1997, 278(5341): 1288-1290.
[16] Liu Y, Shepherd EG, Nelin LD. MAPK phosphatases: regulating the immune response[J]. Nat Rev Immunol, 2007, 7(3):202-212.
[17] Gou D, Ramchandran R, Peng X, et al. miR-210 has an antiapoptotic effect in pulmonary artery smooth muscle cells during hypoxia[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(8):L682-L691.
[18] Shu J, Xia Z, Li L, et al. Dose-dependent differential mRNA target selection and regulation by let-7a-7f and miR-17-92 cluster microRNAs[J]. RNA Biol, 2012, 9(v10):1275-1287.

