合成气发酵梭菌C.autoethanogenum的生长特性与CO发酵性能*
徐惠娟 梁翠谊 许敬亮 郭颖 张宇 庄新姝 袁振宏†
(1.中国科学院 广州能源研究所∥可再生能源重点实验室,广东 广州 510640;2.中国科学院大学,北京100049)
自1987年发现第一株可以利用CO 或CO2、H2进行生长并发酵产乙醇的微生物Clostridium ljungdahlii(C.ljungdahlii)之后,一种新的乙醇生产技术——合成气发酵应运而生.该技术以煤、生物质或有机废弃物的气化合成气(主要成分为CO、CO2和H2)为原料,利用特定的微生物将其发酵为乙醇.由于气化过程可以将原料中的所有含碳有机物转化为合成气,因此包括木质素在内的一些难降解物质都可以被利用;而且合成气生物转化具有反应条件温和、专一性强及对合成气中的某些毒害气体具耐受性等优点[1-2].除气化合成气外,一些富CO 的工业废气(如转炉气、电石炉气、黄磷炉气等)也可以被合成气发酵微生物利用及转化.
C.ljungdahlii 是最早被研究也是研究得最多的合成气乙醇发酵菌株[3-7],此后,研究者们又陆续发现了其他的一些合成气发酵菌株,包括Clostridium carboxidivorans(C.carboxidivorans)[8-9]、Clostridium autoethanogenum(C.autoethanogenum)[10]、Clostridium ragsdalei(C.ragsdalei)[11-12]及Alkalibaculum bacchi(A.bacchi)[13]等.这些菌株产乙醇的能力各不相同.据报道,C.ljungdahlii 在具细胞循环的连续搅拌罐式反应器(CSTR)中发酵,乙醇的质量浓度高达48 g/L[14];C.carboxidivorans 在 鼓 泡 柱 式 反 应 器(BCR)中发酵13 d 后,乙醇质量浓度达2.75 g/L[15];同样在具细胞循环的CSTR 中,A.bacchi 连续发酵30 d 后的乙醇质量浓度达5 g/L 以上[16].相较之下,C.autoethanogenum 的相关研究较少,而且在仅有的一些报道中,其合成气发酵的乙醇质量浓度都在0.5 g/L 以下[17-18].合成气发酵菌株基本都是严格厌氧菌,因而通常采用厌氧瓶或血清瓶对它们进行批式发酵研究,下层液相为培养基和菌体,气体底物充满上层空间.但是对于一个气体底物发酵过程而言,这两种容器都存在一定缺陷:由于底物处于固定体积的上层气相中,随着底物的利用,上层气相的压力会逐渐降低,不利于底物的进一步利用,而且这种体积固定的玻璃瓶不便于监测、计量气体的利用情况.有鉴于此,文中拟采用一种新的反应容器来研究合成气发酵过程,克服厌氧瓶或血清瓶的上述缺陷.
C.autoethanogenum 可以利用木糖,且木糖是其生长的优良底物.木质纤维素原料水解液中的一个重要组分即是木糖,但这部分木糖较难被发酵利用.因此,文中拟以C.autoethanogenum 为研究对象,考察其对木质纤维素水解液的利用及CO 发酵性能,探索气体发酵制乙醇的新工艺.
1 材料与方法
1.1 菌株与培养基
所用菌株C.autoethanogenum DSM 10061 购自德国菌种保藏中心.
生长培养基在DSMZ640 培养基[18]和Rajagopalan 培养基[19]的基础上进行了改良,成分(每升)如下:10 mL 无机盐溶液,10 mL 微量元素溶液,10 mL维生素溶液,1.0 g 酵母膏,2.0 g 蛋白胨,0.5 g 半胱氨酸盐酸,5.0 g 吗啉乙磺酸,0.5 mL 0.1%刃天青,5.0 g 木糖,pH=6.其中,无机盐溶液组成如下:NaCl 80 g/L,NH4Cl 100 g/L,KCl 10 g/L,KH2PO410 g/L,MgSO4·7H2O 20 g/L,CaCl2·2H2O 4 g/L;微量元素溶液组成如下:次氮基三乙酸2 g/L,MnCl2·4H2O 1.3 g/L,CoCl2·6H2O 0.2 g/L,ZnSO4·7H2O 0.2 g/L,FeCl3·6H2O 0.4 g/L,CuCl2·2H2O 0.02 g/L,NiCl2·6H2O 0.02 g/L,Na2MoO4·2H2O 0.02 g/L,Na2WO4·2H2O 0.025 g/L;维生素溶液组成如下:生物素2 mg/L,叶酸2 mg/L,维生素B610 mg/L,维生素B15 mg/L,核黄素5 mg/L,烟酸5 mg/L,泛酸钙5 mg/L,维生素B125 mg/L,对氨基苯甲酸5 mg/L.
发酵培养基不含木糖和蛋白胨,其余组分同生长培养基,pH=6.
配制好的培养基于121 ℃下高压蒸汽灭菌20 min后,从灭菌锅中取出,立即放入厌氧操作箱中(气氛组成:N285%,H210%,CO25%),待培养基显示无色后加塞密封.所有接种及取样等操作均在厌氧箱中进行.
1.2 分析方法
发酵液于4 ℃、12000 r/min 下离心10 min,取上清.乙醇与乙酸含量采用Agilent 7890A 型气相色谱仪检测,载气为Ar,采用DB-FFAP 毛细柱(30 m ×0.25 mm×0.25 μm)和FID 检测器,进样口温度为250 ℃,检测器温度为300 ℃.色谱柱先在40 ℃下保持5 min;然后以20 ℃/min 的速度升温至140 ℃,保持3 min;继续以40 ℃/min 的速度升温至250 ℃,再保持3 min.柱流量为1 mL/min,载气流率为30 mL/min,分流比为l∶50.
发酵液中残糖及水解液的成分采用Waters2498高效液相色谱仪(HPLC)检测,Shodex Sugar SH1011柱,以0.005 mol/L 的H2SO4作为流动相,流量为0.5 mL/min,柱温为50 ℃,UV-RI 检测器,检测器温度为50℃.样品需预先离心(12000r/min,10min)并以0.22 μm 滤膜过滤.
气体组分检测采用Agilent 7890A 型气相色谱仪,Agilent 5A 分子筛柱(8ft ×1/8″ ×2 mm,60~80目)和Agilent Hayesep Q 柱(6ft ×1/8″ ×2 mm,80~100 目),进样器温度为200 ℃,分流比为20 ∶1,柱流量为3 mL/min,TCD 检测器温度为200 ℃.柱子先在60 ℃下保持3 min,再以15 ℃/min 的速率升温到250 ℃.
通过检测600 nm 波长下菌液的光密度(OD)值来测量菌体密度,再根据OD 值与干重的计量关系计算得到细胞干重.前期研究已知每一个OD600对应的细胞干重为247 mg/L.
1.3 碳源对C.autoethanogenum 生长影响的检测
分别以葡萄糖和纤维二糖代替生长培养基中的木糖,保持质量浓度不变(5.0 g/L),配制成相应的培养基,按10%的接种量接种活化后的C.autoethanogenum 至不同培养基中,于37 ℃培养箱中静置培养4 d,取样检测OD600值及糖含量.在100 mL厌氧瓶中进行反应,培养基为50 mL.
1.4 C.autoethanogenum 生长曲线的测定
反应在500mL 厌氧瓶中进行.按10%的接种量接种活化后的C.autoethanogenum 至生长培养基中,37 ℃下静置培养,定时取样检测OD600值、残糖及产物质量浓度.
1.5 气袋生长-发酵实验
反应在1 L 铝箔气体采样袋(简称气袋,大连德霖气体包装有限公司生产)中进行.气袋预先以N2充放气3 次,再以CO 充放气3 次,然后在压力为0.015 MPa、流量为0.8 L/min 的条件下充气(CO)1 min,关闭旋塞.按10%的接种量接种生长至对数期的C.autoethanogenum 于发酵培养基中,混匀后用注射器抽取样品,从旋塞上的小孔注入气袋中,每个气袋加入55 mL.气袋置于37 ℃培养箱中静置培养,待气袋完全扁下去后取样检测残留气体成分、OD600值及产物质量浓度.随后,按上述条件再次向气袋充气(CO),重新灌充CO 的气袋继续置于培养箱中培养,待气袋再次完全扁下去后同上进行第二次检测.
CO 乙醇转化率根据下式计算:

1.6 C.autoethanogenum 对蔗渣水解液的利用实验
甘蔗渣粉碎至40~80 目,水洗后于105 ℃下烘干,以1∶20 的质量比与水混合,置于水解反应器中进行水解,水解液冷却后于12 000 r/min 下离心10 min,取上清.以水解液离心后的上清代替生长培养基中的木糖及水,配制成水解液培养基(pH=6).按10%的接种量接种生长至对数期的C.autoethanogenum 于水解液培养基中,在37 ℃下静置培养4 d,取样检测OD600值、残糖及产物质量浓度.反应在100 mL 厌氧瓶中进行,培养基为50 mL.
2 结果与讨论
2.1 碳源对C.autoethanogenum 生长的影响
德国菌种保藏中心推荐的C.autoethanogenum生长培养基中既含木糖,又含纤维二糖,而Abrini等[10]认为C.autoethanogenum 不能利用葡萄糖.文中分别以木糖、葡萄糖和纤维二糖为唯一碳源配制生长培养基,考察C.autoethanogenum 对不同碳源的利用情况,结果如图1 所示.从图中可以看出:以木糖为碳源时C.autoethanogenum 生长最好,菌体质量浓度及糖利用率都远远高于其他两种碳源;C.autoethanogenum 在葡萄糖及纤维二糖培养基中都有少量生长,但是糖利用率都较低(小于10%),其中对纤维二糖的利用最少.这说明葡萄糖和纤维二糖都不适宜作为C.autoethanogenum 生长培养基的碳源,因此后续研究中均以木糖为生长培养基中的唯一碳源.

图1 C.autoethanogenum 对不同碳源的利用Fig.1 Utilization of different carbon sources by C.autoethanogenum
2.2 C.autoethanogenum 在改良培养基中的生长曲线
图2 为C.autoethanogenum 在改良培养基中的生长曲线.从图中可以看出:第1 天为生长延滞期;从第2 天开始,C.autoethanogenum 进入对数生长期;第4 天后进入稳定期.菌株生长的同时伴随着木糖的消耗及乙酸的生成,而乙醇只在对数生长中期才开始被检测到,且量很少(小于0.25 g/L),整个生长阶段变化不大,说明乙酸是生长偶联型产物,而乙醇是非生长偶联型产物,这与Klasson 等[20]对C.ljungdahlii 的研究结果一致.因为乙醇和乙酸是由中间代谢物乙酰辅酶A 在不同酶的催化下转化而成的,生成乙酸能产生一分子ATP(三磷酸腺苷),生成乙醇则不能,因此菌体生长阶段的主要产物是乙酸.此外,在改良培养基中培养4 d 后,C.autoethanogenum 的菌体质量浓度可达311 mg/L,是之前郭颖等[21]研究结果的3 倍多.

图2 C.autoethanogenum 的生长曲线Fig.2 Growth curves of C.autoethanogenum
2.3 气袋生长-发酵实验结果及分析
CO 发酵是一个厌氧气态底物发酵过程,反应式如下所示:

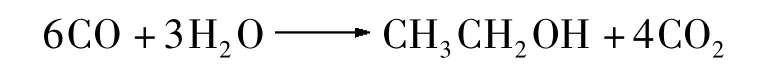
该过程对反应装置的密封性能要求比较高,普通的厌氧瓶较难满足这一点.这是因为,注入瓶中的CO 可能从瓶口泄漏,而且CO 被利用后会使得瓶内上层气相压力降低,存在氧气渗入的可能.文中采用密封性能良好的气体采样袋来研究C.autoethanogenum 的CO 发酵性能,反应前后的气袋变化如图3 所示.由于气袋具有弹性体积,随着CO 逐步被C.autoethanogenum 利用,气袋的体积会逐渐缩小,这既便于观察又使得上层气相的压力相对稳定.虽然发酵过程中会产生一定的CO2,但一方面消耗的CO 摩尔数多于生成的CO2摩尔数,且C.autoethanogenum 可以继续利用CO2(在一定还原力存在下),另一方面CO2较易溶于水,所以最终气袋里的气体基本能耗尽.

图3 气袋变化图Fig.3 Variation of gas sampling bag
表1 为C.autoethanogenum 的气袋生长-发酵结果.发酵培养基中的酵母膏质量浓度分别为0.8和1.0 g/L,整个生长-发酵过程进行了两次CO 充气操作,每一阶段耗时20 d 左右,最后检测气袋中的余气只有CO2,没有CO.从表1可以看出:在第1阶段,消耗的CO 主要用于菌体生长,菌体质量浓度得到较大增长,产物以乙酸为主,醇酸摩尔比较低,CO 乙醇转化率也较低(小于16%);在第2 阶段,消耗的CO 有一部分仍用于菌体生长,表现为菌体质量浓度继续增加,但是更多的CO 用于合成代谢物乙醇,乙酸质量浓度相比第1 阶段有所降低,乙醇质量浓度则显著提高;在1.0 g/L 酵母膏的发酵培养基中,乙醇质量浓度达到3.464 g/L,CO 乙醇转化率达51.7%.另外,0.8 和1.0 g/L 酵母膏质量浓度下得到的最终菌体质量浓度基本相同,但是后者的乙醇和乙酸质量浓度更高,尤其是乙酸.酵母膏作为培养基中的主要氮源供菌体生长利用,较高的浓度有利于生长,而乙酸是生长过程中的主要代谢物,因此表现为产乙酸较多.但第2 阶段的乙酸质量浓度均出现不同程度的降低,酵母膏质量浓度为0.8 g/L 时更为明显,乙酸质量浓度降至0.252 g/L,使得最终醇酸摩尔比达到15.76,比酵母膏质量浓度为1.0 g/L 时的结果高很多.Klasson 等[20]在研究C.ljungdahlii 时也发现降低酵母膏浓度可以提高产物中的醇酸摩尔比.由乙醇和乙酸的代谢途径得知,乙酸在乙醛氧化还原酶的催化下可转化为乙醛,进一步可继续转化为乙醇,因而可以认为,第2阶段乙醇质量浓度的增加伴随着乙酸质量浓度的降低,说明可能有部分乙酸转化为了乙醇.因此在一定范围内,较高的酵母膏浓度或许是有利的,虽然醇酸比有所降低,但可以获得更高的乙醇浓度,正如表1 的结果所示.关于这一点,笔者将在后续研究中展开更深入的探讨.

表1 C.autoethanogenum 的气袋生长-发酵结果Table 1 Results of growth and fermentation of C.autoethanogenum in gas sampling bag
2.4 C.autoethanogenum 对蔗渣水解液的利用
高温液态水法是针对木质纤维素类生物质的一种绿色预处理方法,它可将木质纤维素中的半纤维素水解为木糖及其低聚糖,而且经高温液态水处理后的纤维素原料更易于后续的酶解.该方法具有不添加化学试剂、发酵毒性副产物少等优点[22-23],缺点是水解液中得到的木糖浓度不高,如果用于木糖发酵过程需要先进行浓缩.水解过程中产生的副产物主要包括少量的糠醛、5-羟甲基糠醛、葡萄糖醛酸、乙醇酸、甲酸等,通常认为糠醛和5-羟甲基糠醛是发酵的主要抑制物,因此文中主要考察了这两种物质对C.autoethanogenum生长的影响.表2 为C.autoethanogenum 在不同水解液培养基中的生长情况及产物,水解液由不同条件的高温液态水处理蔗渣得到.从表2 可看出:虽然水解液中木糖的质量浓度较低,但仍可用于C.autoethanogenum 的生长;不过,随着5-羟甲基糠醛及糠醛质量浓度的升高,菌体质量浓度降低,说明这两种物质对菌株的生长有一定的抑制作用.经比较,N2环境下180 ℃、4 MPa处理20 min 得到的水解液较适合C.autoethanogenum 的培养,该条件正好也是蔗渣酶解预处理的一个较优条件.
以上述条件处理蔗渣,将得到的水解液与其他营养物质混合制备水解液培养基,接种C.autoethanogenum,在厌氧瓶中培养2 d 后直接将培养液转入已灌注CO 的1 L 气袋进行气袋发酵实验.发酵14 d后气袋体积大幅度减小,检测发现上层气相中的CO已耗尽,取样分析发酵液的OD600及产物质量浓度等,结果如表3 所示.从表3 可以看出,经过两天的培养,水解液培养基中的木糖已经用完,菌体质量浓度达142.1mg/L,产物中含少量乙醇.培养液接入气袋后,CO 成为唯一的碳源,用于生长与代谢,表现为菌体质量浓度继续增加,乙醇质量浓度达到3.13 g/L.由于仍有部分CO 用于菌体的生长,最终的CO 乙醇转化率为46.9%.与表1 的结果相比较,利用蔗渣水解液生长后再进行CO 发酵,得到的乙醇质量浓度及转化率可达到单纯CO 生长-发酵中两次发酵的水平,说明该工艺是可行的,而且具有如下优点:①发酵时间大大缩短,由原来的40 d 左右减少到16 d;②更多的CO 被用于乙醇转化;③将木质纤维素水解液中木糖的利用与CO 发酵有机结合了起来.
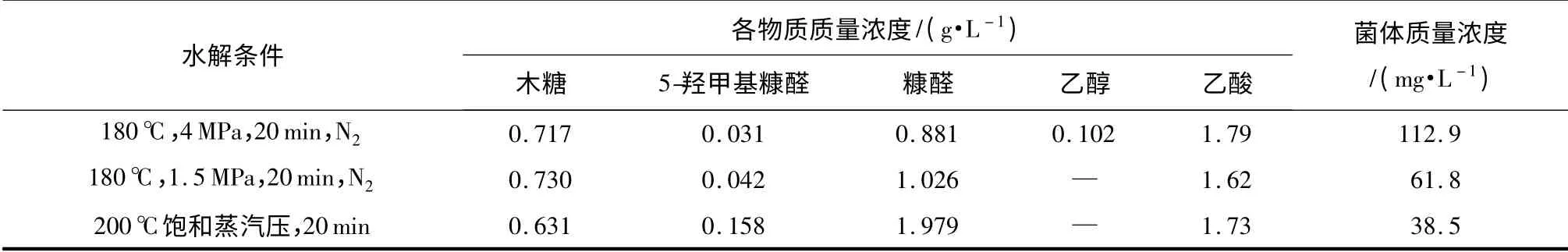
表2 C.autoethanogenum 在不同水解液培养基中的生长情况及产物Table 2 Growth and products of C.autoethanogenum in different hydrolysate media
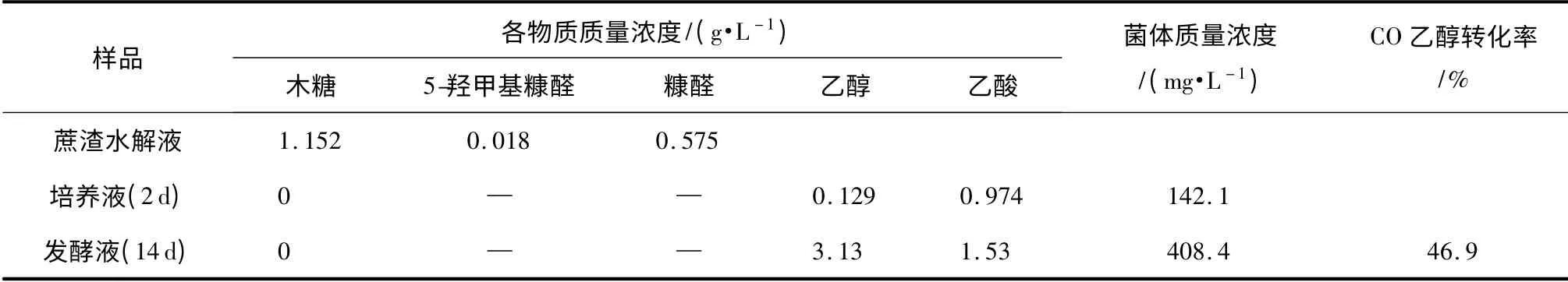
表3 C.autoethanogenum 在蔗渣水解液中的生长情况及CO 发酵结果Table 3 Growth and CO fermentation results of C.autoethanogenum in bagasse hydrolysate medium
3 结论
通过考察C.autoethanogenum 对木质纤维素水解液的利用以及它的生长与CO 发酵性能,得到以下结论:
(1)木糖是C.autoethanogenum 生长的适宜碳源,但不适于乙醇合成,代谢产物以乙酸为主.C.autoethanogenum 在改良培养基中生长良好,菌体质量浓度较之前的研究结果提高两倍以上.
(2)由于具有弹性体积及良好的气密性能,气袋非常适合用于气体发酵的研究.C.autoethanogenum 能够以100% CO 为唯一碳源进行生长并合成乙醇,虽然生长速度比以木糖为碳源时慢,但是产物中的乙醇质量浓度大大提高,在1 L 气袋中经过两次CO 发酵,乙醇质量浓度达3.464 g/L,CO 乙醇转化率达51.7%.
(3)N2环境、180 ℃、4 MPa 下,20 min 高温液态水处理蔗渣得到的水解液可用于C.autoethanogenum 的培养,再偶联CO 发酵,该工艺的发酵结果可达到单纯CO 生长-发酵时两次发酵的水平,而且发酵时间大大缩短,CO 转化为乙醇的效率提高.
[1]Vega J L,Klasson K T,Kimmel D E,et al.Sulfur gas tolerance and toxicity of CO utilizing and methanogenic bacteria[J].Applied Biochemistry and Biotechnology,1990,24/25(1):329-340.
[2]Ahmed A,Cateni B G,Huhnke R L,et al.Effects of biomass generated producer gas constituents on cell growth,product distribution and hydrogenase activity of Clostridium carboxidivorans P7T[J].Biomass and Bioenergy,2006,30(7):665-672.
[3]Tanner R S,Miller L M,Yang D.Clostridium ljungdahlii sp nov,an acetogenic species in clostridial rRNA homology group Ⅰ[J].International Journal of Systematic Bacteriology,1993,43(2):232-236.
[4]Barik S,Prieto S,Harrison S B,et al.Biological production of alcohols from coal through indirect liquefaction[J].Applied Biochemistry and Biotechnology,1988,18(1):363-378.
[5]Phillips J,Clausen E,Gaddy J.Synthesis gas as substrate for the biological production of fuels and chemicals[J].Applied Biochemistry and Biotechnology,1994,45/46(1):145-157.
[6]Klasson K T,Elmore B B,Vega J L,et al.Biological production of liquid and gaseous fuels from synthesis gas[J].Applied Biochemistry and Biotechnology,1990,24/25(1):857-873.
[7]Younesi H,Najafpour G,Mohamed A R.Ethanol and acetate production from synthesis gas via fermentation processes using anaerobic bacterium,Clostridium ljungdahlii[J].Biochemical Engineering Journal,2005,27(2):110-119.
[8]Liou J S-C,Balkwill D L,Drake G R,et al.Clostridium carboxidivorans sp nov,a solvent-producing clostridium isolated from an agricultural settling lagoon,and reclassification of the acetogen Clostridium scatologenes strain SL1 as Clostridium drakei sp nov[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(5):2085-2091.
[9]Ahmed A,Lewis R S,Fermentation of biomass-generated synthesis gas:effects of nitric oxide [J].Biotechnology and Bioengineering,2007,97(5):1080-1086.
[10]Abrini J,Naveau H,Nyns E.Clostridium autoethanogenum sp nov,an anaerobic bacterium that produces ethanol from carbon monoxide[J].Archives of Microbiology,1994,161(4):345-351.
[11]Saxena J,Tanner R S.Effect of trace metals on ethanol production from synthesis gas by the ethanologenic acetogen,Clostridium ragsdalei [J].Journal of Industrial Microbiology and Biotechnology,2011,38(4):513-521.
[12]Kundiyana D K,Wilkins M R,Maddipati P,et al.Effect of temperature,pH and buffer presence on ethanol production from synthesis gas by“Clostridium ragsdalei”[J].Bioresource Technology,2011,102(10):5794-5799.
[13]Allen T D,Caldwell M E,Lawson P A,et al.Alkalibaculum bacchi gen nov,sp nov,a novel CO oxidizing,ethanol producing acetogen isolated from livestock-impacted soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(10):2483-2489.
[14]Klasson K T,Ackerson M D,Clausen E C,et al.Biological conversion of coal and coal-derived synthesis gas[J].Fuel,1993,72(12):1673-1678.
[15]Datar R P,Shenkman R M,Cateni B G,et al.Fermentation of biomass-generated producer gas to ethanol [J].Biotechnology and Bioengineering,2004,86(5):587-594.
[16]Liu K,Atiyeh H K,Stevenson B S,et al.Continuous syngas fermentation for the production of ethanol,n-propanol and n-butanol[J].Bioresource Technology,2014,151:69-77.
[17]Guo Y,Xu J,Zhang Y,et al.Medium optimization for ethanol production with Clostridium autoethanogenum with carbon monoxide as sole carbon source[J].Bioresource Technology,2010,101(22):8784-8789.
[18]Cotter J L,Chinn M S,Grunden A M.Influence of process parameters on growth of Clostridium ljungdahlii and Clostridium autoethanogenum on synthesis gas [J].Enzyme and Microbial Technology,2009,44(5):281-288.
[19]Rajagopalan S,Datar R P,Lewis R S.Formation of ethanol from carbon monoxide via a new microbial catalyst[J].Biomass and Bioenergy,2002,23(6):487-493.
[20]Klasson K T,Ackerson M D,Clausen E C,et al.Bioconversion of synthesis gas into liquid or gaseous fuels[J].Enzyme Microbial Technology,1992,14(8):602-608.
[21]郭颖,许敬亮,徐惠娟,等.合成气和培养基组分对C autoethanogenum 发酵产乙醇的影响研究[J].太阳能学报,2011,32(9):1370-1374.Guo Ying,Xu Jingliang,Xu Huijuan,et al.Study on composition effects of syngas and medium on ethanol production with Clostridium autoethanogenum[J].Acta Energiae Solaris Sinica,2011,32(9):1370-1374.
[22]余强,庄新姝,袁振宏,等.高温液态水中甜高粱渣半纤维素水解及其机理[J].化工学报,2012,63(2):599-605.Yu Qiang,Zhuang Xinshu,Yuan Zhenhong,et al.Hydrolysis of sweet sorghum bagasse hemicellulose with liquid hot water and its mechanism[J].CIESC Journal,2012,63(2):599-605.
[23]Yu Y,Lou X,Wu H.Some recent advances in hydrolysis of biomass in hot-compressed water and its comparisons with other hydrolysis methods [J].Energy & Fuels,2008,22(1):46-60.

