联合应用氯喹增加人胶质瘤细胞U343细胞对Bcl-2抑制剂ABT737的敏感性
赵金川 ,赵 燕 ,侯 坤 ,张 扬 ,牟 荣 ,柳敬伟*
(1.吉林大学第一医院二部 神经外科, 吉林 长春130031;2.吉林省人民医院 神经内科,吉林 长春130021;3.吉林金域医学检验所有限公司)
Bcl-2抑制剂是一种新型的很有应用前景的抗肿瘤药物,它通过抑制促存活Bcl-2家族蛋白的表达诱导肿瘤细胞凋亡。近年来,ABT-737、ABT-263、棉酚、apogossypol、TW-37、obatoclax、HA14-1等Bcl-2小分子抑制剂已成为研究的热点,临床前试验表明该类药物单药对某些肿瘤有效,与放化疗联合使用具有明显的协同效果[1]。 Bcl-2抑制剂可模拟仅有BH3结构域蛋白的功能,其中ABT-737已进入二期临床阶段,它在体外表现出与Bcl-xL、Bcl-2 和Bcl-w 有较高亲和力[2],而对Bcl-B、Bfl-1、Mcl-1亲和力较低[3]。ABT-737表现出较强的单药活性,尤其是对白血病,淋巴瘤,小细胞肺癌,但是也经常出现耐药[4-5]。研究发现,Mcl-1在早期不能被靶向,因而导致ABT-737耐药,但是ABT-737与其它的抗肿瘤药物联用可以增加肿瘤细胞死亡[6]。
目前,累积的证据表明氯喹可提高癌症细胞对放疗和化疗药物的敏感性,氯喹传统上用于治疗或预防疟疾,机制是通过碱化溶酶体酸性环境,抑制其蛋白酶活性[7]。氯喹也可通过其免疫抑制特性用于自身免疫性疾病,但是其抗肿瘤机制尚不清楚[8,9]。因此,本研究拟考察ABT-737和氯喹两种不同机制的抗肿瘤药物联用对人胶质瘤细胞U343细胞杀伤效应,以及二者应用是否具有协同作用。
1 材料与方法
1.1 主要试剂与仪器
氯喹(Chloroquine,CQ),Bcl-2抑制剂ABT737,四甲基偶氮唑蓝(MTT)均购自美国Sigma公司,RPMI 1640,胎牛血清购自美国Gibco公司。
1.2 细胞株与细胞培养
人胶质瘤细胞U343细胞购自中国科学院上海生物化学与细胞生物学研究所,培养于含 10%胎牛血清、100 U/ml青霉素和40 U/ml庆大霉素的RPMI1640培养基中,当细胞生长至对数生长期时进行实验。
1.3 MTT法检测细胞活性
将U343细胞以5×103/ml密度接种于96孔板(每孔加200 μl),培养至对数生长期(24 h),加入不同浓度药物处理24 h后,小心吸去上清,加入90 μl新鲜培养液,再加入10 μl MTT溶液,继续培养4小时,弃上清,每孔加入100 μl二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶标仪于490 nm波长处测定吸光度(A)值。按下式计算细胞存活率,细胞存活率 (%) = [A实验孔-A空白孔/(A对照孔-A空白孔)]×100%,实验重复 3次。
1.4 western检测蛋白表达
U343细胞经药物处理24 h后,加入细胞裂解液RIPA裂解,进行SDS-PAGE电泳。分离胶浓度12%,浓缩胶浓度5%,电转至PVDF膜上,5%脱脂奶粉封闭2 h,Cleaved PARP、Cleaved Caspase-3、细胞色素C(cytochrome c)抗体(Cell Signaling公司,1∶800)4℃孵育过夜,TBST洗3次膜,每次15 min,辣根过氧化物酶标记的羊抗鼠二抗(Cell Signaling公司1∶5000)室温孵育2 h,TBST洗3次膜,每次15 min,ECL显影。
1.5 统计学方法
采用 SPSS16.0软件进行统计学分析。数据以M±SD表示 ,均数差别显著性检验采用单因素方差分析,多组均数间比较采用最小显著差数(LSD)法检验,P<0.05有统计学意义。
2 结果
2.1 ABT737对U343细胞生存率的影响
U343细胞经过10 μM、20 μM、30 μM ABT737处理24 h后,细胞生存率均显著下降,并呈浓度依赖性(如图1)。结果表明,ABT737具有降低U343细胞生存率的作用。
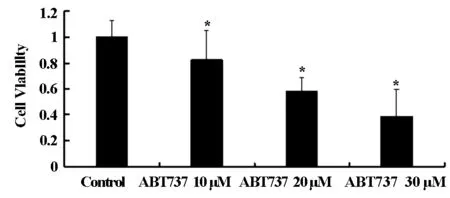
* 代表与对照组相比较有统计学差异
2.2 ABT737对U343细胞凋亡通路相关蛋白表达水平的影响
western blot检测U343细胞凋亡通路执行蛋白caspase-3及其底物PARP,结果如图2A和2B所示,与对照组相比Cleaved caspase-3和Cleaved PARP呈剂量依赖性的表达增加。另外,如图2C所示cytochrome-c的表达量明显增加,与空白对照相比较差异具有显著性。以上结果表明ABT737可以激活凋亡通路,诱导U343细胞发生凋亡。
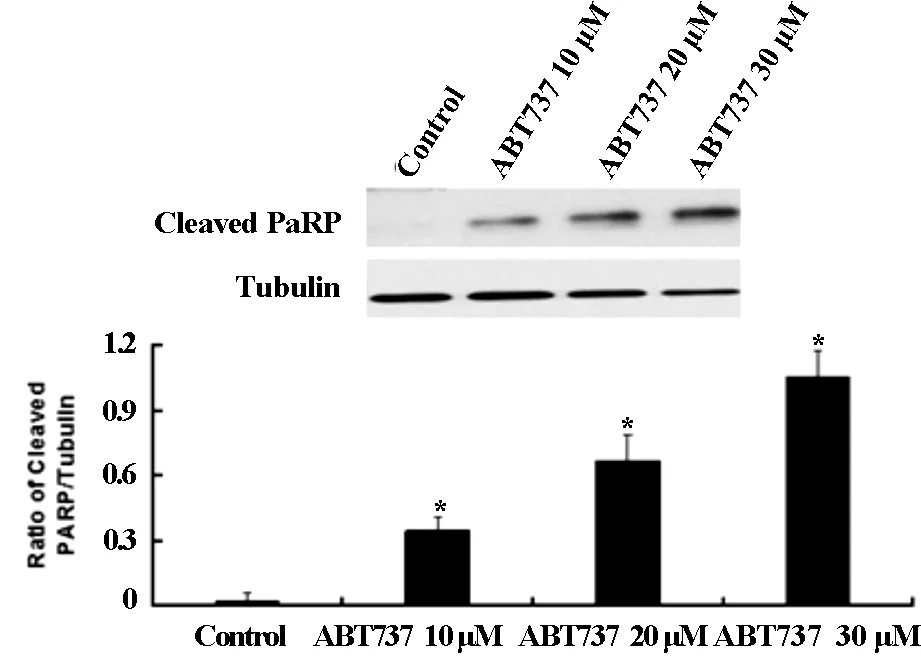
* 代表与对照组相比较有统计学差异

* 代表与对照组相比较有统计学差异

* 代表与对照组相比较有统计学差异
2.3 ABT737联合应用氯喹对U343细胞生存率的影响
为考察联用氯喹对ABT737诱导凋亡的协同作用,首先应用MTT法确定了氯喹对U343细胞的安全剂量,如图3A所示,在20 μM剂量范围内,氯喹对细胞活性无显著影响。然而,当10 μM氯喹与20 μM ABT737共同作用24 h后,MTT结果如3B显示,与对照组相比,二者单用均明显降低U343细胞活性。二者联用与单用ABT737组相比,细胞活性显著降低。结果提示,氯喹和ABT737联合应用具有协同作用,可更进一步降低细胞生存率。
2.4 ABT737联合应用氯喹对U343细胞凋亡通路相关蛋白表达水平的影响
western blot检测结果如图4A和4B所示,氯喹组与对照组相比,Cleaved caspase-3和Cleaved PARP表达水平没有明显改变。而氯喹与ABT737联用组与单用ABT737组比较,Cleaved caspase-3和Cleaved PARP表达水平明显增加。同样,氯喹组的cytochrome-c表达水平与对照组相比无明显改变,而氯喹与ABT737联用组与单用ABT737组比较,cytochrome-c表达水平显著增加(见图4C)。结果表明,联合应用氯喹可以明显增加ABT737引起的人胶质瘤细胞U343细胞凋亡。
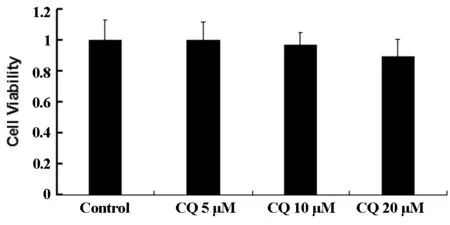
图3A 不同浓度氯喹对U343细胞生存率的影响
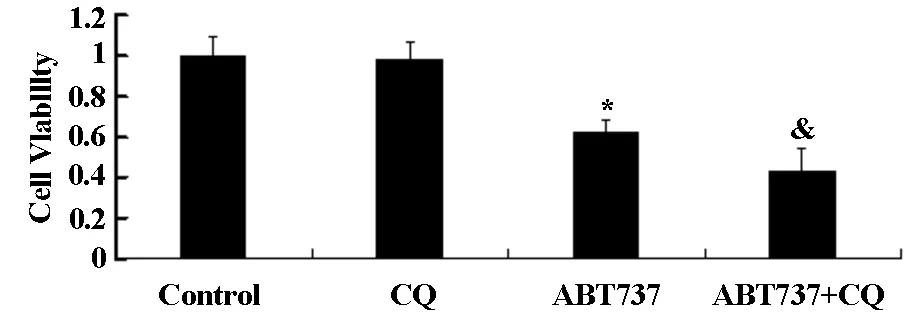
*与对照组相比有统计学差异,&与ABT737组相比有统计学差异
图3BABT737联合应用氯喹对U343细胞生存率的影响
3 讨论
对于恶性肿瘤细胞,细胞凋亡可以快速使细胞数量损失,而且可以导致肿瘤生长缓慢[10]。目前,诸多抗癌药物的研发围绕诱导癌细胞凋亡,当“凋亡程序”受到破坏后,治疗的敏感性降低[11]。而且研究发现,恶性神经胶质瘤的主要特点是对经典的caspase依赖的凋亡途径产生抵抗[12,13]。之前的研究发现ABT737可以诱导癌症细胞凋亡[14],在本研究中,我们同样发现ABT737可以引起人胶质瘤细胞U343细胞发生线粒体通路介导的凋亡。
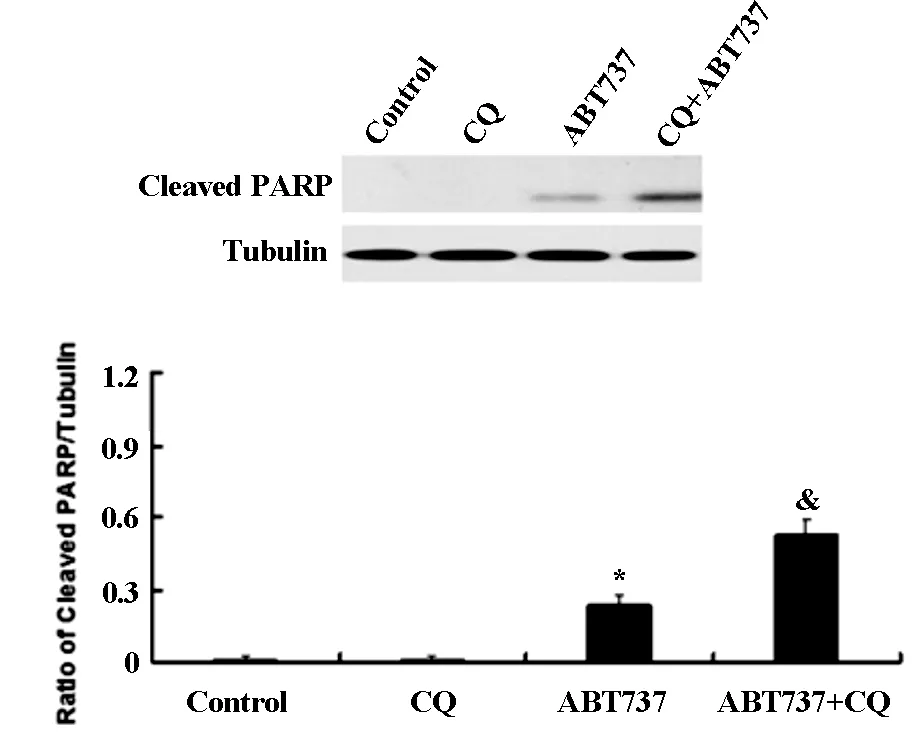
*与对照组相比有统计学差异,&与ABT737组相比有统计学差异
图4AABT737联合应用氯喹对U343细胞CleavedPARP的影响
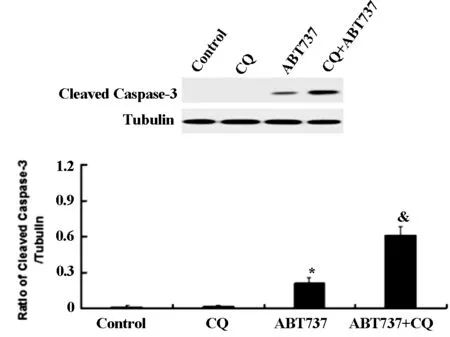
图4B ABT737联合应用氯喹对U343细胞Cleaved caspase-3的影响

*与对照组相比有统计学差异,&与ABT737组相比有统计学差异
氯喹具有增加抗癌药物敏感性的作用[15],而且,正在进行的临床试验也提示氯喹可能会对现行的癌症治疗策略产生深远的影响[16],本研究中我们发现联合应用氯喹可以明显增加ABT737引起的人胶质瘤细胞U343细胞凋亡。但是,氯喹的毒性不容忽视。所以,本实验中通过MTT法选用了对癌细胞不产生显著影响的剂量作为安全剂量,在此剂量下,氯喹表现出明显的药物协同作用。
综上所述,小分子Bcl-2抑制剂ABT737联合小剂量氯喹通过诱导人胶质瘤细胞U343细胞凋亡显著提高ABT737的化疗敏感性,这为临床治疗癌症及其他肿瘤提供了一种新的思路和方法,而氯喹发挥这种作用的具体分子机制还需要进一步研究。
参考文献:
[1]张淑兰,姚鹏,宫 平.Bcl-2蛋白小分子抑制剂的研究进展[J].沈阳药科大学学报,2008(11):919.
[2] Tilman Oltersdorf,Steven W Elmore,Alexander R Shoemaker,et al.An Inhibitor of Bcl-2 Family Proteins Induces Regression of Solid Tumours[J].Nature,2005,435(7042):677.
[3] RW Rooswinkel,B Van de kooij,M Verheij,et al.Bcl-2 Is a Better Abt-737 Target Than Bcl-xl Or Bcl-w and Only Noxa Overcomes Resistance Mediated By Mcl-1,Bfl-1,Or Bcl-b[J].Cell Death & Disease,2012,3(8):0.
[4] Marina Konopleva,Rooha Contractor,Twee Tsao,et al.Mechanisms of Apoptosis Sensitivity and Resistance to the Bh3 Mimetic Abt-737 in Acute Myeloid Leukemia[J].Cancer Cell,2006,10(5):375.
[5] Derek Yecies,Nicole E Carlson,Jing Deng,et al.Acquired Resistance to Abt-737 in Lymphoma Cells That Up-regulate Mcl-1 and Bfl-1[J].Blood,2010,115(16):3304.
[6] Mark S Cragg,Claire Harris,Andreas Strasser,et al.Unleashing the Power of Inhibitors of Oncogenic Kinases Through Bh3 Mimetics[J].Nature Reviews Cancer,2009,9(5):321.
[7] 李晓升.评述氯喹的作用机制假说[J].中国人兽共患病杂志,1999,15(4):101.
[8] CA Homewood,DC Warhurst,W Peters,et al.Lysosomes,Ph and the Anti-malarial Action of Chloroquine[J].Nature,1972,235(7):50.
[9] Andrew FG Slater.Chloroquine:Mechanism of Drug Action and Resistance In< I> Plasmodium Falciparum [J].Pharmacology & Therapeutics,1993,57(2):203.
[10]John FR Kerr,Clay M Winterford,Brian V Harmon.Apoptosis.Its Significance in Cancer and Cancer Therapy[J].Cancer,1994,73(8):2013.
[11] Clemens A Schmitt,Scott W Lowe.Apoptosis and Therapy[J].The Journal of Pathology,1999,187(1):127.
[12] Oliver B?gler,Michael Weller.Apoptosis in Gliomas,and Its Role in Their Current and Future Treatment.[J].Frontiers in Bioscience:a Journal and Virtual Library,2002,7(3):1.
[13] Joachim P Steinbach,Michael Weller.Apoptosis in Gliomas:Molecular Mechanisms and Therapeutic Implications[J].Journal of Neuro-oncology,2004,70(2):245.
[14] Hayato Takeuchi,Yasuko Kondo,Keishi Fujiwara,et al.Synergistic Augmentation of Rapamycin-induced Autophagy in Malignant Glioma Cells By Phosphatidylinositol 3-kinase/protein Kinase B Inhibitors[J].Cancer Research,2005,65(8):3336.
[15] Tomonori Kimura,Yoshitsugu Takabatake,Atsushi Takahashi,et al.Chloroquine in Cancer Therapy:a Double-edged Sword of Autophagy[J].Cancer Research,2013,73(1):3.
[16] Ravi K Amaravadi,Jennifer Lippincott-schwartz,Xiao-Ming Yin,et al.Principles and Current Strategies for Targeting Autophagy for Cancer Treatment[J].Clinical Cancer Research,2011,17(4):654.

