慢病毒介导shRNA沉默人纤维介素基因对心肌微血管内皮细胞增殖、迁移的影响
王 亮 吴友平 郑振中 殷 然 王梦洪 郑泽琪 彭景添 魏云锋
(南昌大学第一附属医院心血管内科,江西 南昌 330006)
人纤维介素(fgl2)属于纤维蛋白家族中的一员,是一种Ⅱ型跨膜糖蛋白,可分为胞质、跨膜和胞外结构域3部分。fgl2由活化的巨噬细胞、血管内皮细胞表达,国内外有关fgl2的研究主要集中在肝病方面的研究,提示其可能参与血管新生等病理生理过程,但目前缺乏关于fgl2对MMVECs增殖、迁移等血管形成的关键环节的直接证据〔1~3〕。本研究通过制作并包装fgl2的RNA干扰慢病毒,转染心肌微血管内皮细胞(MMVECs),观察fgl2沉默对MMVECs增殖、迁移的影响。
1 材料与方法
1.1材料与试剂 HEK293T细胞购自中科院上海细胞所;制备编码慢病毒颗粒的重组病毒质粒及辅助包装原件载体质粒购自上海吉凯基因化学公司;Lipofectamine2000、Trizol试剂盒购自Invitrogen公司;逆转录RNA试剂盒购自Promega公司;RNase-free购自Axygen公司;小鼠抗人Flag抗体购自美国Sigma公司,山羊抗小鼠IgG 抗体、小鼠抗人GAPDH 抗体购自美国Santa Cruz公司。
1.2shRNA慢病毒重组载体构建及病毒包装 从GenBank中查找大鼠fgl2基因,按RNA干扰序列设计原则,设计4组针对fgl2基因cds区的靶序列,同时按公认标准设计合成无意义序列作阴性对照(PSCNC)。每组序列均按发卡结构模式设计合成,在其两端设计酶切位点黏端,直接联入酶切后的载体。DNA片段均由上海吉凯基因公司合成。设计合成的寡核苷酸片段稀释后在退火反应体系中形成双链DNA片段,经T4 DNA连接酶插入到经AgeⅠ和EcoRⅠ双酶切后的线性质粒pGCSIL-GFP中。回收载体片段,与双链DNA片段行连接反应,转化大肠杆菌感受态细胞DH5α,摇菌后接种到LB琼脂培养基,筛选阳性克隆行PCR及测序鉴定。每组产物中随机选5个菌落克隆溶于10 μl LB中,取1 μl为PCR模板;阴性对照为dd H2O;阳性对照为含针对GAPDH siRNA插入片段的载体质粒。fgl2上游:5′- CCTATTTCCCATGATTCCTTCATA -3′;下游:5′- GTAATACGGTTATCCACGCG -3′。PCR反应条件:94℃预变性30 s;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环,72℃延伸6 min,4℃保存。
Western印迹检测外源筛选有效靶点的干扰效果,确认有效靶点并进行病毒包装。将含慢病毒包装系统质粒的DNA溶液(pGC-LV载体20 μg,pHelper1.0载体15 μg,pHelper2.0载体10μg),与Opti-MEM等体积混匀,调总体积为2.5 ml,与脂质体2000混匀,室温孵育20 min,转到含293T细胞的培养基中培养。收集转染48 h后的细胞上清液,4℃,4 000 r/min离心10 min,过滤上清,离心,弃上清,加PBS 50~100 μl,-80℃保存。96孔板接种293T细胞,调至每孔4×104个细胞,培养过夜。根据待测滴度,每个Ep管加90 μl无血清培养基。取待测病毒原液10 μl至第1管中混匀,继续相同的操作至最后1管。选所需的孔弃培养基,加等量稀释的病毒液,培养4 d后观察荧光表达情况,将最后两个含荧光细胞的孔中荧光细胞的个数乘以稀释倍数即病毒原液的滴度值。系列稀释法测定病毒滴度为1×109TU/ml。
1.3MMVECs培养与鉴定 取7 d大鼠乳鼠心脏剪去主动脉、左右心房、右心室,保留左心室,用PBS洗净血液。小心剥离心外膜及心内膜。用75%乙醇灭活30 s,用PBS冲洗干净,剪碎,加入适量的0.08%胰蛋白酶,37℃水浴消化3次。适量0.1% Ⅱ型胶原酶(用不含血清DMEM稀释)消化组织,置于孵箱中消化3 h。转移至超净台中,加含血清的培养基终止消化。1 000 r/min离心5 min,弃上清,重悬沉淀。反复离心3次。离心所得的细胞用200目筛网过滤,过滤后所得细胞悬于20%胎牛血清DMEM培养基,接种于0.2%明胶预处理的培养瓶中37℃培养。每隔2 d换液1次,直至长成细胞单层,0.125%胰蛋白酶消化传代,选第3代传代内皮细胞。0.125%胰蛋白酶消化贴壁细胞,传代至爬片上,孵箱过夜,待细胞贴壁长满后,取出爬片,固定后采用免疫荧光方法检测MMVECs特异性标志CD31-RA、Ⅷ-RA。
单纯MMVECs组(对照组)、携带GFP空载质慢病毒转染MMVECs(GFP组)、Fgl2shRNA慢病毒转染MMVECs(fgl2-RNAi-LV组)。培养96 h后分别收集MMVECs。取第3代MMVECs用于转染,转染前1 d将MMVECs以适当密度接种于6孔细胞培养板内。24 h待细胞密度达60%~70%时即可用于转染。转染前2 h将细胞培养基更换为无血清培养基,慢病毒转染6~8 h后,更换20%胎牛血清培养基。24~72 h后荧光显微镜下观察GFP表达。
1.4细胞总RNA提取及鉴定 转染96 h后,去除6孔板中的培养基,按1.0 ml/1.0×106细胞加入的Trizol试剂,轻轻晃动,使其充分裂解。移入1.5 ml去RNA酶的EP管中,室温(15℃~30℃)静置5 min。严格按照Trizol试剂说明书进行,加入0.2 ml氯仿,盖紧盖子剧烈震荡EP管15 s,室温静置3 min。4℃,8 000 r/min,离心15 min,可见混合物分层。将上层水相约350 μl转移入另一新的去RNA酶EP管中,加入0.5 ml异丙醇,混匀后室温静置10 min。4℃,8 000 r/min,离心10 min,管底可见白色的RNA沉淀。弃上清,加入75%乙醇1.0 ml,混匀后,4℃,5 000 r/min,离心5 min。弃上清,空气中干燥RNA沉淀,加入20 ml DEPC水溶解。样本RNA取少许稀释100倍后,以核酸蛋白分析仪测定OD260、OD280及OD260/OD280值,计算RNA的纯度和浓度,-70℃保存以备用。
1.5qRT-PCR测定各组MMVECs中fgl2 mRNA的表达 引物的设计根据 GenBank 库中相应 cDNA 序列进行。每个样品重复3次,用ABI7500检测分析。以作β-actin内参,用2-△△Ct计算结果。引物序列及反应条件见表1。

表1 引物序列及反应条件
1.6MTT检测内皮细胞增殖能力 用含10%胎牛血清得培养液配成单个细胞悬液,以每孔104个细接种细胞接种到 96 孔板,每孔体积 200 μl(每组设8个孔,2个对照孔)按照一般内皮细胞培养条件,培养4 d。培养4 d后,每孔加 MTT 溶液(5 mg/ml用 PBS 配制,pH=7.4)10 μl,继续孵育 4 h,呈色,终止培养,小心吸弃孔内培养上清液,每孔加 100 μl DMSO,振荡10 min,使结晶物充分融解,选择 490 nm波长,在酶联免疫监测仪上测定各孔光吸收值,记录结果,以时间为比色横坐标,吸光值为纵坐标绘制细胞生长曲线。
1.7Transwell检测细胞迁移能力 将小室放入培养板中,在上室加入300 μl预温的无血清培养基,室温下静置15~30 min,使基质胶再水化。再吸去剩余培养液。消化细胞,终止消化后离心弃去培养液,用PBS洗1~2遍,用含BSA的无血清培养基重悬。调整细胞密度至5×105,取细胞悬液200 μl加入Transwell小室。24孔板下室加入500 μl含20%FBS的培养基。将细胞放入细胞培养箱继续培养12 h。细胞计数统计:用棉签上室内的细胞,用0.1%结晶紫染色,在显微镜下,取5个视野计数细胞个数。
2 结 果
2.1qRT-PCR检测fgl2shRNA慢病毒转染MMVECs后fgl2的表达变化 与对照组(为参照)与GFP组比较,fgl2-RNAi-LV组的fgl2表达明显下调(0.198±0.02,P<0.05),而对照组与GFP组(0.984±0.08)无明显差异,提示慢病毒转染MMVECs后fgl2的表达明显下降。
2.2Transwell检测细胞迁移能力 与对照组(7.8±1.24)与GFP组(7.4±1.56)比较,fgl2-RNAi-LV组的迁移能力增强(16.2±2.44,P<0.05),而对照组与GFP组无明显差异(P>0.05)。见图1。
2.3MTT检测内皮细胞增殖能力 与对照组与FGP组比较,fgl2-RNAi-LV组的MMVECs的增殖能力与迁移能力增强(P<0.05),而对照组与GFP组无明显差异(P>0.05)。见图2。
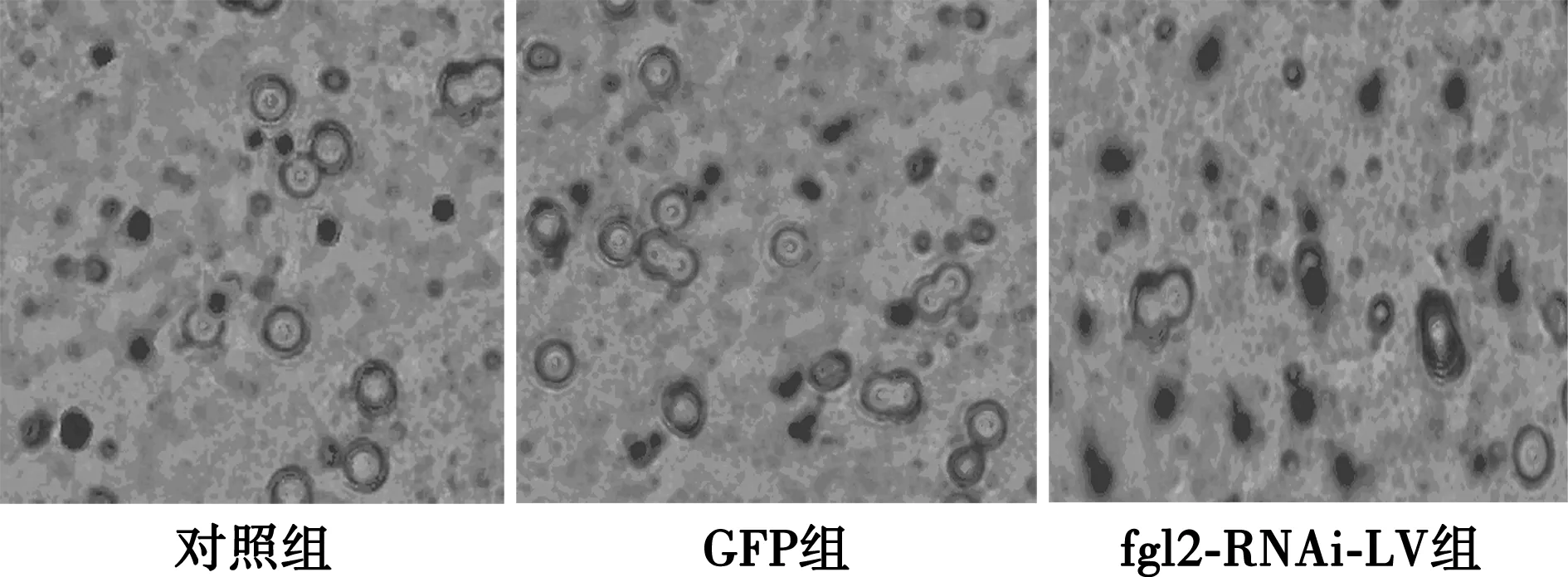
图1 Transwell检测各组细胞迁移能力(×400)

图2 MTT检测MMVECs增殖
3 讨 论
慢病毒载体是近年来发展起来的一种新型载体,其感染效率高、细胞免疫反应小,而且能通过基因整合稳定持续地产生小干扰RNA(siRNA)而发挥沉默效应〔4〕。RNAi是一种能够高效、特异地下调目标基因表达,并在基因功能学研究和基因治疗领域有着广阔应用前景的技术〔5~7〕。本研究合成的pGCSIL-fgl2shRNA 慢病毒表达载体具有高效的感染效率、确切的干涉效果及持续稳定的表达优势,将fgl2-shRNA慢病毒转染MMVECs,收集细胞,经实时定量PCR检测,fgl2明显下调,说明fgl2-shRNA载体构建成功。
在血管生成过程中,血管内皮细胞增殖和迁移是血管发生的最基本和最重要的环节〔8〕。MMVECs是缺血心肌血管新生的重要因素。大血管内皮与微血管内皮细胞在生物活性〔9〕,对各种物质反应性等方面均存在着明显的不同〔10〕,并且微血管内皮细胞具有显著的组织器官异质性〔11〕,即与细胞所来源的器官功能密切相关。利用大血管内皮细胞研究的结果很难客观、准确地解释微血管内皮细胞。所以要准确地反映所研究的组织
或器官的功能机制,最好选择组织或器官的微血管内皮细胞作为研究对象〔12〕。本研究结果发现fgl2基因沉默能够促进MMVECs的增殖和迁移,提示fgl2参与微血管内皮细胞血管新生的调控,但是其机制并不清楚。
总之,本研究明确了fgl2参与调控心肌微血管内皮细胞增殖、迁移等血管新生关键环节,为进一步研究fgl2在血管新生调控奠定基础。
4 参考文献
1Su K,Chen F,Yan WM,etal.Fibrinogen-like protein 2/fibroleukin prothrombinase contributes to tumor hypercoagulability via IL-2 and IFN-gamma〔J〕.World J Gastroenterol,2008;14(39):5980-9.
2Maisonpierre PC,Suri C,Jones PF,etal.Angiopoietin-2,a nature ancagonist for Tie2 that disrupts in vivo〔J〕.Angiogeneste Sci,1997;277(5292):55-60.
3Loughna S,Sato TN.Angiopoietin and TIE signaling pathway in vascular development〔J〕.Matrix Biol,2001;20(5-6):295-319.
4Yin Y,Huang L,Zhao X,etal.AMD3100 mobilizes endothelial progenitor cells in mice,but inhibits its biological functions by blocking an autocrine/ paracrine regulatory loop of stromal cell derived factor-1 in vitro〔J〕.J Cardiovasc Pharmacol,2007;50(1):61-7.
5Hamik A,Lin Z,Kumar A,etal.Kruppel-like factor 4 regulates endothelial inflammation〔J〕.J Biol Chem,2007;282(18):13769-79.
6Alder JK,Robert W,Richard L,etal.Kruppel-like factor 4 is essential for inflammatory monocyte differentiation in vivo〔J〕.J Immunol,2008;180(8):5645-52.
7Okita K,Nakagawa M,Hyenjong H,etal.Generation of mouse induced pluripotent stem cells without viral vectors〔J〕.Science,2008;322(5903):949-53.
8Hamada K,Sasaki T,Koni PA,etal.The PTEN /PI3K pathway governs normal vascular development and tumor angiogenesis〔J〕.Genes Dev,2005;19(17):2054-65.
9Cohen G,Riahi Y,Alpert E,etal.The roles of hyperglycaemia and oxidative stress in the rise and collapse of the natural protective mechanism against vascular endothelial cell dysfunction in diabetes〔J〕.Arch Physiol Biochem,2007;113(4-5):259-67.
10Picano E,Michelassi C.Chronic oral dipyridamole as a ′novel′ antianginal drug:the collateral hypothesis〔J〕.Cardiovasc Res,1997;33(3):666-70.
11Murohara T,Asahara T,Silver M,etal.Nitric oxide synthase modulates angiogenesis in response to tissue ischemia〔J〕.J Clin Invest,1998;101(11):2567-78.
12Fabre JE,Rivard A,Magner M,etal.Tissue inhibition of angiotensin-converting enzyme activity stimulates angiogenesis in vivo〔J〕. Circulation,1999;99(23):3043-9.

