TLR4对人乳腺癌细胞MCF-7放射敏感性的影响
王 宏 张海鹏 卢良杰 范志民
(吉林大学第一医院,吉林 长春 130021)
Toll样受体(TLRs)是一类重要的模式识别受体,TLRs最初被认为是固有免疫系统所特有,但很多学者发现,TLRs也表达于肿瘤细胞〔1,2〕。其中以TLR4的肿瘤表达最为广泛,且表达丰度较高,因而TLR4在肿瘤的发生、发展中作用备受关注〔3,4〕。肿瘤细胞TLR4的激活可以促进细胞的增殖和凋亡抵抗〔5〕。TLR4在乳腺癌中的表达及其对乳腺肿瘤生物学行为以及对肿瘤细胞放射敏感性的研究报道甚少。因此,本研究在以往研究肿瘤细胞辐射效应机制的基础上,进一步探讨TLR4对人乳腺癌细胞放射敏感性的影响。
1 材料与方法
1.1细胞株培养 人乳腺癌细胞株MCF-7购自上海细胞库,用RPMI1640培养基(内含10%的胎牛血清及青霉素与链霉素各100 U/ml)、37℃、5%CO2培养箱中培养。均用0.25%胰酶消化贴壁细胞并传代。
1.2主要试剂 RPMI1640培养基、标准胎牛血清购自美国Clone公司;内毒素脂多糖(LPS)购自美国Sigma公司;TAK242购自上海佰世凯化学科技有限公司;CCK-8试剂盒购自上海碧云天生物技术研究所;Annexin V-FITC/PI双染色法流式细胞检测试剂盒购自美国Invitrogen公司;抗小鼠TLR4抗体购自美国R&D公司;FITC标记兔抗山羊IgG购自北京中杉金桥生物技术有限公司。
1.3照射条件及实验分组〔6〕国产X.S.S.205(FZ)型固定式X射线深部治疗机(丹东市康嘉仪器设备有限公司),电压180 kV,电流18 mA,滤板0.5 mmCu+1.0 mmAl。单次照射剂量为5 Gy,源靶距60 cm,剂量率0.387 Gy/min。取对数生长期的肿瘤细胞分为3组:①空白对照组:只加入PBS;②激动组(LPS组):5 Gy照射前4 h单独加入LPS,终浓度为1 μg/ml ;③阻滞组(TAK242组):5 Gy照射前1 h单独加入TAK242,终浓度为1 μg/ml。
1.4CCK-8试剂盒检测肿瘤细胞增殖活性 取对数生长期细胞,常规消化制成单细胞悬液,调细胞浓度为4×104/ml,取100 μl加入96孔板中,细胞贴壁后按方法3进行实验分组,每组设3复孔,培养48 h后每孔加入CCK-8溶液10 μl,37℃、5%CO2培养箱中培养2 h后终止。按照试剂盒说明书用酶联免疫检测仪在450 nm处测定其吸光度(A)值,用于表示细胞相对增殖活性,增殖活性(%)=实验组A值/对照组A值×100%。
1.5流式细胞术(FCM)检测细胞凋亡 取对数生长期细胞,用胰蛋白酶消化细胞,以每孔106个细胞接种于6孔板中培养,细胞贴壁后按方法3进行实验分组,每组设4复孔,培养48 h后收集细胞,取5×105个细胞移入离心管,1500 r/min离心半径13 cm,离心5 min,悬于1×Buffer中后1 500 r/min离心半径13 cm,离心5 min,弃上清,每管依次加入5 μl Annexin V-FITC和10 μl PI,在室温下反应15 min,用流式细胞仪检测。Annexin V从FITC的绿色荧光通过FITC通道检测;PI红色荧光通过PI通道检测。
1.6流式细胞术(FCM)检测细胞周期 1×106个细胞经胰酶消化制成单细胞悬液后,冰冷PBS洗涤2次,1 500 r/min离心半径13 cm,离心5 min,弃上清,加入0.1 mg/ml的核糖核酸酶80 μl和5%碘化丙啶溶液150 μl,在4℃作用30 min,用流式细胞仪检测细胞周期变化,用CellQuest软件收取细胞(每份样品收取1×104个细胞),结果以百分率表示。
1.7克隆形成实验检测细胞辐射敏感性〔7〕将不同数量的细胞分别接种于6孔细胞培养板中,按方法3分组处理。给予不同干预处理后,继续培养10~14 d,集落形成后,弃培养液,PBS洗涤2次,加甲醇溶液固定15 min。弃固定液,加适量吉姆萨染色20 min,流水洗去染色液。倒置显微镜下计数各孔50个以上的集落数。按以下公式计算克隆形成率(PE,%)=(克隆数/接种细胞数)×100%,对照组克隆形成率设为100%,各组细胞存活分数=各组克隆形成率/对照组克隆形成率。
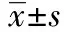
2 结 果
2.1TLR4对受照的MCF-7细胞增殖活性的影响 MCF-7受5 Gy照射后其增殖活性明显低于照射前(P<0.05),经TLR4阻断剂TAK242处理后,其增殖活性明显降低(P<0.05),而用TLR4激动剂LPS处理后,其增殖活性明显升高(P<0.05)。见表1。
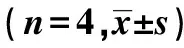
表1 TAK242和LPS对照射前后MCF-7细胞增殖活性的影响
2.2TLR4对受照的MFC-7细胞凋亡率的影响 用TAK242阻断TLR4后,辐射诱导MFC-7细胞凋亡率明显增多,而用LPS刺激后其凋亡率明显受抑制(P<0.05)。见表2。

表2 TAK242和LPS对照射前后MCF-7凋亡率的影响
2.3TLR4对受照的MCF-7细胞周期变化的影响 MCF-7细胞受照后G2/M期细胞显著多于对照组(P<0.01),G0/G1期细胞明显减少(P<0.01),S期细胞变化不明显(P>0.05)。见表3。

表3 TAK242和LPS对照射前后细胞周期的影响
2.4TLR4对受照的MCF-7细胞克隆形成的影响 MCF-7受5 Gy照射后其细胞存活数明显低于照射前(P<0.01),经TLR4阻断剂TAK242处理后,其细胞存活数明显降低(P<0.01),而用TLR4激动剂LPS处理后,其细胞存活数明显升高(P<0.01)。见表4。

表4 TAK242和LPS对照射前后MCF-7细胞放射敏感性的影响
3 讨 论
TLRs的分布十分广泛,可以直接识别结合某些病原体或其产物所共有的高度保守的特定分子结构,即病原相关分子模式,可以对不同病原相关分子模式进行识别、结合,并引发一系列信号转导,进而导致炎性介质的释放,在天然免疫防御中起着重要作用,并最终激活获得性免疫系统〔8〕。目前发现的TLRs 家族至少已包括了12 个成员,不同的TLRs 其配体也有所不同,其中TLR4 是介导内毒素/脂多糖应答的最主要受体。TLR4 几乎分布于所有的细胞系,主要表达在参与宿主防御功能的细胞上,TLR4 信号转导通路,与许多疾病的发生及发展过程相关,下游信号的级联式反应往往会使疾病朝不良的方向转归〔9〕,因此临床上研制各种阻断或抑制TLR4 信号通路上各个节点药物也是目前医学领域研究的热点。
乳腺癌是起源于乳腺腺上皮细胞的恶性肿瘤。目前已成为全球范围内严重影响女性身心健康及生活质量的首要恶性疾病之一,且威胁患者生命。亚洲范围内我国属于乳腺恶性肿瘤低发病国家,但不容乐观的是我国每年患病率同样以非常惊人的速度在增长,由于我国国土范围较大,区域差异性更为明显,沿海及京、津等大中型城市的乳腺癌患者数量庞大且病死率高,城乡患者相对较少但发病率增长速度加快,患病人群逐渐呈现出年青化趋势,乳腺癌目前手术治疗后辅助放射治疗是乳腺癌的重要治疗手段。理论上电离辐射能够杀伤肿瘤细胞,因此,现阶段临床多采用放疗的方法进行恶性肿瘤的治疗。但当放疗条件一定的情况下,为了加大治疗效果,继续优化放疗射线物理剂量的分布就会受到一定的限制。Mittal等〔10〕报道,TLR4表达在辐射抵抗细胞上,其存在对肿瘤的致癌作用必不可少,同时也证明TLR4与放射敏感性密切相关。
在肿瘤的放射治疗中,免疫细胞表面的TLR4信号诱导的炎性反应能影响宿主免疫应答,产生抗肿瘤免疫,从而帮助肿瘤细胞产生免疫逃逸〔11〕。然而,肿瘤细胞在受到辐射后可释放内源性配体,激活TLR4信号通路,刺激NF-κB产生,从而促进各种细胞因子的释放,如IL-6,血管内皮生成因子(VEGF)等,促进肿瘤细胞的增殖和转移,抑制凋亡,进而降低肿瘤的治疗效果。因此,我们可以以TLR4为作用靶点选择合适的药物,抑制其反应通路,降低肿瘤细胞的放射抵抗,也可以通过其他途径增强肿瘤细胞的放射敏感性,提高肿瘤放疗效果。迄今对表达在人乳腺癌细胞上TLR4的研究甚少,因此,进一步研究和阐述TLR4对乳腺癌细胞的功能和生物学特性尤为重要。
细胞表面膜受体在感应电离辐射作用后,启动的信号传导过程可大体分为两类,即细胞保护性通路和细胞毒性通路。前者与照射后细胞的抑制增殖有关;后者主要引起细胞凋亡〔12〕。本实验结果显示,应用TLR4信号通路抑制剂TAK-242阻断后能明显抑制受照MCF-7细胞的增殖,LPS能明显促进MCF-7细胞的增殖;用TAK242阻断TLR4后,辐射诱导MCF-7细胞凋亡率明显增多而用LPS刺激后其凋亡率明显受抑制;阻断TLR4后受照的MCF-7细胞对存活分数降低,而刺激TLR4后受照的MCF-7细胞对存活分数升高,说明TLR4与MCF-7细胞的放射敏感性相关。这与Mittal等〔10〕报道的表达在辐射抵抗细胞上的TLR4对肿瘤的致癌作用必不可少结果相一致,结果说明高表达TLR4的肿瘤细胞比低表达的肿瘤细胞具有辐射抗性。
文献报道〔13〕,电离辐射诱导的DNA 损伤可引起细胞周期延迟,受损细胞不能通过G1 期关卡和G2 期关卡而发生G1期阻滞及G2期阻滞,得到更多修复的机会,得以进入下一细胞周期,而未修复的细胞则被清除。本实验结果显示,辐射可诱导肿瘤细胞G2期阻滞,从而有充足的时间来修复DNA损伤,有利于细胞清除,这可能是不同肿瘤细胞有不同放射敏感性的原因之一,说明阻滞TLR4可以增敏乳腺癌MCF-7 细胞, 并且可以诱导细胞发生G2 期阻滞,其结果为临床治疗乳腺癌提供新的思考和实验数据, 为乳腺癌放射治疗提供新的理论基础。
4 参考文献
1Woods DC, White YA, Dau C,etal. TLR4 activates NF-κB in human ovarian granulosa tumor cells〔J〕. BBRC,2011;409(4) : 675.
2Sato Y, Goto Y, Narita N,etal. Cancer cells expressing Toll like receptors and the tumor microenvironment 〔J〕. Cancer Microenviron, 2009;2(1) :205 .
3Huang B, Zhao J, Li H,etal. Toll-like receptors on tumor cells facilitate evasion of immune surveillance〔J〕.Cancer Res,2005;65(12):5009-14.
4Huang B, Zhao J, Unkeless JC,etal.TLR signaling by tumor and immune cells a double-edged sword〔J〕. Oncogene, 2008;27(2):218-24.
5Rakoff,Nahoum S, Medzhitov R. Toll- like receptors and cancer〔J〕. Nat Rev Cancer, 2009;9(1): 57- 63.
6Masayuki Li, Naoko Matsunaga, Kaoru Hazeki,etal. A novel cyclohexene, Ethyl(6R)-6-〔N-(2-Chloro-4-fluorophenyl)sulfamoyl〕cyclohex-1-ene-1-carboxylate(TAK-242), selectively inhibits Toll-like receptor 4-mediated cytokine production through auppression of intracellular signaling〔J〕. Mol Pharmacol, 2006;69(10):1288.
7Bennett DC, Charest J, Sebolt Ketal.High-throughput screening identifies aclacinomycin as a radiosensitizer of EGFR-mutant non-small cell lung cancer〔J〕.Transl Oncol, 2013;6(3):382-91.
8Yin Gao, Xiubin Fang, Yue Tong,etal. TLR4-mediated MyD88-dependent signaling pathway is activated by cerebral ischemia-reperfusion incortex in mice〔J〕. Biomed Pharmacothe, 2009;63(6):442.
9Jun Yu, Tiecheng Pan, Xiang Wei,etal. Aression of TLR9 in human pulmonary adenocarcinoma cell line A549〔J〕 .Chin-Gerf Clin Oncol, 2009;8(7):393.
10Mittal D, Saccheri F, Pusterla T,etal. TLR-4mediated skin carcinogenesis is dependent on immune and radioresistant cell〔J〕. EMBO J, 2010;29(13):2242-52.
11Paulos CM, Wrzesinski C, Kaiser A,etal. Microbial translocation augments the function of adoptively transferred self/tumor specific CD8+ T cells via TLR4 signaling 〔J〕. J Clin Invest, 2007;117(8): 2197.
12Albanese J, Dainiak N. Modulation if intercellular communication mediated at the cell surface and on extracellular, plasma membrane-derived vesicles by ionizing radiation〔J〕. Exp Hematol, 2003;31(6):445-64.
13梁 硕,王志成,龚守良. pshuttle-Egr1-Smac质粒对MCF-7细胞的辐射致敏作用及细胞周期进程的影响〔J〕. 中国实验诊断学,2011;31(2):202.

