CDc25c在肝脏缺血再灌注损伤中的保护作用
王 雅 赵 星 马从乾 杨 轲
(南阳市中心医院血管外科,河南 南阳 473000)
细胞周期调控异常是细胞发生凋亡的一个关键性事件,其核心成分为细胞周期蛋白及细胞周期蛋白依赖性激酶(CDK1)。Cdc25c是CDK1的一个新家族,在G2/M期转变中有重要的作用〔1〕。Cdc25c通过活化Cyclin B/Cdc 2复合物使细胞由G2期进入M期来对细胞起调控作用;Cdc25c作为ATM/ATR-Chk2/Chk1-Cdc25信号级联转导途径的下游底物,是G2/M期检查点重要效应因子〔2~4〕。本实验通过大鼠肝脏缺血再灌注损伤模型,探讨Cdc25c对缺血再灌注肝脏细胞凋亡的影响。
1 材料与方法
1.1实验动物及分组 清洁级雄性SD大鼠30只,体重300~350 g, 购于河南省实验动物中心。按照随机数字表法分为空白对照组(S组);缺血再灌注+生理盐水组(I/R组);pAdEasy-Cdc25c +缺血再灌注组(C组),每组10只。
1.2模型建立 腹腔注射1%戊巴比妥钠 (0.4~0.6 ml/100 g),剑突下行正中腹部切口3~4 cm,打开腹腔,暴露肝门,用无损伤血管钳夹闭门静脉,肝动脉造成全肝缺血30 min后,松夹恢复血流再灌注2 h。I/R组和C组在模型建立前12 h分别经门静脉注射生理盐水和pAdEasy-Cdc25c。手术完毕后,取肝组织放置于液氮和甲醛中。
1.3Western印迹 取100 mg组织及1 ml的RIPA和10 μl的甲苯基磺酰氟(PMSF)放入EP管并置于超声组织破碎仪中,之后按照RIPA裂解液说明书提取组织蛋白。二喹啉甲酸(BCA)法测蛋白浓度。取30 μg的组织总蛋白,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)凝胶电泳100 V,待蛋白至分离胶后120 V。湿转220 mA,2 h将凝胶上的蛋白转移至硝酸纤维素膜上。5%的脱脂奶粉封闭1 h。加入1∶1 000的1×盐酸缓冲液(TBS)稀释的一抗 Cdc25c(Santa Cruz公司兔抗多克隆抗体)及1∶1 000的1×TBS稀释的一抗Caspase 3(Santa Cruz公司兔抗单克隆抗体),4℃过夜。1×TBST洗膜3次,10 min/次。加入1∶3 000的1×TBS稀释的二抗(北京康为世纪的山羊抗兔IgG-HRP),室温1 h。1×TBST洗膜3次,10 min/次。加入1∶1 000的1×TBS稀释的一抗(北京康为世纪的兔抗鼠内参GAPDH一抗),4℃过夜。1×TBST洗膜3次,10 min/次。加入1∶3 000的1×TBS稀释的二抗(北京康为世纪公司的山羊抗兔lgG-HRP),室温1 h。1×TBST洗膜3次,10 min/次。待暗室加入增强化学发光法(ECL)发光剂曝光,显影。使用Quantity-one软件计算各个样本Cdc25c蛋白表达水平。
1.4免疫组织化学法 标本经甲醛固定,常规脱水、包埋,连续4 μm切片,分别作苏木素-伊红(HE)和免疫组化(SP)染色。SP试剂盒、兔源性多克隆抗体均为Santa Cruz公司产品(抗体工作比例为1∶100)。3%H2O2-甲醇阻断内源性过氧化物酶,微波(750W,95℃,5 min×2次)抗原修复,二氨基联苯胺(DAB)显色,HE复染。每批染色均设阳性对照和阴性对照,严格按SP试剂盒的说明进行染色。判断标准:①按细胞显色有无及深浅计分:0分,细胞无显色;1分为浅黄色;2分为棕黄色;3分为棕褐色。②.按细胞的显色比例计分:0分,显色细胞<10%;1分,10%~30%显色;2分,31%~60%显色;3分,60%以上显色。每例积分=①×②。按积分高低分为:阴性(-),计分为0分;弱阳性(+),积分1~4分;强阳性(),积分>4分。
1.5细胞凋亡原位末端转移酶标记法(TUNEL) 标本经甲醛固定,常规脱水、包埋,连续4 μm切片,经二甲苯脱蜡,梯度乙醇水化,严格按照TUNEL凋亡试剂盒说明书(In Situ cell Death Detection Kit, Fluorescein; Roche),滴加TUNEL反应液,温箱孵育,滴加抗荧光淬灭剂,进行封片。
1.6统计学方法 应用SPSS17.0软件进行分析,蛋白表达量及细胞凋亡率利用t检验。
2 结 果
2.1免疫组织化学及Western印迹检测Cdc25c和(Caspase)-3的表达 图1,图2可见,Caspase-3在I/R组的表达高于S组并且I/R组明显低于C组(P<0.05)。Caspase-3蛋白的阳性表达主要位于胞质,呈黄色或者棕黄色颗粒。Caspase-3在缺血再灌注组中的阳性率明显高于正常组(P<0.05)。通过上调Cdc25c基因表达,在肝脏缺血再灌注组中的Caspase-3表达明显下降(P<0.05)。Cdc25c在S和C组明显高于I/R组(P<0.05)。
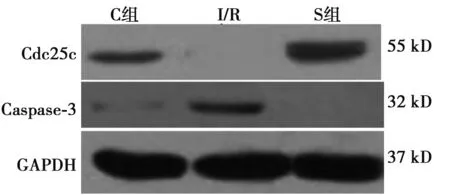
图1 Western印迹分析Cdc25c、Caspase 3在肝脏组织中的表达
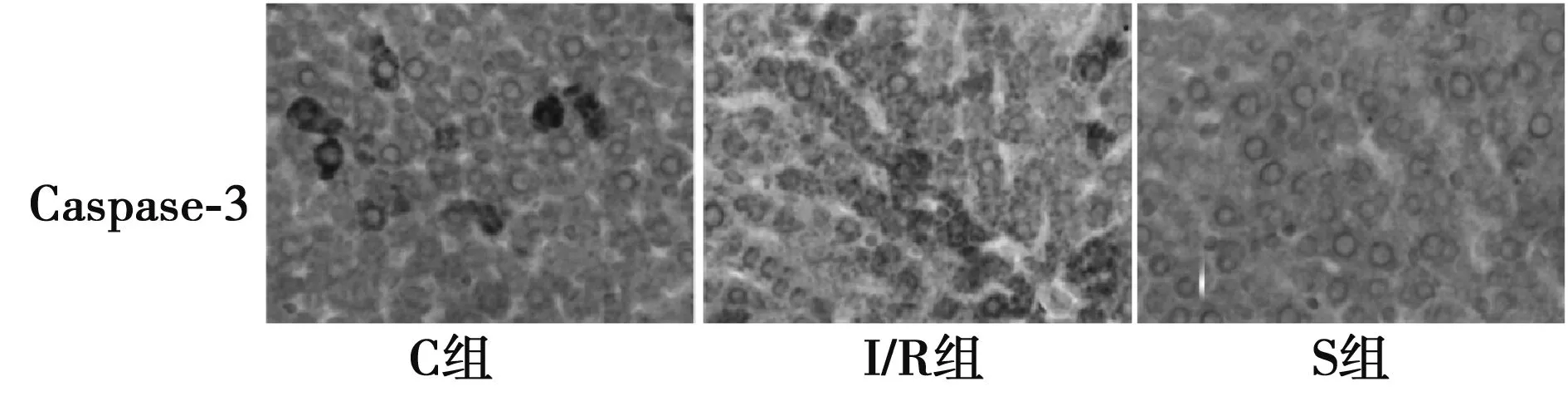
图2 免疫组织化学检测Caspase 3在肝脏组织中的表达
2.2TUNEL 检测肝细胞的凋亡 I/R组的凋亡比S组明显升高(P<0.05)。而在C组凋亡较I/R明显下降(P<0.05),见图3。

图3 TUNEL检测肝细胞的凋亡
3 讨 论
肝脏缺血再灌注是肝部分切除及肝移植的主要制约因素之一,是导致患者死亡的主要原因。是指各种原因导致肝血流中断或者不足使肝脏缺血,当恢复血供再灌注后,肝细胞功能代谢障碍及结构破坏反而加重。凋亡是肝脏缺血再灌注损伤后细胞死亡的主要方式〔5~7〕。
细胞周期是细胞生命活动的基本过程。周期蛋白激酶是调控细胞周期网络的核心。细胞周期中必需的Cdc25基因所表达的蛋白质为Cdc25磷酸酶,它是细胞周期调控蛋白,在正常的细胞周期中具有重要的作用。Cdc25c基因位于染色体5q31,由14个外显子和14个内含子组成,全长约2 115 bp, 其cDNA的开放阅读框架由1 419个核苷酸组成,编码473个氨基酸。Cdc25c通过正反馈机制在调节细胞的有丝分裂〔1〕。当Cdc25c活性受抑制时,CDK1/周期蛋白B1复合物的活性也受将受抑制,G2期检查点的总开关处于“关闭”状态,发生G2/M期阻滞,进而导致细胞分裂停止,进而导致细胞的凋亡。
细胞周期调控机制的失活,特别是在G1/S期和G2/M期检查点的失活,在细胞凋亡的过程中起重要作用,在人类的许多肿瘤中存在Cdc25c的过量表达。通过抑制Cdc25c的表达可以诱发细胞凋亡,从而有效的抗肿瘤增殖〔8~10〕。
本研究显示凋亡蛋白Caspase-3在缺血再灌注组中的表达明显高于正常组织;干预后Caspase-3的蛋白表达明显降低和免疫组织化学结果一致。这可能由于通过ATM-Chk2途径导致DNA损伤,进而导致细胞周期停止,进展导致细胞凋亡。这和Agarwal等〔11〕的报道一致。
Caspase-3是细胞凋亡的效应分子,它在各种生理和病理因素刺激下,通过其家族成员的级联放大,实施细胞的凋亡,引起细胞特征性的凋亡形态学上的改变,加重组织或者器官的功能损害。本研究提示Cdc25c具有抑制肝细胞凋亡和改善肝功能的作用,有利于预防肝脏缺血再灌注损伤。然而要将之用于临床,还要做进一步的深入研究。
4 参考文献
1Aressy B, Ducommun B. Cell cycle control by the Cdc25 phosphatases〔J〕. Antic Agents Med Chem,2008;8(8):818-24.
2Donzelli M, Draetta GF. Regulating mammalian checkpoints through Cdc25 inactivation〔J〕. EMBO Rep,2003;4(7):671-7.
3Takizawa CG, Morgan DO. Control of mitosis by changes in the subcellular location of cyclin-B1-Cdk1 and Cdc25C〔J〕. Curr Opin Cell Biol,2000;12(6):658-65.
4Nilsson I, Hoffmann I. Cell cycle regulation by the Cdc25 phosphatase family〔J〕. Prog Cell Cycle Res,2000;4(1):107-14.
5Jaeschke H. Molecular mechanisms of hepatic ischemia-reperfusion injury and preconditioning〔J〕. Am J Physiol Gastrointest Liver Physiol,2003;284(1):G15-26.
6Borghi-Scoazec G, Scoazec JY, Durand F,etal. Apoptosis after ischemia-reperfusion in human liver allografts〔J〕. Liver Transpl Surg,1997;3(4):407-15.
7Teoh NC, Farrell GC. Hepatic ischemia reperfusion injury: pathogenic mechanisms and basis for hepatoprotection〔J〕. J Gastroenterol Hepatol,2003;18(8):891-902.
8Kristjansdottir K, Rudolph J. Cdc25 phosphatases and cancer〔J〕. Chem Biol,2004;11(8):1043-51.
9Hernandez S, Bessa X, Bea S,etal. Differential expression of cdc25 cell-cycle-activating phosphatases in human colorectal carcinoma〔J〕. Lab Invest,2001;81(4):465-73.
10Molinari M, Mercurio C, Dominguez J,etal. Human Cdc25 A inactivation in response to S phase inhibition and its role in preventing premature mitosis〔J〕. EMBO Rep,2000;1(1):71-9.
11Agarwal C, Tyagi A, Agarwal R. Gallic acid causes inactivating phosphorylation of cdc25A/cdc25C-cdc2 via ATM-Chk2 activation, leading to cell cycle arrest, and induces apoptosis in human prostate carcinoma DU145 cells〔J〕. Mol Cancer Ther,2006;5(12):3294-302.

