氯化锂对人神经母细胞瘤细胞氧糖剥夺模型PARP/AIF凋亡信号通路的影响
贾国强 付宝莲 巴晓红
(建昌县人民医院,辽宁 建昌 125300)
氯化锂对氧糖剥夺的SH-SY5Y细胞具有较强的保护作用,1.0 mmol/L氯化锂为细胞保护的有效剂量,其作用机制之一可能是对 AIF信号通路的抑制〔1〕。本实验拟采用氧糖剥夺的SH-SY5Y细胞模型模拟脑缺血再灌注损伤进一步阐述氯化锂对PARP-1/AIF信号通路的影响,为锂剂用于缺血性脑血管病的治疗奠定理论基础。
1 材料与方法
1.1主要仪器设备 二氧化碳(CO2)培养箱;低温高速离心机;BB6220型三气培养箱;倒置相差显微镜;显微照相系统;超净工作台;BIO-RAD电泳槽;BIO-RAD半干转印仪。
1.2主要试剂 氯化锂(Sigma)、兔抗人AIF单克隆抗体(abcam)、TRITC标记的山羊抗兔IgG二抗(Santa cruz)、兔抗人PARP-1单克隆抗体(Abcam)、小鼠抗人β-actin单抗(Santa cruz)、辣根过氧化物酶标记的羊抗小鼠IgG (Santa cruz)、辣根过氧化物酶标记的羊抗兔IgG (Santa cruz)、兔抗组蛋白H1多克隆抗体(Santa cruz)、DMEM培养液(Hyclone)、胎牛血清(Hyclone)、BCA蛋白定量试剂盒及细胞核蛋白与细胞质蛋白抽提试剂盒(碧云天生物科技公司),TUNEL细胞凋亡(显色法)检测试剂盒(生研生物科技有限公司)。
1.3细胞 人神经母细胞瘤SH-SY5Y细胞(中国医科大学附属盛京医院神经内科王占强惠赠)。
1.4实验方法
1.4.1细胞培养及氧糖剥夺模型的制备 取一管冻存的SH-SY5Y细胞,复苏,离心,加入10%胎牛血清的DMEM培养液,于37℃、5% CO2的培养箱中培养2~3 d,细胞长满单层,传代。模型制备:更换培养液为无血清、无糖人工脑脊液,置入恒温(37℃)三气培养箱,连续充以无氧气体(90% N2, 9% CO2和1% O2)。继续培养4 h取出,更换原培养液,在常氧下继续培养24 h。
1.4.2细胞分组 取传代后培养2 d的SH-SY5Y细胞分为正常对照组,氧糖剥夺组和锂剂处理组。正常对照组细胞一直置于37℃,5%饱和湿度CO2培养箱内培养。氧糖剥夺组更换nACSF,培养30 min后,造模。锂剂处理组在造模前nACSF中加入1.0 mmol/L的锂剂进行预处理。
1.4.3TUNEL染色(显色法)检测细胞凋亡 按TUNEL细胞凋亡检测试剂盒(生研生物科技有限公司)说明进行操作。每张切片随机选400倍下3个视野,进行双盲观测,计算平均阳性率作为该标本的阳性率。
1.4.4Western印迹检测PARP-1、AIF蛋白的表达 取各组细胞,按照细胞核蛋白与细胞质蛋白抽提试剂盒(碧云天生物科技公司)说明书操作,提取胞浆蛋白、胞核蛋白。然后按照BCA蛋白定量试剂盒(碧云天生物科技公司)说明书操作进行蛋白浓度测定,分别取等量蛋白质进行10%SDS-PAGE电泳分离,分离后的蛋白质转移至PVDF 膜;膜经5%脱脂奶粉封闭,加入一抗(分别为1∶500稀释的兔抗人AIF单抗、兔抗组蛋白H1单抗、兔抗人PARP-1单抗,小鼠抗人β-actin单抗),4℃过夜;加入辣根过氧化物酶标记的二抗(分别为羊抗兔IgG、羊抗小鼠IgG),室温孵育 1 h,用DAB显色。以β-actin与Histone分别作为细胞质与细胞核的内参照进行校正,凝胶成像分析系统分析扫描结果:测定蛋白条带的积分光密度。目的蛋白相对量=目的蛋白条带积分光密度/内参蛋白条带积分光密度。
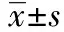
2 结 果
2.1TUNEL染色检测细胞凋亡 正常对照组:有少量TUNEL阳性细胞(1.80±0.82)。氧糖剥夺组TUNEL阳性细胞数较正常对照组明显增多(16.40±2.30,P<0.05)。锂剂处理组TUNEL阳性细胞数较氧糖剥夺组明显减少(6.52±1.86,P<0.05),见图1。
2.2Western 印迹检测PARP-1、AIF蛋白的表达 SH-SY5Y细胞氧糖剥夺前后,胞质内PARP-1 p85片段没有表达,胞质内AIF蛋白表达无差异。而在胞核中,正常对照组中PARP-1 p85片段呈低表达,AIF蛋白低表达或不表达,细胞氧糖剥夺后PARP-1 p85片段、AIF蛋白高表达,且锂剂处理组PARP-1 p85片段、AIF条带的表达比氧糖剥夺组少,见表1、图2、图3。
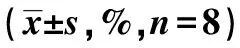
表1 不同组PARP-1 p85片段、AIF蛋白印迹密度(OD)比较
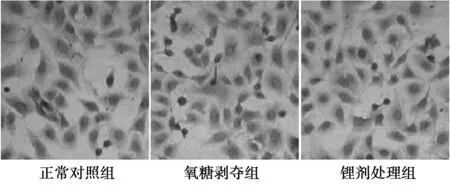
图1 不同组细胞TUNEL染色阳性表达(×400)
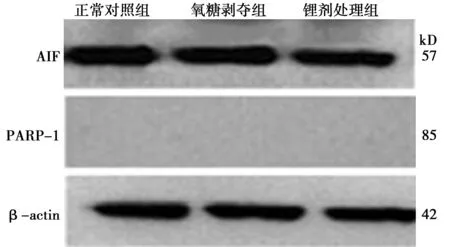
图2 各组细胞质内蛋白Western印迹表达
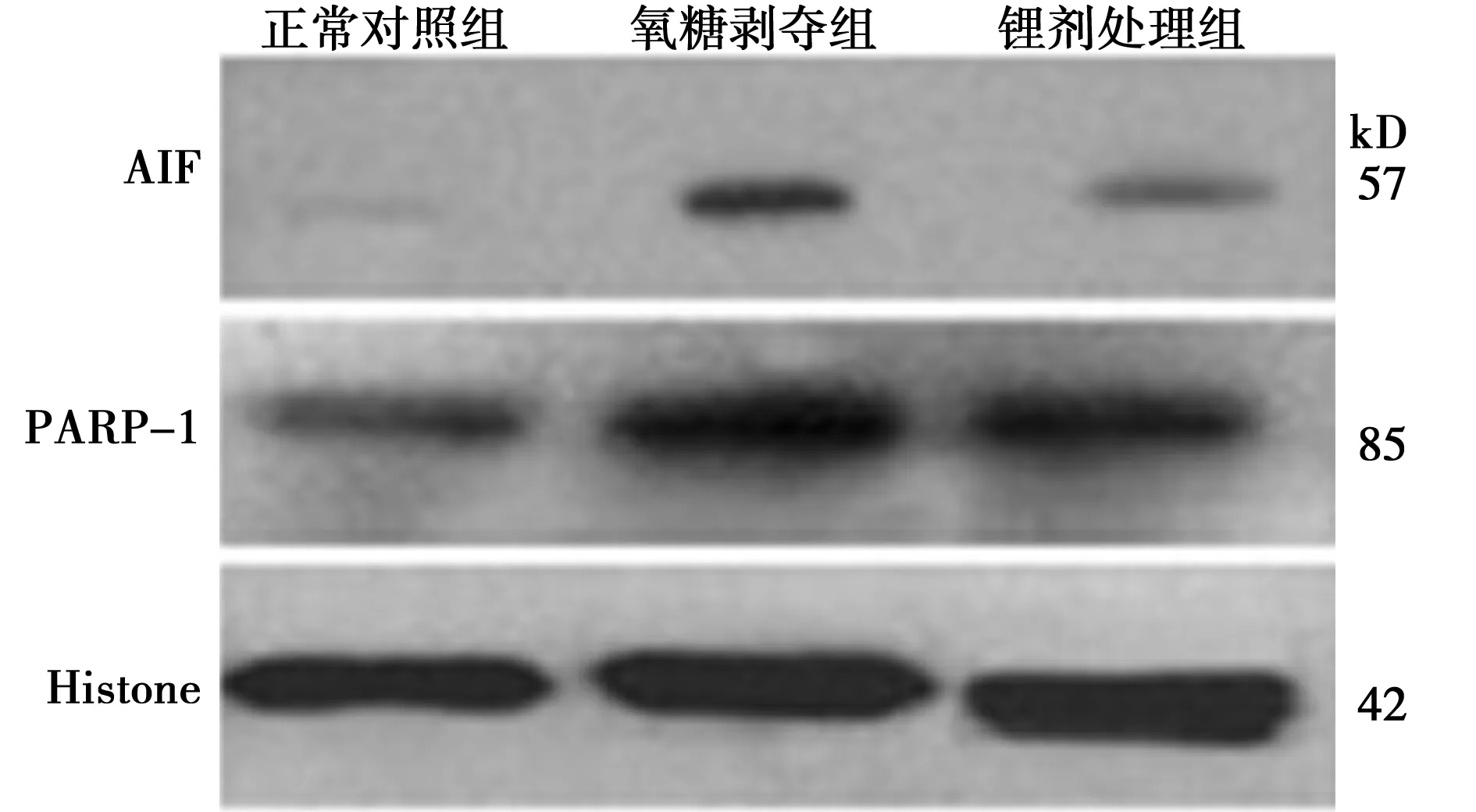
图3 各组细胞核内蛋白Western印迹表达
3 讨 论
本研究表明氯化锂对氧糖剥夺模型的神经细胞有较强的保护作用。研究表明,这种保护作用可能是通过抑制AIF核移位实现的〔1〕。但是造成这种核移位的原因可能是通过激活PARP-1所造成的。
PARP-1是一种核染色质伴随蛋白,广泛存在于真核细胞内。PARP-1是caspase-3底物之一,caspase-3可将PARP-1裂解为85 kD和24 kD片段,丧失了DNA的修复作用,故出现PARP-1的裂解片段,被认为是发生细胞凋亡的一个早期标志〔2〕。脑缺血后予数天连续抑制PARP-1表达,可通过抑制炎症反应而延长受损神经元细胞存活并能促进神经再生〔3〕。AIF的释放与PARP-1有关〔4,5〕。Zhang等〔6〕体外实验得出PARP-1抑制剂可阻止AIF核移位。PARP-1基因敲除同样可抑制AIF的移位。因此认为PARP-1是AIF从线粒体释放的上游诱导因子。研究发现PARP-1与AIF依赖的细胞凋亡可能涉及p53基因、Bax和钙蛋白酶,但不包括半胱氨酸蛋白酶和PARP-2〔7〕。
AIF定位于线粒体,细胞质内AIF主要反应线粒体的AIF的表达量。而细胞核内的PARP-1 p85片段在各组细胞中均有表达,氧糖剥夺前较氧糖剥夺后表达增强,而锂剂处理组较氧糖剥夺组表达减少,说明氧糖剥夺激活了PARP-1,而AIF蛋白在正常对照组中呈低表达或不表达,在氧糖剥夺组、锂剂处理组中呈高表达,但锂剂处理组较氧糖剥夺组表达的明显减少,说明氯化锂通过激活PARP-1,从而抑制 AIF从线粒体向细胞核移位,产生抗凋亡的作用。
但是PARP-1的激活是怎么促使AIF发生核移位的,至今学界内没有明确的解释。正常情况下,PARP-1起到修复DNA作用和维持基因组的稳定性〔8〕,但如果PARP-1过度活化可导致ATP和 NAD+不可逆的衰竭〔9〕,线粒体是体内产生能量的主要场所,大量的ATP消耗,导致线粒体膜通透性发生改变,AIF从线粒体被释放出来,转移到细胞核,启动凋亡的发生。AIF引起染色体核周边凝集和DNA成大片段的断裂〔10〕,造成PARP-1不能及时的修复,加重细胞的损害,恶性循环,最终细胞发生坏死。但现在更多证据表明单纯的能量消耗不足以介导PARP-1依赖性细胞死亡。在PARP-1敲除小鼠上行缺血性卒中模型研究发现予维持细胞内能量水平,并不是减小脑梗死体积的机制。另外,用原代细胞培养技术研究发现,削弱细胞内能量水平不是PARP-1介导的细胞死亡的主要原因〔11〕。PARP-1过度激活后,大量的PAR形成对细胞有直接毒性作用〔12〕。另外,有可能通过亚细胞器等其他的途径引起的。
综上,氯化锂对氧糖剥夺模型的SH-SY5Y细胞具有较强的保护作用,其作用机制之一可能是通过抑制PARP-1活性,从而减少AIF发生核移位。
4 参考文献
1贾国强, 巴晓红, 潘凤英.锂剂对SH-SY5Y细胞氧糖剥夺模型的保护作用及其对AIF凋亡通路的影响〔J〕.中风与神经疾病杂志,2011;28(3): 228-32.
2Lazebnik YA, Kaufmann SH, Desnoyers S,etal.Cleavage of poly(ADP-ribose) polymerase by a proteinase with properties like ICE〔J〕.Nature, 1994;371(6495): 346-7.
3Kauppinen TM, Suh SW, Berman AE,etal.Inhibition of poly(ADP-ribose) polymerase suppresses inflammation and promotes recovery after ischemic injury〔J〕.J Cereb Blood Flow Metab,2009;29(4): 820-9.
4Yu SW, Andrabi SA, Wang H,etal.Apoptosis-inducing factor mediates poly (ADP-ribose) (PAR) polymer-induced cell death〔J〕.Proc Natl Acad Sci USA, 2006;103(48): 18314-9.
5Andrabi SA, Kim NS, Yu SW,etal.Poly(ADP-ribose)(PAR) polymer is a death signal〔J〕.Proc Natl Acad Sci USA, 2006;103(48): 18308-13.
6Zhang Y, Zhang X, Park TS,etal.Cerebral endothelial cell apoptosis after ischemia-reperfusion: role of PARP activation and AIF translocation〔J〕.J Cereb Blood Flow Metab, 2005;25(7): 868-77.
7Moubarak RS, Yuste VJ, Artus C,etal.Sequential activation of poly(ADP-ribose) polymerase 1, calpains, and Bax is essential in apoptosis-inducing factor-mediated programmed necrosis〔J〕.Mol Cell Biol, 2007;27(13): 4844-62.
8Masutani M, Suzuki H, Kamad N,etal.Poly(ADP-ribose) polymerase gene disruption conferred mice resistant to streptozotocin-induced diabetes〔J〕.Proe Natl Aead Sci USA,1999;96(5):2301-4.
9Nguewa PA, Fuertes MA, Valladares B,etal.Poly(ADP-ribose) Polymerases: homology, structural domains and functions.Novel therapeutical applications〔J〕.Prog Biophys Mol Biol,2005;88(1):143-72.
10Yu SW, Andrabi SA, Wang H,etal.Apoptosis-inducing factor mediates poly (ADP-ribose) (PAR) polymer-induced cell death〔J〕.Proc Natl Acad Sci USA, 2006;103(48): 18314-9.
11Wang Y, Dawson VL, Dawson TM.Poly(ADP-ribose) signals to mitochondrial AIF: a key event in parthanatos〔J〕.Exp Neurol,2009;218(2): 193-202.
12Szabo G, Bahrle S, Stumpf N,etal.Poly(ADP-Ribose) polymerase inhibition reduces reperfusion injury after heart transplantation〔J〕.Circ Res,2002;90(1): 100-6.

