齐墩果酸通过线粒体途径诱导原髓细胞白血病细胞株细胞凋亡
杨 玉 商 宇 陈珏晓 徐 鹏 卢晓潇 孙志博 张 丽 邵文武 张鹏霞
(佳木斯大学医学院,黑龙江 佳木斯 154007)
齐墩果酸(OA)是中药女贞子的主要成分。研究表明,OA具有诱导人白血病原髓细胞株(HL-60)细胞凋亡及细胞周期阻滞的作用〔1~3〕,但是其诱导凋亡的机制尚不完全清楚。本实验检测线粒体凋亡信号通路关键蛋白半胱氨酸蛋白酶(Caspase)-9、Smac/DIABLO、细胞色素C(Cyt-c)和凋亡诱导蛋白(Bid)表达,研究其对线粒体凋亡信号通路的干预作用,探讨OA诱导HL-60细胞凋亡的机制,为应用OA治疗白血病提供实验依据。
1 材料与方法
1.1药品与主要试剂 人早幼粒系白血病HL-60细胞购自中国科学院上海细胞库。抗Caspase-9抗体购自美国Oncogene公司,抗Smac/DIABLO抗体购于上海康成生物工程有限公司,抗Cyt-c抗体购于北京博奥森生物技术有限公司,抗Bid抗体与抗β-Actin抗体均为美国Santa cruz公司产品。苯甲基磺酰氟(PMSF)与丙烯酰胺购自美国Sigma公司。
1.2方法
1.2.1药物配制 OA溶于二甲基亚矾(DMSO)中,用含新生牛血清的RPMI-1640稀释,配制成最终浓度800 μmol/L的储存液。常规方法配制蛋白质免疫印迹法试剂。
1.2.2细胞培养与分组 HL-60细胞接种于培养瓶,加入含有胎牛血清、青霉素、链霉素的RPMI-1640培养液,置于5%CO2饱和湿度培养箱培养,2~3 d传代一次。实验设空白对照组与OA用药组。空白对照组:HL-60细胞培养于含0.05%DMSO的RPMI-1640培养基。OA用药组:按照前期实验结果,选择80 μmol/L OA处理HL-60细胞12、24、48 h。
1.2.3细胞总蛋白的提取及Caspase-9测定 分别收集对照组和OA用药组细胞。冷磷酸盐缓冲液(PBS)洗涤,PBS重悬细胞并转移细胞至Ep管,加入细胞裂解液,冰浴,离心,取上清,蛋白浓度经二奎啉甲酸(BCA)法测定。煮沸使蛋白变性,等量蛋白(50 μg)经十二烷基硫酸钠-聚丙烯酰胺凝胺(SDS-PAGE)电泳分离 (β-Actin,Caspase-9:15 %)。转移蛋白至硝酸纤维素(NC)膜,封闭后加适量滴度一抗 (β-Actin,1∶500;Caspase-9,1∶500),4℃轻摇过夜。加辣根过氧化物酶标记的羊抗兔二抗(1∶1 000),TBS-T漂洗,Western Blotting Luminol Reagent化学发光法曝光显影。
1.2.4线粒体的提取与去线粒体细胞质的制备 收集各组细胞,PBS洗涤后,将细胞悬于含蛋白酶抑制剂的匀浆缓冲液,匀浆20次,离心去除细胞核及未破碎的细胞。取上清再次离心,所得的上清液即为胞质部分。取沉淀,用匀浆缓冲液(含蛋白酶抑制剂并加入1 % Triton-100)洗2次并重悬,离心,所得上清液即为线粒体部分。制备线粒体匀浆,BCA蛋白浓度测定试剂盒测定线粒体和去线粒体细胞质的蛋白浓度。
1.2.5线粒体Bid蛋白和去线粒体细胞质Smac/DIABLO、Cyt-C蛋白的检测 空白对照组与OA用药组分别收集2×107个HL-60细胞,提取线粒体并制备去线粒体细胞浆。聚丙烯酰胺凝胶电泳分离,分别转至NC膜,以兔抗人的Bid抗体孵育线粒体,以兔抗人Cyt-c抗体和兔抗人Smac/DIABLO抗体分别孵育去线粒体细胞浆,加适量滴度辣根过氧化物酶标记的羊抗兔二抗,Western Blotting Luminol Reagent化学发光法曝光显影。
2 结 果
2.1OA对HL-60细胞Caspase-9蛋白表达的影响 42 kD分子量的β-Actin 蛋白为上样量对照。不同时间的OA作用于HL-60细胞后,46 kD分子量的Pro-Caspase-9随时间的增加而减少,这意味着降解后有活性的Caspase-9在逐渐增加。见图1。

图1 各组HL-60细胞Caspase-9蛋白的表达
2.2OA对HL-60细胞线粒体Bid蛋白表达的影响 HL-60细胞经OA处理后,线粒体Bid表达逐渐增加,48 h线粒体Bid表达最高,见图2。

图2 各组HL-60细胞线粒体Bid蛋白的表达
2.3OA对HL-60细胞去线粒体胞质Smac/DIABLO和Cyt-c蛋白表达的影响 HL-60细胞去线粒体胞质中Smac/DIABLO和Cyt-c蛋白表达随OA作用时间的增加而增加,提示在OA诱导的凋亡过程中伴随Smac/DIABLO和Cyt-c从线粒体中释放。见图3。
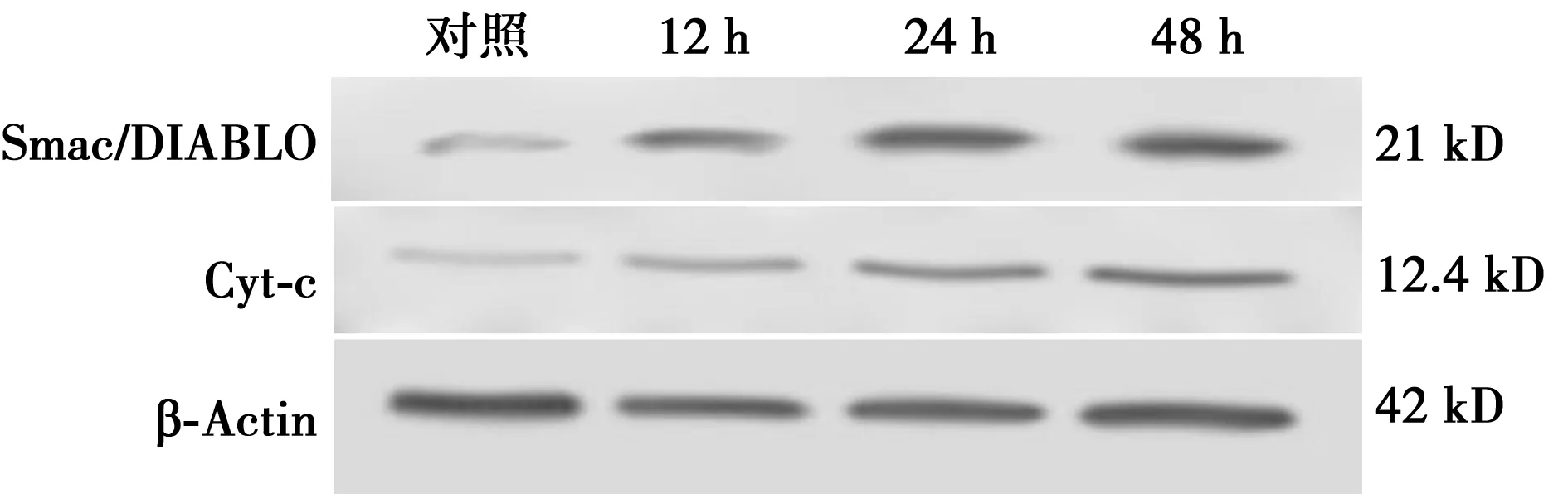
图3 各组HL-60细胞去线粒体胞质Smac/DIABLO和Cyt-c蛋白的表达
3 讨 论
在深入研究细胞凋亡调控机制与信号通路的过程中,以线粒体为核心的凋亡信号通路日益得到人们重视。线粒体及相关凋亡因子可以作为新型药物的潜在作用靶点,为疾病(尤其是肿瘤)的治疗提供新的策略〔4〕。线粒体凋亡信号通路被活化的关键事件是Cyt-c的释放。众多研究表明,在凋亡信号的刺激下,Bcl-2家族成员中的Bid蛋白被Caspases-8、GrB等蛋白酶剪切,形成截短的15 kD片断tBid。tBid片段转位至线粒体并诱导线粒体外膜通透性增加,引起Cyt-c、Caspase-9等促凋亡蛋白的释放〔5,6〕。Smac/DIABLO 在Cyt-c的诱导下释放至细胞质〔7〕,并辅助Cyt-c活化Caspase-9,Caspase-9再活化Caspase-3,从而激活Caspase级联反应,使细胞凋亡。
Caspase-9是线粒体凋亡信号通路下游引起Caspase级联反应诱导细胞凋亡的关键分子,实验过程中观察到Caspase-9随着OA的作用时间延长而增加,提示OA对HL-60细胞线粒体凋亡信号通路具有干预作用。为了研究Cyt-c和Smac/DIABLO量的变化,制备了去线粒体细胞浆,以避免提取细胞液时线粒体破碎所引起的线粒体成分在细胞液中的增加。研究结果提示在凋亡信号的刺激下,储存于线粒体中的Cyt-c和Smac/DIABLO被释放至细胞质,参与HL-60细胞凋亡。另外,在凋亡信号诱导下,剪切形成的tBid蛋白经胞质转位至线粒体,诱导线粒体中促凋亡蛋白释放,使细胞凋亡。
综上所述,OA可以通过以线粒体为核心的凋亡信号通路诱导HL-60细胞的凋亡。OA作用于其靶点,活化Caspases-8、GrB等蛋白酶,并剪切Bid蛋白,随之tBid片段转位至线粒体,使Cyt-c、Caspase-9、Smac/DIABLO等促凋亡蛋白释放至胞质,诱导细胞凋亡。细胞凋亡的调控机制十分复杂,各个凋亡通路也并非独立运转而是彼此交错、互相调控。接下来的研究工作,将寻找OA的准确药物靶点,更加深入地研究OA的促凋亡机制,争取为OA应用于临床提供更多的实验依据。
4 参考文献
1Zhang P,Li H,Chen D,etal.Oleanolic acid induces apoptosis in human leukemia cells through caspase activation and poly(ADP-ribose) poly-merase cleavage〔J〕.Acta Biochim Biophys Sin,2007;39(10):803-9.
2Ma W,Wang DD,Li L,etal.Caveolin-1 plays a key role in Oleanolic acid-induced apoptosis of HL-60 cells〔J〕.Oncology Reports,2014;32(1):293-301.
3马 微,李 丽,杨永旭,等.CAV-1基因在五种白血病细胞中的表达〔J〕.中国老年学杂志,2013;33(19):4754-6.
4Bouchier-Hayes L,Lartigue L,Newmeyer DD.Mitochondria:pharmacological manipulation of cell death〔J〕.J Clin Invest,2005;115(10):2640-7.
5Chou JJ,Li H,Salvesen GS,etal.Solution structure of BID,an intracellular amplifier of apoptotic signaling〔J〕.Cell,1999;96(5):615-24.
6周翔宇,刘 宁,闫 珊,等.S1通过线粒体途径诱导人卵巢癌细胞凋亡〔J〕.中国老年学杂志,2014;34(1):122-4.
7Creagh EM,Murphy BM,Duriez PJ,etal.Smac/Diablo antagonizes ubiquitin ligase activity of inhibitor of apoptosis proteins〔J〕.J Biol Chem,2004;279(26):26906-14.

