表皮生长因子受体表达水平对西妥昔单抗及其介导的抗体依赖的细胞介导的细胞毒作用杀伤肺腺癌A549细胞的影响
李瑾昱,焦顺昌,张国庆,孙胜杰
中国人民解放军总医院肿瘤内科,北京 100853
表皮生长因子受体表达水平对西妥昔单抗及其介导的抗体依赖的细胞介导的细胞毒作用杀伤肺腺癌A549细胞的影响
李瑾昱,焦顺昌,张国庆,孙胜杰
中国人民解放军总医院肿瘤内科,北京 100853
目的探讨表皮生长因子受体 (EGFR)表达水平对西妥昔单抗及其介导的抗体依赖的细胞介导的细胞毒作用 (ADCC)对肺腺癌A549细胞杀伤的影响。方法以肺腺癌A549细胞作为靶细胞,NKTm细胞作为效应细胞,将pEGFR-EGFP质粒用核转染技术导入A549细胞,免疫组织化学法检测转染组与野生组A549细胞表面EGFR蛋白的表达水平。采用细胞计数试剂盒-8法检测西妥昔单抗以及西妥昔单抗介导的ADCC作用对转染后A549细胞与野生组A549细胞的体外杀伤率。结果免疫组织化学结果显示,野生组A549细胞EGFR表达呈弱阳性,而转染后的A549细胞EGFR表达呈强阳性。西妥昔单抗介导的ADCC作用对转染后高表达EGFR的A549细胞具有更强的杀伤作用 (P<0.05),而西妥昔单抗单独作用时,转染组与野生组间的杀伤率差异无统计学意义 (P>0.05)。结论细胞表面EGFR蛋白的表达水平能够影响西妥昔单抗介导的ADCC作用对肺腺癌A549细胞的杀伤,而对西妥昔单抗本身的杀伤作用无影响。
西妥昔单抗;非小细胞肺癌;表皮生长因子受体
Acta Acad Med Sin,2014,36(2):164-167
西妥昔单抗是抗表皮生长因子受体 (epidermal growth factor receptor,EGFR)人/鼠嵌合型lgG1单克隆抗体,可以通过阻断内源性配体介导的EGFR信号传导通路抑制肿瘤的生长。此外,西妥昔单抗还能够通过发挥抗体依赖的细胞介导的细胞毒 (antibody-dependent cell-mediated cytotoxicity,ADCC)作用介导淋巴细胞释放细胞因子及胞内毒性物质,杀伤肿瘤细胞[1]。大规模临床研究证实与单纯化疗相比,联合西妥昔单抗能够延长患者的总生存期[2-3]。然而作为靶向药物的西妥昔单抗在非小细胞肺癌的治疗中尚缺乏有效的疗效预测指标。EGFR是西妥昔单抗发挥抗肿瘤作用的关键,研究表明肿瘤细胞高表达EGFR的非小细胞肺癌患者,在一线化疗方案中加用西妥昔单抗可能取得更好的疗效[4-5]。但EGFR表达水平是否真的能够预测西妥昔单抗联合化疗的疗效仍需前瞻性临床试验验证。本研究在细胞水平上探讨EGFR表达水平对西妥昔单抗以及其介导的ADCC作用杀伤肺癌细胞的影响。
材料和方法
材料西妥昔单抗注射液 (德国默克公司);RPMI-1640培养基、无菌磷酸盐缓冲液、胎牛血清(美国GIBCO公司);胰蛋白酶-EDTA消化液 (美国AMRESCO公司);细胞计数试剂盒-8(日本Dojindo laboratories公司);DH5α(美国GIBICO公司);细胞核转染试剂盒T(德国Amaxa Biosystems公司)。HERA Safe KS-12型生物安全柜、HERA Cell 240型CO2细胞培养箱、SORVALL LEGEND MACH 1.6R 离心机、Multiskan MK3酶标仪 (美国Thermo公司);Olympus BX41正置显微镜、Olympus CKX41倒置显微镜 (日本Olympus公司);Cytometer FC 500 MPL流式细胞仪(美国 BECKMAN公司);Veriti 96well梯度 PCR仪(Applied Biosystems公司);Amaxa Nucleofector system电转仪 (德国 Amaxa Biosystems公司)。人肺腺癌A549细胞为我室常规冻存;NKTm细胞由中国人民解放军总医院肿瘤中心实验室林星石教授培养并提供;pEGFR-EGFP质粒由华中科技大学同济医学院免疫研究所沈关心教授惠赠。
靶细胞及效应细胞的制备A549细胞用RPMI/1640培养液 (含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素)置于37℃,5%CO2培养箱中常规传代培养。取对数生长期的细胞制成悬液。NKTm细胞由中国人民解放军总医院肿瘤中心实验室制备,具体培养方法参见本实验室方法[6]。
pEGFR-EGFP质粒转染A549细胞将6孔板每孔加入1.5 ml培养液,放入培养箱中预热至37℃;添加剂与核转染溶液按1∶4.5的比例混合至100 μl;收集对数生长期的A549细胞1×106个,用上述100 μl混合液重悬细胞,充分混匀;加入2 μg pEGFR-EGFP质粒;迅速将液体移入电转杯中,盖好杯盖放入电转仪中,选择程序“A549 X-001”;按启动键,将质粒电转至A549细胞后迅速将细胞混合液移入6孔板中,37℃,5%CO2培养箱孵育。
流式细胞仪检测转染率转染后的A549细胞于37℃,5%CO2培养箱中孵育24 h后,弃上清,胰蛋白酶常规消化后用完全培养基中和,1 500 r/min,转矩300 N·m,离心5 min后弃上清,PBS溶液重悬后清洗3遍,流式细胞仪检测。
EGFR免疫组织化学检测将转染组及野生组A549细胞悬液分别滴到不同载玻片上,37℃、5%CO2的培养箱中培养3 d。培养好的细胞玻片用PBS缓冲液漂洗2 min×3次。4%多聚甲醛室温固定后灭活内源性过氧化物酶,滴加抗EGFR一抗,置于37℃烤箱孵育1 h后向细胞上滴加适量二抗工作液,置于保湿盒内37℃烤箱孵育30 min。避光条件下二氨基联苯胺显色并苏木素复染。显微镜下观察染色及分化程度,最后乙醇脱水及封片。
细胞计数试剂盒-8法检测A549细胞的抑制率将野生组A549细胞及转染组A549细胞分别按50个/μl接种于96孔板,每孔中的液体量为100 μl。37℃,5%CO2培养箱孵育12 h;待其完全附壁后,加入西妥昔单抗 (终浓度0.05 g/L),待药物作用18 h后再加入1 250 个/μl的 NKTm 细胞100 μl(效靶比为25∶1)。继续培养4 h后每孔加入细胞计数试剂盒-8试剂10 μl,2 h后用酶标仪 (测定波长450 nm)测定每孔光密度 (optical density,OD)值,最后结果取均值,以未处理组作为对照组,重复3次。
抑制率的计算西妥昔单抗对肿瘤细胞抑制率=1-(西妥昔单抗组OD值/靶细胞对照组OD值)×100%;联合作用对肿瘤细胞抑制率=[靶细胞对照组OD值-(联合作用组OD值-NKTm细胞对照组OD值)] /靶细胞对照组OD值×100%;NKTm细胞对肿瘤细胞抑制率=[靶细胞对照组OD值-(NKTm细胞组OD值-NKTm细胞对照组OD值)]/靶细胞对照组OD值×100%。
统计学处理采用SPSS 15.0统计软件,计量资料以±s表示,组间差异采用秩和检验分析方法,P<0.05为差异具有统计学意义。
结 果
转染后EGFR蛋白表达情况应用核转染技术将pEGFR-EGFP质粒转染到A549细胞后,荧光显微镜下可见转染后细胞呈现绿色荧光,流式细胞仪测得转染率为22.3%。免疫组织化学结果显示,野生组的A549细胞EGFR表达呈弱阳性 (1+),转染后的A549细胞EGFR表达呈强阳性 (3+),且多为膜阳性(图1)。
EGFR表达水平对ADCC作用的影响分别以野生组的A549细胞和转染后高表达EGFR分子的A549细胞作为靶细胞,西妥昔单抗联合NKTm细胞以及单独西妥昔单抗、单独NKTm细胞分别对靶细胞进行杀伤作用,结果显示西妥昔单抗介导NKTm细胞对转染后高表达EGFR的A549细胞的抑制率显著高于野生组 (52.74 ±6.30 比 41.76 ±3.45,P <0.05),而西妥昔单抗单药及NKTm细胞单独作用对EGFR表达水平不同的A549细胞的抑制率差异无统计学意义 (P>0.05)(表 1)。
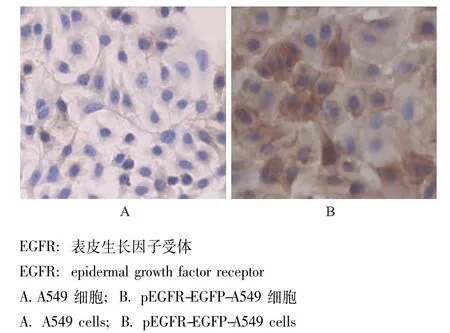
图1 EGFR免疫组织化学染色结果 (×20)Fig 1 Immunohistochemical staining for EGFR expression(×20)
表1 西妥昔单抗介导抗体依赖的细胞介导的细胞毒作用对不同A549细胞的抑制率 (±s,%)Table 1 Inhibition rate of antibody-dependent cell-mediated cytotoxicity activity mediated by cetuximab on different A549 cells(x- ± s,%)

表1 西妥昔单抗介导抗体依赖的细胞介导的细胞毒作用对不同A549细胞的抑制率 (±s,%)Table 1 Inhibition rate of antibody-dependent cell-mediated cytotoxicity activity mediated by cetuximab on different A549 cells(x- ± s,%)
与 A549细胞比较,aP<0.05aP <0.05 compared with A549 cell
分组Group A549 pEGFR-EGFP-A549西妥昔单抗Cetuximab 16.11 ± 1.83 17.68 ±0.92 NKTm 细胞 NKTm cell 21.71 ±2.95 20.64 ±5.21西妥昔单抗+NKTm细胞Cetuximab+NKTm cell 41.76 ± 3.45 52.74 ±6.30a
讨 论
一项Ⅲ期临床研究结果表明西妥昔单抗联合化疗一线治疗晚期非小细胞肺癌可以显著延长患者的中位生存期 (11.3个月比10.1个月) 与1年生存率 (47%比42%)[3]。FLEX试验是第1个证明EGFR抑制剂靶向药物与化疗联用可以延长生存的临床研究。然而,与结直肠癌治疗中研究结果不同的是,西妥昔单抗在非小细胞肺癌的治疗中缺乏有效的疗效预测指标,研究表明K-ras基因突变、EGFR基因突变、EGFR基因扩增、与细胞骨架蛋白同源的第10号染色体缺失的磷酸酶基因表达情况均与西妥昔单抗治疗非小细胞肺癌的疗效无关[7-8]。直到第14届世界肺癌大会,Pirker等[4]报道一项新的数据分析显示,EGFR免疫组织化学评分为高表达组,联合西妥昔单抗治疗的有效率及生存期显著高于单纯化疗,因此认为EGFR表达水平对西妥昔单抗联合化疗的生存期可能有预测作用,但尚缺乏前瞻性的研究加以证实。
西妥昔单抗除了可以与EGFR特异结合并阻断下游信号的传导外,还可以激活ADCC作用[1],然而西妥昔单抗激活ADCC作用首先与肿瘤细胞表面EGFR结合,因此EGFR表达水平可能影响西妥昔单抗诱导的ADCC效应从而影响其对非小细胞肺癌的疗效。为了证实这个假设,本研究选择A549细胞作为靶细胞,进行西妥昔单抗诱导ADCC作用杀伤非小细胞肺癌的体外研究。首先将A549细胞转染EGFR基因,使转染后的A549细胞高表达EGFR分子,之后检测西妥昔单抗介导ADCC作用以及单独西妥昔单抗对A549细胞转染组与对照组的抑制率。研究中效应细胞NKTm细胞是以CD3+、CD8+、CD56+和CD16+细胞为主要效应细胞的混合淋巴细胞,已在临床中广泛用于过继性细胞免疫治疗[9]。本研究显示西妥昔单抗介导的ADCC作用对高表达EGFR的A549细胞的抑制率显著高于EGFR低表达组,差异具有统计学意义,而西妥昔单抗单独作用于两组的抑制率差异却无统计学意义。因此,西妥昔单抗可能通过介导ADCC作用而对EGFR高表达的患者具有更好的疗效。但Kurai等[1]认为肺癌细胞较低水平的EGFR表达已足够产生西妥昔单抗介导的最大的ADCC活性,EGFR表达水平的进一步增加,对ADCC活性无相应的影响。分析结果不同的原因可能为Kurai等[1]采用具有EGFR表达差异的不同肺癌细胞系作为靶细胞,而本研究采用的是具有EGFR表达差异的同一肺癌细胞系,这样可避免因不同肿瘤细胞系间的其他潜在干扰因素而非EGFR蛋白表达水平对ADCC活性的影响。此外,效应细胞的活性、效靶比的不同也影响着实验结果,因此,尚需要进一步的研究以及临床试验进行验证。
本研究结果提示西妥昔单抗介导的ADCC作用对EGFR蛋白高表达的肺腺癌A549细胞具有更强的杀伤作用,这提示可能正是因为西妥昔单抗介导的ADCC作用在非小细胞肺癌的治疗中发挥重要作用,因此高表达EGFR的肿瘤患者在接受西妥昔单抗联合化疗治疗后能够获得更好的疗效。本研究从细胞水平证实了Pirker等[4]的研究结果。因此,在西妥昔单抗的临床应用中或许应该增加对患者免疫状态的关注,如果能够提高患者的细胞免疫功能可能会达到更好的疗效,此外患者的免疫状态的相关指标是否可以作为西妥昔单抗疗效预测因子也可以进一步探讨。
[1]Kurai J,Chikumi H,Hashimoto K,et al.Antibody-dependent cellular cytotoxicity mediated by cetuximab against lung cancer cell lines [J].Clin Cancer Res,2007,13(5):1552-1561.
[2]Lynch TJ,Patel T,Dreisbach L,et al.Cetuximab and firstline taxane/carboplatin chemotherapy in advanced non-smallcell lung cancer:results of the randomized multicenter phaseⅢ trial BMS099 [J].J Clin Oncol,2010,28(6):911-917.
[3]Pirker R,Szczensna A,von Pawel J,et al.FlEX:a randomized,multicenter,phaseⅢ study of cetuximab in combination with cisplatin/vinorelbine(cv)versus CV alone in the first-line treatment of patients with advanced non small cell lung cancer(NSCLC)[J] .J Clin Oncol,2008,26(15s):6s.
[4]Pirker R,Pereira JR,von Pawel J,et al.EGFR expression as a predictor of survival for first-line chemotherapy plus cetuximab in patients with advanced non-small-cell lung cancer:analysis of data from the phase 3 FLEX study[J].Lancet Oncol,2012,13(1):33-42.
[5]Pirker R,Pereira JR,Szczesna A,et al.Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer(FLEX):an open-label randomised phaseⅢ trial[J].Lancet,2009,373(9674):1525-1531.
[6]张国庆,焦顺昌,林星石,等.恶性肿瘤患者外周血淋巴细胞体外扩增后亚群的变化[J].军医进修学院学报,2008,29(3):184-186.
[7]O’byrne KJ,Gatzemeier U,Bondarenko I,et al.Molecular biomarkers in non-small-cell lung cancer:a retrospective analysis of data from the phase 3 FLEX study[J].Lancet Oncol,2011,12(8):795-805.
[8]Khambata-Ford S,Harbison CT,Hart LL,et al.Analysis of potential predictive markers of cetuximab benefit in BMS099,a phaseⅢstudy of cetuximab and first-line taxane/carboplatin in advanced non-small-cell lung cancer [J].J Clin Oncol,2010,28(6):918-927.
[9] 焦顺昌,张国庆,林星石,等.自体NK、T混合淋巴细胞扩增后回输对肿瘤免疫的影响 [J].军医进修学院学报,2008,29(5):343-345.
Role of Epidermal Growth Factor Receptor Expression Level in Cetuximab Cytotoxicity and Antibody-dependent Cell-mediated Cytotoxicity Effect Against A549 Lung Cancer Cell Line
LI Jin-yu,JIAO Shun-chang,ZHANG Guo-qing,SUN Sheng-jie
Department of Medical Oncology,Chinese PLA General Hospital,Beijing 100853,China
JIAO Shun-chang Tel:13811331264,E-mail:lijinyu301@sina.com
ObjectiveTo investigate the role of epidermal growth factor receptor(EGFR)expression level in cetuximab cytotoxicity and antibody-dependent cell-mediated cytotoxicity(ADCC)effect against A549 lung cancer cell line.MethodsA549 cell line and NKTm cells were used as the target cell and the effector cell,respectively.pEGFR-EGFP plasmids were transfected into A549 cells by nucleofector method.EGFR expression levels were measured by immunohistochemistry.The ADCC activity induced by cetuximab was assessed by cell counting kit-8 assay.ResultsA549 cells transfected with pEGFR-EGFP plasmids expressed higher level of EGFR protein on membrane and were more sensitive to ADCC activity mediated by cetuximab(P <0.05) .The inhibition rate of A549 cells showed no significant difference between transfection group and wild-type group when treated with cetuximab alone(P> 0.05) .Conclusion EGFR expression level influences the sensitivity of A549 lung cancer cell line to ADCC activity mediated by cetuximab but not to cetuximab alone.
book=47,ebook=53
cetuximab;non-small cell lung cancer;epidermal growth factor receptor
焦顺昌 电话:13811331264,电子邮件:lijinyu301@sina.com
R735.5
A
1000-503X(2014)02-0164-04
10.3881/j.issn.1000-503X.2014.02.009
2013-06-17)
·论 著·

