高住低练对大鼠骨髓促红细胞生成素受体蛋白表达的影响
, ,
(湖南第一师范学院 体育系,湖南 长沙 410012)
高住低练对大鼠骨髓促红细胞生成素受体蛋白表达的影响
曹蕾,郑澜,皮亦华
(湖南第一师范学院 体育系,湖南 长沙 410012)
研究目的:探讨高住低练对大鼠骨髓细胞促红细胞生成素受体(Erythropoietin receptor, EpoR)蛋白表达的不同作用。研究方法:本研究将健康雄性SD大鼠56只随机分为7组,采用免疫组织化学及计算机显微图像分析,检测EpoR在骨髓组织中的含量,分析运动和低氧2种不同的处理因素对骨髓EpoR蛋白表达的效应。研究结果:高住低练和低住低练都可使EpoR蛋白表达增加。高住低练中随着训练时间的延长,EpoR增加更明显。结论:随着低氧和训练因素的影响,EpoR蛋白有逐渐上升的趋势,模拟高住低练能使EpoR蛋白表达加快。
高住低练;促红细胞生成素受体蛋白;免疫组织化学
促红细胞生成素(Erythropoietin, Epo)和促红细胞生成素受体(Erythropoietin receptor, EpoR)与运动训练关系的研究是从研究高原训练开始的。而在对高原训练的研究中发现在诸多影响运动成绩的因素里,缺氧对机体的刺激造成红细胞和血红蛋白的增加是最主要的因素。事实证明高住低练的训练模式与高原训练一样也可以明显地提高运动员的成绩[1],而且由于低海拔高氧含量的训练可以上强度,高住低练的方法甚至优于传统的高原训练。许多研究认为这是由于这种训练方法能通过身体缺氧刺激改变血浆Epo的量,Epo与其受体EpoR结合后发挥生物效力,使外周血中红细胞数和血红蛋白含量升高,从而提高最大吸氧量,但近年来的对血浆中Epo的研究并未取得一致结果,因此,我们试图通过探明EpoR蛋白表达的规律来证实高住低练与红系细胞的关系,本研究就以高住低练的训练方式来研究在不同低氧时间和递增运动强度下EpoR蛋白表达的变化,进一步明确EpoR在低氧训练中对红系细胞生成的影响机制,为运动实验提供依据。
1 研究对象与方法
1.1 实验对象

表1 本研究大鼠分组情况
健康雄性2.0月龄Sprague-Dawley大鼠56只,体重约200g(由中南大学湘雅医学院动物学部提供)。用国家标准啮齿类动物饲料饲养,生活期间室温保持20~23 ℃,相对湿度45~55%,每天光照12 h。适应性喂养一周后,随机分为7组,每组8只(表1)
1.2 实验内容
1.2.1 训练方案
采用杭州立泰科技有限公司PT动物实验跑台训练,共13天,每天一次,运动强度依据Bedford所建立的运动负荷模型[2],训练时间为每晚18:00~22:00,详细训练方案见表2。

表2 训练方案(速度×时间)
1.2.2 低氧安排
采用美国Hypoxico公司的低氧装置,用美国产TOXIRAE PGM-36型氧气监测仪实时监测低氧舱中氧含量的变化,并向低氧舱中充入纯氮气以保持氧分压为11.3 kPa,每天训练后即刻置于低氧舱中6h[3-4]。
1.3 标本制备
运动训练方案结束后,将实验大鼠用25%乌拉坦1ml/100g体重麻醉,75%酒精浸泡消毒后取材。后将大鼠呈仰卧位固定于手术台上,取双侧股骨切断,取骨髓,涂于明胶处理的玻片上,4%多聚甲醛固定15 min,用0.01%PBS反复冲洗,置于4 ℃冰箱备用。
1.4 测试方法
1.4.1 免疫组织化学方法
免疫组化一抗由SANTACRUZE公司提供,所用工作浓度为1:200,SABC、DAB试剂盒及苏木素由武汉博士德公司提供即用型。
1.4.2 计算机图像分析
用美国Imager-pro图像分析系统。EpoR的表达用阳性单位表示,公式为

1.5 统计分析
2 实验结果
2.1 鼠骨髓免疫组化及计算机图像分析
2.1.1 免疫组化观察结果
使用免疫组化ABC法对大鼠骨髓EpoR进行标记,EpoR定位于细胞膜上,呈圆球状颗粒,弥散分布。对阳性单位进行统计分析发现在运动时间和强度递增,低氧时间延长的情况下EpoR的表达也随之上升,但是运动组即使是常氧运动13天组,其表达的水平仍低于加了低氧因素的3天组。用肉眼观察到的图片也可以发现,运动低氧组的EpoR蛋白表达相比相同训练常氧组的要多(见图1):
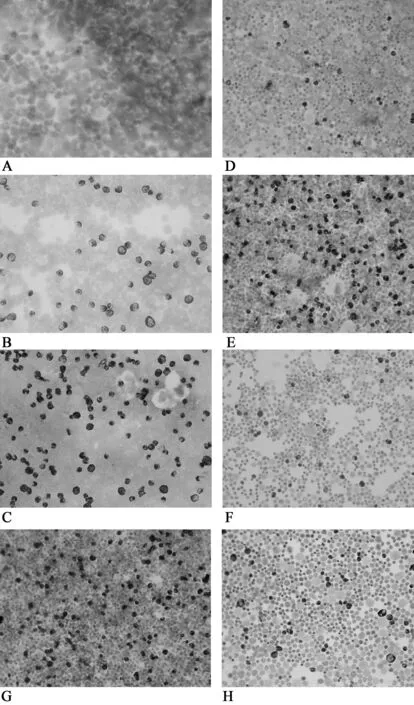
图1 骨髓细胞免疫组织化学染色
A.未加一抗的阴性对照片。×40
B.对照组可见少量表达EpoR的细胞(棕色)。×40
C.第2组训练低氧3天组,可见较多表达EpoR的细胞。×40
D.第3组训练3天组。×40
E.第4组训练低氧6天组。×40
F.第5组训练6天组。×40
G.第6组训练低氧13天组,可见许多表达EpoR的细胞。×40
H.第7组训练13天组。×40
2.1.2 计算机显微图像分析结果
表3列出了计算机显微图像分析得到的阳性单位灰度值。从图2中可以看出,运动和低氧与对照组相比较,低住低练组和高住低练组的EPOR蛋白表达都上升,但运动3天组的相对对照组来说无统计学意义;在运动组的对比中,运动3天、6天和13天组之间逐渐上升,差异具有显著性;在高住低练的各组中,高住低练3天组与高住低练6天组之间EpoR蛋白表达的上升差异无统计学意义,运动低氧13天组EpoR的表达与其它两个低氧组相比显著升高。高住低练组大鼠骨髓EpoR蛋白表达显著高于低住低练组。
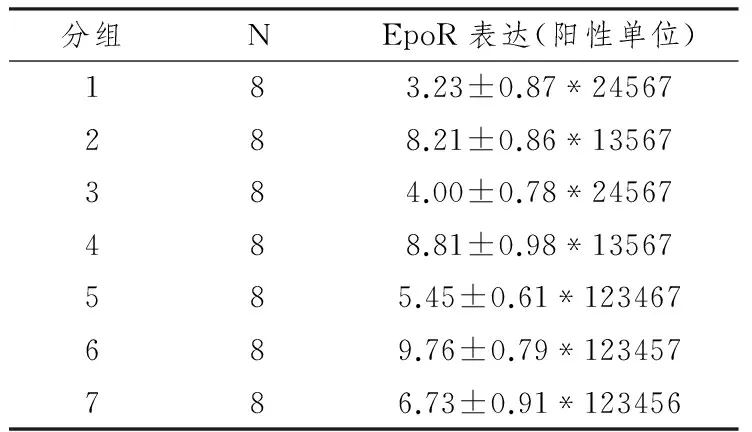
表3 EpoR蛋白表达免疫组化涂片计算机显微图像分析(阳性单位)

图2 大鼠骨髓EpoR蛋白表达动态变化
3 分析与讨论
EpoR是一种跨膜蛋白质,62KD,由507个氨基酸组成,人与鼠有82%的同源性,其结构可分为三部分:胞膜外部分,跨膜区域,胞内区部分[6]。能表达EpoR的细胞主要为:红系干细胞、巨核细胞的干细胞,另外多种神经细胞亦可表达EpoR。促红细胞生成素(erythropoietin,Epo)的主要靶细胞就是红细胞系集落形成细胞(CFU-E),因而CFU-E具有促红细胞生成素受体(EpoR)量最多。但其他一些细胞也有EpoR的存在如白血病细胞[9]。EpoR的数目与该细胞对Epo依赖性大小有关。有人证实,所有的CFU-E细胞上均有EpoR,而只有20%的FUE细胞上有EpoR。当红系细胞逐渐成熟,对Epo的依赖性下降,受体逐渐丧失,到成红细胞阶段只有很少的EpoR不再依赖Epo。
EpoR的表达受多种因素的影响,Grossi等进行体外细胞培养发现重组人红细胞生成素(Recombinant Hunan Erythropoietin,rhEpo)能促进红白血病细胞EpoR的表达[8]。近年大量研究发现缺氧可以诱导大脑中EpoR mRNA表达。Spandou等的动物实验发现持续结扎大鼠一侧颈动脉,24 h后脑组织中EpoR mRNA表达显著提高,提示在缺血缺氧条件下Epo/EpoR系统对神经细胞起着重要的保护作用[9]。Sun等人的实验也支持这一观点[10]。Yu X的动物实验发现,在鼠胚胎脑神经原中,缺氧能使EpoR表达增长10倍[11]。有文献报道缺氧是Epo产生的强有力刺激因子,也能刺激EpoR在组织中的表达[12]。还有研究证明在肿瘤中EpoR的表达与肿瘤的大小以及内部的缺氧程度有关[13],Ge RL在海拔1780米、2085米、2454米及2800米高度检测安静人群的肾脏供氧情况和血液中Epo的含量,发现进入高原6小时后Epo就开始增加,同时尿的氧分压呈下降趋势。在较低的两个高度(1780米和2085米)上,24小时后尿氧分压回到了原来的值,但在其它两个高度上则是持续降低,Epo在2454米的高度上则与尿氧分压有相反的表现。证明了Epo上升的海拔高度为2100~2500米,人体在1780和2085米海拔经过短期环境适应之后就可以恢复肾组织的供氧,但在相对较高海拔却可以引起持续的增长[14]。Beleslin- Cokic等发现Epo可以刺激内皮细胞EpoR的增殖和生成[15]。另外,HIF-1等因子也可以诱导EpoR的生成[16]。从而进一步地验证了高原的缺氧环境对EpoR表达可能产生的影响。
国内外有关运动对骨髓EpoR蛋白表达的研究报道并不多见,有研究认为运动产生的热量可使大鼠在颅脑损伤等应激状态下快速表达较多的EpoR[17],说明运动本身就可以提高EpoR的表达。以上所有这些研究都是在安静状态下进行的。赵杰修等在运动性贫血的研究中发现运动性贫血大鼠骨髓中EpoR的mRNA表达显著低于安静对照组和运动加营养组[18]。至今尚未见到有关低氧训练对骨髓EpoR蛋白生成的影响的报道。
本研究采用免疫组织化学及计算机图像分析系统对EpoR蛋白表达进行半定量分析,结果显示运动和低氧都能够使骨髓细胞EpoR蛋白表达逐渐增加,高住低练组大鼠骨髓细胞EpoR蛋白表达水平明显高于低住不练组和低住低练组,表达的最高峰出现在低氧运动13天组,说明高住低练能促进大鼠骨髓细胞EpoR蛋白的表达,并且随着运动和低氧时间的延长对EpoR蛋白表达有累积作用。在运动训练3天组与安静对照组之间差异无统计学意义,这可能说明3天的运动训练不能影响骨髓细胞EpoR蛋白表达。这是否意味着低氧训练可以使EpoR蛋白表达的增加提前出现,并且出现更高的峰值;在峰值出现之后是否会出现下降或维持特定水平,还有待进一步的研究。
4 结论
4.1 骨髓EpoR蛋白表达随着低氧和训练因素的影响,EpoR蛋白表达有逐渐上升的趋势,模拟高住低练能使EpoR蛋白表达加快。
4.2 模拟高住低练实验13天的实验中,EpoR蛋白表达随时间延长而得到积累,在实验中没有峰值的出现。
[1]翁庆章,钟伯光.高原训练的理论与实践[M].北京:人民体育出版社,2002.
[2]Bedford TG,Tipton CM,Wilson NC.etal.Maximum oxygen consumption of rats and its changes with various experimental procedures [J].Appl Physiol,1979,47(6):1278-1283.
[3]Levine BD.“Living high-training low”: effect of moderate-altitude acclimatization with low-altitude training on performance[J]. Journal of Applied Physiology, 1997,83(1):102-112.
[4]郑澜,陆爱云,周志宏.低氧运动大鼠血清血管内皮生长因子与动脉血氧分压的相关研究[J].体育科学,2004,(7):29-31.
[5]申洪.免疫组织化学染色定量方法研究(Ⅲ) [J].中国组织化学与细胞化学杂志,1995,(1):89-92.
[6]Simon S,Jones,Alan D,etal. Human Erythropoietin Receptor: Cloning, Expression, and Biologic Characterization [J].Blood,1990,76(1):31-35.
[7]樊华,李霞,等.急性白血病细胞促红细胞生成素受体的表达 [J].中国医科大学学报,1999,28(06):76.
[8]Grossi A, Vannucchi A M,etal.Erythropoietin upregulates the expression of its own receptor in IF-1 cell line [J]. Leuk Res,1998,22 (2):145-151.
[9]Spandon E,Papoutsopoulou S,Soubasi V,etal.Hypoxia-ischemia affects erythropoietin and erythropoietin receptor expression pattern in the neonatal rat brain [J].Brain Res,2004,24(9):167-172.
[10]Sun Y,Zhou C,Polk P,etal.Mechanisms of erythropoietin-induced brain protection in neonatal hypoxia-ischemia rat model [J].Cereb Blood Flow Metab,2004,24(2):259-270.
[11]Yu X,Shacka JJ,etal.Erythropoietin receptor signaling is required for normal brain development [J].Development,2002,129(2):505-516.
[12]Ikegaya N,Yamamoto T,Takeshita A,etal.Elevated erythropoitin receptor and transforming growth factor-betal expression in stenotic fistulae used for hemodialysis[J].JAM SOC Nephrol,2000,11(5):928-935.
[13]Pollio F, Staibano S, Mansueto G,etal.Erythropoietin and erythropoietin receptor system in a large uterine myoma of a patient with myomatous erythrocytosis syndrome: possible relationship with the pathogenesis of unusual tumor size[J].Hum Pathol,2005,36(1):120-127.
[14]Ge RL,etal.Determinants of erythropoietin release in response to short-term hypobaric hypoxia[J].Appl Physiol,2002,92(6):2361-7.
[15]Beleslin-Cokic BB, Cokic VP,etal.Erythropoietin and hypoxia stimulate erythropoietin receptor and nitric oxide production by endothelial cells[J].Blood,2004,104(7):2073-80.
[16]Isaac DD,Andrew DJ.Tubulogenesis in drosophila: a requirement for the trachealess gene product[J].Genes Dev,1996,10(1):103-117.
[17]Shein NA, Horowitz M, Alexandrovich AG,etal.Heat acclimation increases hypoxia-inducible factor 1alpha and erythropoietin receptor expression: implication for neuroprotection after closed head injury in mice [J].Cereb Blood Flow Metab,2005,18:25.
[18]赵杰修,田野.运动性贫血的机理和防治研究[D]//北京:北京体育大学,2003.
Influence of living high and training low on erythropoietin receptor of rat bone marrow
CAO Lei, ZHENG Lan, PI Yi-hua
(1.College of Physical Education, Human Normal University, Changsha 410012, Hunan,China;2. Hunan Institute of Sport Science, Changsha, China)
Objective:To explore the effect of different training pattern and hypoxic stimulus on protein expression of hypoxia induced erythropoietin receptor on bone marrow.Methods:56 male SD rats were randomly divided into 7 groups. Immunohistochemical technology and computer image processing method were applied to exam the content of erythropoietin receptor on bone marrow, and the effect of hypoxia and training on rat bone marrow erythropoietin receptor were analyzed.Results:Erythropoietin of bone marrow was increased in both high-altitude living but low-altitude training group and low-altitude living and low-altitude training group.With the extending of training time, the increase of erythropoietin receptor was obvious.Conclusion:Living-high training-low could increase the protein expression of erythropoietin receptor.
living-high training-low; erythropoietin receptor; immunohistochemistry; bone marrow
2014-02-25
曹蕾(1980- ),女,湖南人,讲师,硕士,研究方向运动人体科学。
A
1009-9840(2014)06-0072-04

