生鲜猪肉中致病性球菌的双重PCR检测方法的建立与应用
李英英, 邵刘云, 刘 肖, 张秀方, 胡 慧, 王亚宾, 陈丽颖
(河南农业大学牧医工程学院,河南 郑州 450002)
生鲜猪肉中致病性球菌的双重PCR检测方法的建立与应用
李英英, 邵刘云, 刘 肖, 张秀方, 胡 慧, 王亚宾, 陈丽颖
(河南农业大学牧医工程学院,河南 郑州 450002)
以金黄色葡萄球菌clfa基因和溶血性链球菌sdy基因为靶基因设计引物.通过对单个基因PCR和多重基因 PCR扩增进行特异性、敏感性试验以及优化反应体系,建立了快速检测溶血性链球菌和金黄色葡萄球菌的双重PCR方法.在郑州市不同地区随机抽检126份生鲜猪肉样品,分别进行了双重PCR检测和常规微生物学检验.结果表明,建立的双重PCR方法特异性好,抗干扰能力强,灵敏度可达到102ng·L-1.在126个样品中检测出溶血性链球菌的样品数为7份,检出率为5.55%;检出金黄色葡萄球菌阳性的样品数为8份,检出率为 6.35%.
金黄色葡萄球菌;溶血性链球菌;猪肉;双重PCR;检测
近年来,随着经济全球化进程加快,食品安全已经成为当今世界性公共卫生热点.引起食源性疾病的首要因素是食源性致病菌,其多数暴发案例是通过致病性细菌污染食品而引起的[1].其中,溶血性链球菌(Streptococcushemolyticus)和金黄色葡萄球菌(Staphylococcusaureus)是2种重要的致病性球菌,且以金黄色葡萄球菌对肉与肉制品的污染最为严重[2].猪肉作为中国消费量最大的肉类食品,也是溶血性链球菌和金黄色葡萄球菌污染的高危畜产品,因此对其进行致病性球菌检测具有重要的食品卫生学意义.目前,对肉类食品中致病菌的检测主要使用以核酸和蛋白质为核心的技术,如PCR以及衍生技术[3]、生物芯片[4]、酶联免疫技术[5]、ATP荧光技术[6]等,这些技术和传统技术相比具有很多技术上的优势,但同时其强操作性、大成本、高费用、多设备等问题,使得这些方法在实际生产中并不能大批量的推广,并且由于大多检测菌种单一,技术优势很难惠及生鲜猪肉的工业化生产中,使得目前在一线生产中缺少实用且同时能检测多种致病菌的方法.在生鲜猪肉的实际生产中,不同的加工程序均可能受到致病菌的污染,要确保食品安全必须对生鲜猪肉的最终产品进行残存菌的检测.目前一种基于引物DNA序列特异性的多重 PCR 技术能够在同一反应体系中快速、准确同时检测多种病原菌,具有很高的应用前景[7].本研究以溶血性链球菌和金黄色葡萄球菌的特异性基因sdy,clfa为研究对象,在确定方法特异性和抗干扰能力的基础上,用优化后的反应体系建立了一种快速、灵敏且特异性强的双重PCR方法,实现了对猪肉中这2种致病菌的同时检测.
1 材料与方法
1.1材料
1.1.1 菌株及肉样 金黄色葡萄球菌(Staphyloccusaureus)ATCC25923、溶血性链球菌(Streptococcushemolytics)ATCC21059、产气荚膜杆菌(Bacilusperfringens)13124F0、蜡样芽胞杆菌(BacilusCereus)11778F0、单核细胞增生李斯特菌(Listeriamonocytogenes)19114F0、大肠杆菌(E.coli)、沙门氏菌(Salmonella) 14028F1以及志贺氏菌(Shigella) 12022F1 等标准菌株均由河南农业大学动物微生物学与免疫学实验室保存.126个待检生鲜猪肉样品先后采集自郑州市区6家综合性超市、8家冷鲜肉专卖店和5个农贸市场的生鲜猪肉销售点,每个抽样点抽取样本数不少于5个.
1.1.2 试剂 PCR反应试剂:DL2000 DNA Ladder Marker,Taq PCR Master Mix 均购自上海生工生物工程有限公司;脑心浸萃液态培养基(BHI)购自广东环凯微生物科技有限公司;1×TAE电泳缓冲液、琼脂糖、GoldView、无水乙醇、异丙醇、Ezup柱式细菌基因组DNA抽提试剂盒由上海生工生物工程有限公司提供;核酸回收试剂盒TaKara 购自宝生物工程(大连)有限公司.
1.1.3 仪器 sp-D垂直净化工作台;Eppendorf 离心机;DYCP-31B型电泳槽;DYY-111-6B型电泳仪;PTC-200型PCR仪;AlphalmagerTM2200型凝胶图像分析系统;恒温培养箱;荣华SHA-C水浴恒温振荡器;CF长风数显调节水浴锅,北京市长风仪器公司生产;ZF型紫外透射反射分析仪;78-1型磁力加热搅拌器,江苏省金坛市荣华仪器制造有限公司生产;LX-100手掌型离心机,江苏海门市麒麟医用仪器厂生产;MVS-1旋涡混合器,北京北德科学器材有限公司生产.
1.2方法
1.2.1 PCR引物设计与合成 根据GenBank收录的金黄色葡萄球菌clfa基因和溶血性链球菌sdy基因,应用软件Premier 5.0设计2对引物,其目的扩增片段长度分别为635,309 bp(表1).引物由上海生工生物工程有限公司合成.
1.2.2 样品处理与细菌基因组DNA的提取 将保存的菌种复苏后在BHI营养琼脂平板上划线,37 ℃培养16 h.挑取典型单个菌落接种于BHI液体培养基过夜培养,参照Ezup柱式细菌基因组DNA抽提试剂盒说明[8],分别进行各参考菌株基因组DNA的提取,并以相同方法制备待检肉样菌液混合DNA模板.
样品处理参照食品安全国家标准(GB 4789.10—2010),处理方法如下:称取25 g 样品至盛有 225 mL 7.5 %氯化钠肉汤的无菌均质杯内,8 000~10 000 r·min-1均质1~2 min.然后将处理的样品接种于BHI液体培养基中参照Ezup柱式细菌基因组DNA抽提试剂盒说明提取样品DNA.
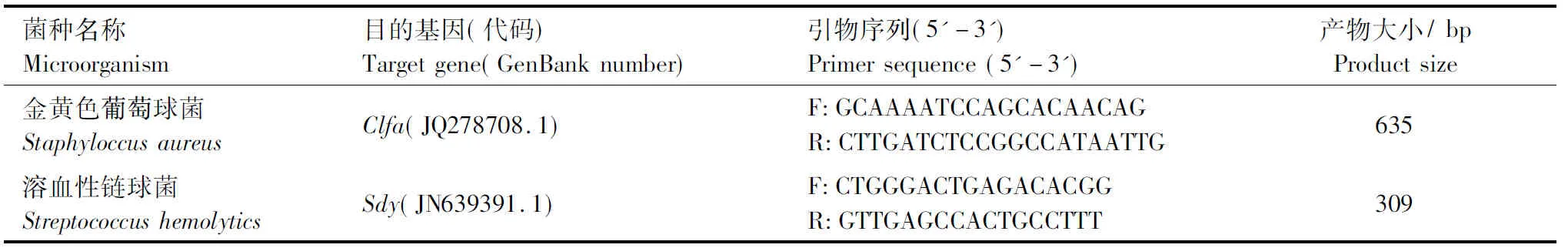
表1 PCR引物序列与目的基因长度Table 1 Double PCR amplification of the target gene sequence
1.2.3 单基因PCR特异性试验 金黄色葡萄球菌clfa基因扩增的反应体系为:模板DNA 2 μL,PCR buffer 2.5 μL,MgCl2( 3 mmol·L-1)1.5 μL,dNTP(400 μmol·L-1) 2 μL,上、下游引物(20 μmol·L-1,)各1 μL,其余用去离子水补足至25 μL.扩增条件:94 ℃预变性5 min,PCR循环为94 ℃变性 45 s,(50,52,54 ℃)退火 40 s,72 ℃ 延伸40 s,34个循环后,72 ℃延伸10 min.溶血性链球菌sdy基因扩增的反应体系同金黄色葡萄球菌clfa基因的扩增体系.扩增条件:94 ℃预变性5 min,PCR循环为94 ℃变性45 s,(49,50,51,52,53,54 ℃)退火 40 s,72 ℃ 延伸40 s,34个循环后,72 ℃延伸10 min.将扩增的目的基因送至上海生工进行测序.
1.2.4 单基因PCR敏感性试验 分别测定金黄色葡萄球菌和溶血性链球菌的DNA模板浓度,稀释成相同质量浓度105ng·L-1后10倍递增稀释10-3~105ng·L-1,按1.2.2所述方法提取DNA,进行PCR扩增,测定单重PCR的敏感性.
1.2.5 双重PCR检测与反应条件优化 以金黄色葡萄球菌和溶血性链球菌混合DNA为模板,对引物、酶等因素进行摸索.根据退火温度比引物Tm低3~5 ℃的原则,选取52,53,54,55,56 ℃等5个温度,在梯度PCR仪上进行最佳退火温度的优化.
1.2.6 双重PCR体系的特异性试验 采用已经建立的双重PCR体系对金黄色葡萄球菌、溶血性链球菌、产气荚膜杆菌、蜡样芽胞杆菌、单增李斯特菌、大肠杆菌、沙门氏菌及志贺氏菌的混合DNA和去离子水进行双重PCR扩增,以检测引物和反应的特异性.
1.2.7 双重PCR体系的敏感性试验 把金黄色葡萄球菌和溶血性链球菌基因组DNA模板混合,按1.2.5方法进行双重PCR扩增,测定双重PCR扩增的敏感性.
1.2.8 生鲜猪肉中致病性球菌的双重PCR检测与分析 从郑州多家综合型超市、冷鲜肉专卖店及农贸市场等不同地方采集新鲜猪肉样品,分别营养肉汤中增菌培养,提取细菌基因组DNA并进行PCR检测.
2 结果与分析
2.1单基因PCR特异性和核苷酸序列分析
经PCR检测,针对溶血性链球菌标准菌株sdy基因扩增出大小约为309 bp 的特异性片段,而对金黄色葡萄球菌clfa基因的PCR产物大小约为635 bp.上述PCR产物经测序分析,与GenBank中公布的基因序列同源性均达到99%以上,说明所扩增条带就是预期的目的基因片段.试验表明,上述2对引物在50~54 ℃之间都能扩增出特异性目的片段,这为双重PCR方法的建立奠定了基础(图1、图2).敏感性分析表明,对溶血性链球菌灵敏度达到10 ng·L-1,对金黄色葡萄球菌灵敏度为102ng·L-1.
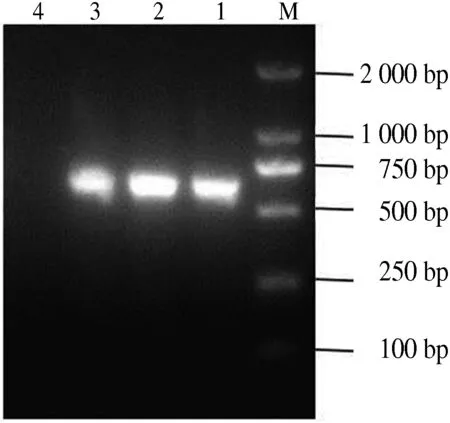
M.DL2000 DNA Marker;1.50 ℃;2.52 ℃;3.54 ℃;4.阴性对照.
M.DL2000 DNA Marker;1.50 ℃;2.52 ℃;3.54 ℃;4.Negative control.
图1金黄色葡萄球菌的PCR扩增结果
Fig.1ResultofHemolyticstreptococcusPCRamplification
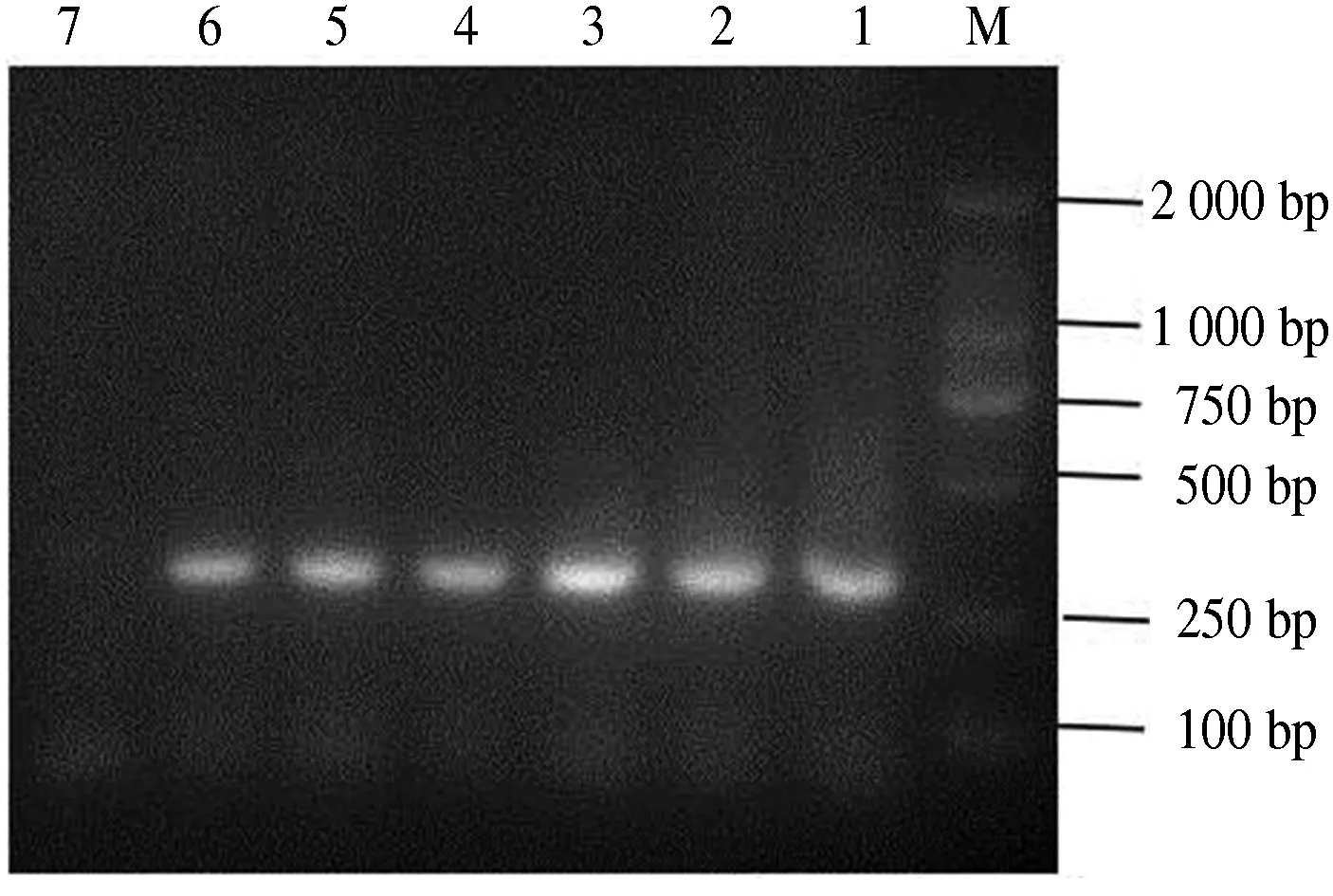
M.DL2000 DNA Marker;1.49 ℃;2.50 ℃;3.51 ℃;4.52 ℃;5.53 ℃;6.54 ℃;7.阴性对照.
M.DL2000 DNA Marker;1.49 ℃;2.50 ℃;3.51 ℃;4.52 ℃;5.53 ℃;6.54 ℃;7.Negative control.
图2溶血性链球菌的PCR扩增结果
Fig.2ResultofStreptococcushemolyticusPCRamplification
2.2双重PCR的扩增及条件优化
温度梯度PCR试验显示,在52 ℃时引物之间的相互竞争和相互影响最小,扩增效果最佳.因此,该双重PCR体系的退火温度选为52 ℃(图3).
经一系列试验摸索,最终确定双重PCR最佳反应体系为:Taq PCR Master Mix,12 μL;2种菌的上游引物各1 μL;2种菌的下游引物各1 μL;模板DNA,2 μL;ddH2O,7 μL;总体积25 μL.其反应条件为:94 ℃预变性5 min,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸40 s,共进行34个循环,最后72 ℃终延伸10 min.
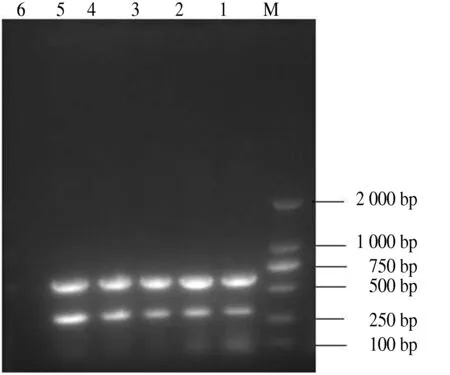
M.DL2000 DNA Marker;1.56 ℃;2.55 ℃;3.54 ℃;4.53 ℃;5.52 ℃;6.阴性对照.
M.DL2000 DNA Marker;1.56 ℃;2.55 ℃;3.54 ℃;4.53 ℃;5.52 ℃;6.Negative control.
图3退火温度的优化
Fig.3Optimizationoftheannealingtemperature
2.3多重PCR的特异性检测结果
应用该体系对8个受试菌株的混合DNA模板进行PCR扩增(图4),仅在金黄色葡萄球菌和溶血性链球菌相应基因位置上出现特异性目的条带,而对其他6种细菌未出现非特异性扩增.
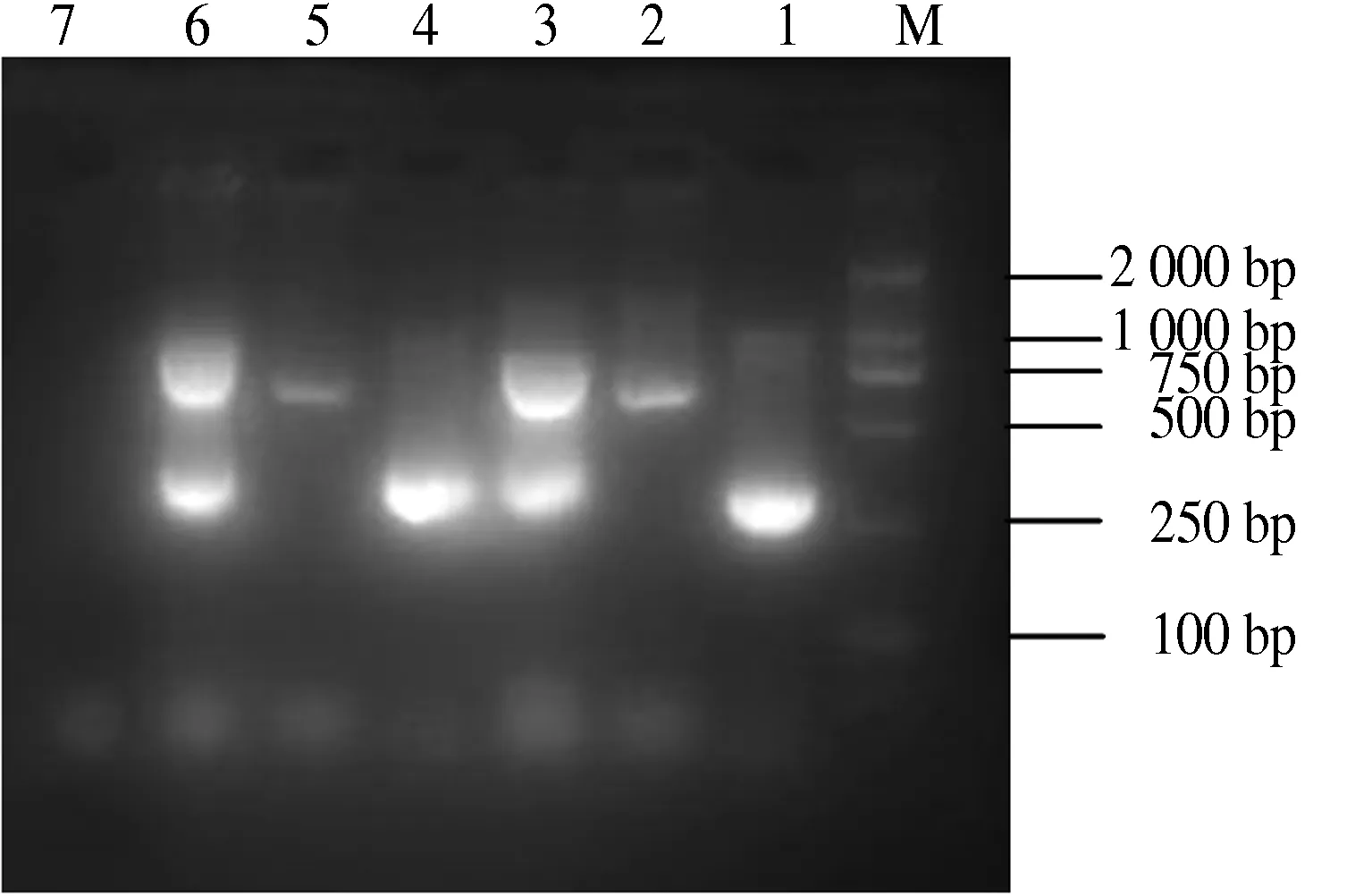
M.DL2000 DNA Marker;1.溶血性链球菌;2.金黄色葡萄球菌;3.溶血性链球菌、金黄色葡萄球菌;4~6.金黄色葡萄球菌、溶血性链球菌、产气荚膜杆菌、蜡样芽胞杆菌、单增李斯特杆菌、大肠杆菌、沙门氏菌、志贺氏菌混DNA;7.阴性对照.
M.DL2000 DNA Marker;1.Hemolyticstreptococcus;2.Staphylococcusaureus;3.Hemolyticstreptococcus、Staphylococcusaureus;4~6.Staphylococcusaureus,Hemolyticstreptococcus.Clostrdiumperfringens,Bacilluscereus,ListeriaLesterbacillus,Escherichiacoli,Salmonella,Shigellamixed DNA.
图4双重PCR特异性检测结果
Fig.4ResultofthespecifitydetectingbyduplexPCR
2.4双重PCR的敏感性试验
在优化的PCR反应条件下,该双重PCR对金黄色葡萄球菌、溶血性链球菌的检测灵敏性达到102ng·L-1(图5).

M.DL2000 DNA Marker;1~8.DNA模板依次10倍稀释;9.阴性对照.
M.DL2000 DNA Marker;1~8.The DNA template is 10 times of dilution; 9.Negative control.
图5双重PCR敏感性检测
Fig.5SensitivityofduplexPCR
2.5应用双重PCR检测肉样的结果
对126份生鲜猪肉中致病性球菌的双重PCR检测结果分别如图6和表2所示.
M.DL2000 DNA Marker,1~8.样品;9.阴性对照.
M.DL2000 DNA Marker,1~8.Sample;9.Negative control.
图68份生鲜猪肉样品的PCR检测
Fig.6PCRdetectionof8samplesofrawpork
经PCR检测,126份生鲜猪肉样品中,金黄色葡萄球菌阳性样品8份,检出率为6.35%;溶血性链球菌阳性样品7份,检出率为5.55%;金黄色葡萄球菌和溶血性链球菌同时检出的有3份(2.38%).
3 讨论
食品安全与人们的生活息息相关.近些年来,随着科技的不断进步,各种单一的食源性致病菌PCR快速检测方法被大量建立起来,如沙门氏菌[9]、金黄色葡萄球菌[10]、链球菌[11]、大肠杆菌O157[12]、单核细胞增生性李斯特氏菌[13]等病原微生物的检测.但这些方法都只能对食品中单一的致病菌进行检测,而现实生活中食品往往同时存在多种致病菌,致使食品安全的实际监测面临样本量大、时间紧急、人员不足等一系列问题.单一的病原微生物PCR的检测已越来越不能满足不断发展的需求.所以近些年在单重PCR的基础上建立起的多重PCR技术引起广泛重视并已有了很大的进展,赵新等[14]根据沙门氏菌侵袭力蛋白A基因(invA)、单核细胞增生李斯特菌蛋白转录调控基因(prfA)、金黄色葡萄球菌自溶素基因(alt)、蜡样芽孢杆菌的促旋酶B亚单位基因(gyrB)设计引物,进行多重PCR扩增,建立了4种致病菌的多重PCR检测体系.王娜等[15]根据副溶血性弧菌的耐热直接溶血素基因(tdh)、金黄色葡萄球菌的耐热核酸酶基因(nuc)和单增李斯特菌的侵入关联蛋白基因(iap)分别设计引物,进行PCR扩增及反应条件的优化,建立了对3种菌的多重PCR检测方法.王虎虎等[16]利用3种致病菌的特异性基因invA,HlyA,rfbE 设计 3 对引物,在鸡肉生产一线建立起可同时检测沙门氏菌、单增李斯特菌、大肠杆菌 O157的三重 PCR 方法.金黄色葡萄球菌和溶血性链球菌同为革兰氏阳性菌,可通过食品加工人员、炊事员或销售人员带菌等途径造成食品污染,危害人类健康.金黄色葡萄球菌的clfa基因主要编码菌体中的黏附纤维蛋白原凝集素,是金黄的葡萄球菌的主要抗原蛋白[17],溶血性链球菌的sdy基因是溶血性链球菌中相对较保守的基因序列[18].因此,本试验选取此2种基因作为靶基因,能够建立起一种快速、灵敏、特异性强的双重PCR方法,实现对猪肉中金黄色葡萄球菌和溶血性链球菌的同时检测.

表2 生鲜猪肉中溶血性链球菌和金黄色葡萄球菌双重PCR检测结果Table 2 Detection of raw pork of hemolytic streptococcus PCR
多重PCR的扩增对反应条件要求严格,如果不严格控制则容易出现非特异性扩增从而导致最终扩增失败[19].其中,退火温度是影响PCR特异性的重要因素,温度过高将影响模板和引物的结合而使扩增效率降低,过低则会导致非特异扩增[20].本研究先分别进行了两种模板的单重PCR退火温度摸索,寻找出尽量一致的退火温度,然后再将模板混合,进行双重PCR体系的退火温度优化,结果显示退火温度为52 ℃时能达到最佳效果,且稳定性良好.优化的双重PCR体系检测金黄色葡萄球菌和溶血性链球菌DNA的敏感性为102ng·L-1.检测结果表明,所建立的双重PCR检测方法能同时监测两种致病性球菌,特异性好,灵敏度高,能满足对市场生鲜猪肉快速检测和监控的需要.
检测结果显示,在126份生鲜猪肉样品中,金黄色葡萄球菌和溶血性链球菌的阳性检出分别为6.35%和5.55%,二者同时被检出的占2.38%.而索玉娟等[21]对生牛乳、生鲜肉(猪肉、牛肉、羊肉、鸡肉) 、肉制品、水产品、速冻食品、果蔬、豆制品等510份样品检测表明,金黄色葡萄球菌阳性食品108 份,总检出率为21.2%,其中生猪肉中检出率18%.这反映出当前市售生鲜猪肉中金黄色葡萄球菌的污染情况较以往几年有所降低,这可能与近些年国家食品安全部门对肉类食品行业的严格规范有关,但这种菌引发的污染还在一定程度上存在着,仍需引起重视.究其原因,可能与动物生前的健康状况与体表卫生清洁程度、屠宰加工操作规范及屠宰用水卫生状况以及鲜肉保藏、运输、销售等环节的交叉污染等因素有关.本研究中来自超市和农贸市场的样品阳性检出率相对较高,可能是由于这些地点人口流动大、冷链保障不到位、售卖人员操作不当等造成的.需要引起注意的是,样品中存在的死亡致病菌虽然对食肉安全影响不大,但在实际检测过程中,由于PCR的灵敏性极高,可能扩增出其DNA,而造成假阳性现象.因此可先利用多重PCR方法对样品进行初筛,然后再结合国标法验证,从而提高检测的准确率[22,23].
[1] 张 敏, 童华荣, 张丽平, 等. 动物性食品安全现状及其对策[J]. 食品工业科技, 2005, 11(5): 182-186.
[2] GOODING C M, CHOUDARY P V. Rapid and sensitive immunomagnetic separation-polymerase chain reaction method for the detection ofEscherichiacoliO157: H7 in raw milk and ice-cream[J]. J Diary Res, 1997, 64(1): 87- 931.
[3] TEREZA C R , SHAI B, MANSEL W G. Detection of campylobacter jejuni in naturally contaminated chicken skin by melting peak analysis of amplicons inreal-time PCR[J]. International Journal of Food Microbiology, 2005, 104: 105-111.
[4] LI Y X, LI Y Q, ZHENG B, et al . Determination of foodborne pathogenic bacteria by multiplex PCR-microchip capillary electrophoresis with genetic algorithm-support vector regression optimization[J]. Analytica Chimica Acta, 2009, 643: 100-107.
[5] KUMAR S, BALAKRISHNA K, BATRA H V. Enrichment-ELISA for detection of Salmonella typhi from food and water samples[J]. Biomedical and Environmental Sciences, 2008, 21(2): 137-143.
[6] CALL D R, BORUCKI M K, LOGE F J . Detection of bacterial pathogens in environmental samples using DNA microarrays[J]. J Microbiol Methods, 2003, 53(2): 235-243.
[7] 张玉霞, 黄 鸣 . 食品检验中多重PCR技术的应用[J]. 中国卫生检验杂志, 2008, 18 (5): 958-960.
[8] 钱玉春, 类延花, 胡中旺, 等. 4种食源性致病菌的多重PCR检测方法的建立[J]. 中国卫生检验杂志, 2009, 19(9): 2042-2045.
[9] 何 超, 樊学军, 汪东篱, 等. 沙门菌、志贺菌和大肠杆菌O157: H7的多重PCR快速检测体系的初步探讨[J]. 卫生研究, 2005, 34 (6): 721-723.
[10] 张亚兰. 肉制品中金黄色葡萄球菌的PCR技术检测方法研究[J]. 分析与检测, 2008(5): 108-111.
[11] 杜海燕, 周碧君. 链球菌通用PCR检测方法的建立及应用[J]. 贵州农业科学, 2009, 37(12): 152-154.
[12] 徐晓可, 吴清平, 周艳红, 等. 肉类中大肠杆菌O157: H7多重 PCR 检测方法的建立[J]. 微生物学通报, 2008, 35(4): 619-622.
[13] 张晓焱, 王 梅, 周映霞, 等. 多重PCR技术检测肉品中致病菌的应用研究[J]. 肉类研究, 2009(7): 47-49.
[14] 赵 新, 王 永, 兰青阔, 等. 4种食源性致病菌多重PCR检测技术的研究及应用[J]. 天津农业科学, 2009, 15(6): 6-8.
[15] 王 娜, 陶 妍. 水产品三种致病菌多重PCR检测方法的建立[J]. 食品与生物科技学报, 2009, 28(3): 397-403.
[16] 王虎虎, 徐幸莲. 冰鲜鸡肉中致病菌三重PCR检测方法的建立[J]. 中国农业科学, 2010, 43(17): 3608-3615.
[17] 尹荣兰, 张乃生, 张艳晶, 等. 金黄葡萄球菌ClfA活性基因的克隆及原核表达[J].中国生物制品学杂志, 2009, 22(1): 38-40.
[18] SILVIA P, FULVIO L ,AURORA R T, et al. Detection of streptococcus dysgalactiae subsp equisimilis in equine nasopharyngeal swabs by PCR[J]. Journal of Veterinary Science, 2010, 11(1): 67-72.
[19] AGERSBORG A, DAHL R, MARTINEZ I , et al. Sample preparation and DNA extraction procedures for polymerase chain reaction identification of listeria monocytogenes in seafoods[J]. Int J Food Microbiol, 1997, 35: 275-280.
[20] 黄银花, 胡晓湘, 徐慰倬, 等. 影响多重PCR扩增效果的因素[J]. 遗传, 2003, 25(1): 65- 67.
[21] 索玉娟, 于宏伟, 凌 巍, 等. 食品中金黄色葡萄球菌污染状况研究[J]. 中国食品学报, 2008, 8(3): 88-93.
[22] AMIT P, THEODORE P L. Shelf life evaluation for ready-toeat sliced uncured turkey breast and cured ham under probable storage conditions based on listeria monocytogenes and psychrotroph growth[J]. Int J Food Microbiol , 2008, 47: 49-56.
[23] 汪学荣, 彭祥伟. PCR技术检测肉中食源性病原菌的研究进展[J]. 肉类工业, 2010(7): 52-55.
(责任编辑:蒋国良)
EstablishmentandapplicationofduplexPCRmethodforpathogeniccoccidetectioninrawpork
LI Ying-ying, SHAO Liu-yun, LIU Xiao, ZHANG Xiu-fang, HU Hui, WANG Ya-bin, CHEN Li-ying
(College of Animal Husbandry and Veterinary Science, Henan Agricultural University, Zhengzhou 450002, China)
Primers forclfagene of Staphylococcusaureusandsdygene ofStreptococcushemolyticuswere specifically designed. Through reaction optimization and specificity and sensitivity tests, singular and duplex PCR methods were set up, and were then applied to detection of the target bacteria. 126 raw pork samples collected from different places of Zhengzhou city, were analyzed by the PCR method, and conventional microbiological examination was also taken as a control. The results show that the duplex PCR protocol turned out to be specific, effective with a sensitivity of 102ng·L-1. The examination of the raw pork samples showed that 7 out of 126 were detected asStreptococcushemolyticuspositive(5.55%), whilstStaphylococcusaureuswas detected among 8 samples,showing a detection rate of 6.35%.
Staphylococcusaureus;Streptococcushemolyticus; raw pork; duplex PCR; detection
S 851
:A
2014-01-19
河南省重大科技攻关项目(112101110100);国家质检总局科技计划项目(2013QK233)
李英英,1987年生,女,河南洛阳人,硕士研究生,主要从事食源性病原微生物的检验与分子生物学研究.
陈丽颖,1967 年生,女,河南南阳人,副教授.
1000-2340(2014)05-0613-06

