全自动血液分析仪LH 750两种检测模式的一致性评价
崔晓阳,周 卫,谭辉赟,朱彩云(广东省深圳市龙华新区人民医院检验科 518109)
LH750是由Beckman Coulter公司推出,采用了流式细胞、电阻抗和VCS(电导、射频和激光)等技术的先进全自动血液分析仪。为了满足临床应用需求,LH750提供了全血模式(WB)和预稀释模式(PD)两种检测模式。虽然,这两种模式原理相同,但是由于取样、血液稀释和分析前血液流经管路不同,导致两者检测结果存在差异[1-2]。因此,可以将同一血液细胞分析仪的两种检测模式看成两种检测系统。根据CNASCL02:2008《医学实验室质量与能力认可准则》的要求,实验室使用两套及以上检测系统检测同一项目时,应有比对数据表明其检测结果的一致性[3]。本文参考美国临床和实验室标准化协会(CLSI)EP9-A2文件[4]并结合Bland-Altman法和美国临床实验室改进修改法案(CLIA′88)规定的TEa(允许总误差)为判断标准的一致性评价方法,对全自动血液分析仪LH750的全血模式和预稀释模式两种检测模式测定同一样品的白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)和血小板计数(PLT)进行一致性评价。
1 材料与方法
1.1 标本 按照EP9-A2文件建议的浓度分布要求选择2013年1~6月深圳市龙华新区人民医院门急诊和住院部患者新鲜抗凝全血标本。
1.2 仪器与试剂 Beckman Coulter LH750血细胞分析仪及配套试剂、校准品和质控品。
1.3 方法
1.3.1 仪器校准与质控 依据厂商推荐程序进行仪器校准与质控,各项指标合格后方可进行临床样本检测。
1.3.2 一致性评价试验 按EP9-A2文件建议的方法进行:连续5d,每天选择8份标本在LH750全血和预稀释两种模式上进行WBC、RBC、Hb和PLT检测。8例标本随机编号,为排除携带污染对测定结果的影响,重复测定的顺序为1~8和8~1。全血模式作为参比方法,用X表示,预稀释模式为实验方法,用Y表示。
1.4 数据收集与处理
1.4.1 数据记录 记录每天8份标本的所有检测结果,X和Y两种方法测定结果分别用Xij和Yij表示(i为标本号,1~40;j为重复测定次数,1或2)。
1.4.2 离群值检验 EP9-A2文件要求对方法内和方法间所有标本的测定值进行离群值检验,按照公式分别计算方法内绝对偏差、相对偏差和方法间绝对偏差(E)、相对偏差(E′),可接受限是上述偏差的4倍。如果一个标本同时超出了绝对偏差和相对偏差的可接受限,判断为离群点。
1.4.3 相关性与直线回归分析 计算两种检测模式各个项目的相关系数(r)和直线回归方程Y=bX+a。EP9-A2要求r≥0.975(r2≥0.95),若符合则说明样品范围足够宽,数据满足要求,如果达不到,可以通过测定另外的样品扩大数据范围。
1.4.4 Bland-Altman法 以两种检测模式间重复测定结果的差值和对应均值,绘制Bland-Altman散点图并计算一致性界限作为一致性评价指标,即差值的95%分布范围(差值均值±1.96s)。如果散点图上95%的点位于一致性界限内,且界限内最大差值满足临床可接受水平,则判断两种方法一致性较高。
1.4.5 CLIA′88总允许误差一致性评价标准(临床可接受水平) 根据临床使用要求,将各个项目的医学决定水平浓度(Xc)代入回归方程,计算参比方法(Y)与实验方法(X)之间系统误差(SE)用偏倚Bias表示。Bias=|Y-Xc|,不正确度Bias%=×100%。以Bias%≤CLIA′88TEa为临床可接受水平,判断两种检测模式是否具有可比性。
1.5 统计学方法 所有数据采用SPSS17.0软件处理完成。Bland-Altman散点图按照夏寿扬等[5]报道的方法绘制。
2 结 果
2.1 离群点判断 4个检测项目方法内和方法间的可接受限结果见表1。经过判断,本次试验中各项目均未见离群点,说明仪器精密度良好,所获数据可以进行下一步分析。
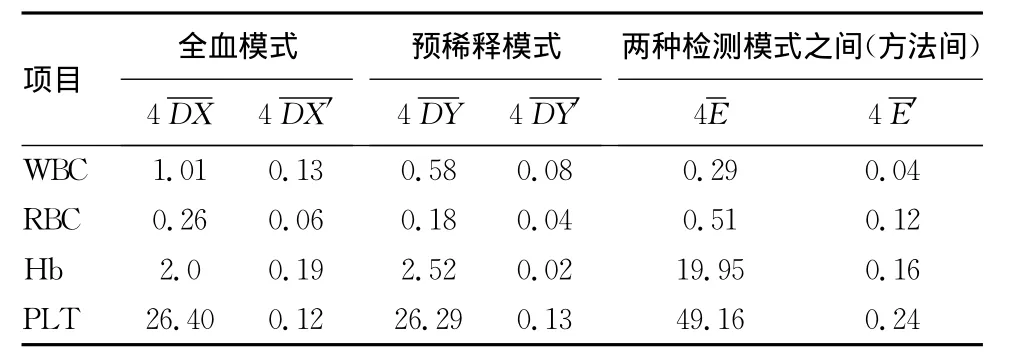
表1 各项目重复测量方法内和方法间可接受限
2.2 直线回归方程及相关系数 以全血模式为参考检测方法(X),预稀释模式为实验方法(Y),二者进行相关性回归分析,并计算出r及直线回归方程,见表2。计算结果显示,所有项目r≥0.975说明评价方法取值范围足够宽,且两种检测模式之间相关性良好。
2.3 Bland-Altman法 绘制4个项目的Bland-Altman散点图,见图1。根据散点图显示的信息,将Bland-Altman一致性判断结果汇总成表3。实验结果显示所有项目均有2/40点位于一致性界限外,一致性界内最大差值对应各自测定均值的偏差分别为8.13%、5.6%、8.13%和8.03%。对照 CLIA′88相应的标准,WBC、RBC和PLT 3个项目两种检测模式结果一致性较高;而Hb项目的偏差具有实际临床专业意义,可以认为结果不具有可比性。

表2 各项目的相关系数及直线回归方程

图1 两种检测模式间Bland-Altman分析

表3 Bland-Altman一致性结果判断表

表4 两种检测模式间偏倚评估与临床可接受性评价
2.4 各项目在给定医学决定水平的偏倚 两种检测模式的WBC、RBC以及Hb项目一致性评价符合临床接受水平,PLT项目低值医学决定水平上的偏差超出1/2CLIA′88TEa,但仍小于CLIA′88TEa,实际工作中可暂认为其符合临床要求,见表4。
3 讨 论
血细胞分析以静脉血检测的准确性最高,但由于末梢血检测取血量少,节省时间和费用,满足了某些特殊病患和婴幼儿进行血液检验的需要,仍然在各级医院检验科广泛开展,且很多科室在同一台血细胞分析仪上进行末梢血检测(预稀释模式)和静脉血检测(全血模式)。研究表明,末梢血与静脉血的血细胞分析结果有一定差异,而且这种差异常会造成对同一患者两种结果解释的困难。当前临床血液实验室广泛应用新鲜全血校血细胞分析仪进行校准,而无法对末梢血检测系统校准,因此,如何保证末梢血血细胞分析结果的准确行和可比性就显得十分重要。
本科室将LH750全自动血液分析仪的全血模式和预稀释模式看成两种不同血液检测分析系统,依据CNAS-CL43:2012《医学实验室质量与能力认可准则在临床血液学检测领域的应用说明》等法规文件“应对不同吸样模式(自动、手动和预稀释模式)进行校准和比对”的要求进行定期比对[5]。在临床工作中,血细胞分析仪检测结果一致性评价常用的方法有配对t检验、相关分析、回归分析等,但是这些方法均不准确[6]。配对t检验只是检验两组数据的集中位置是否相同,对两种检测系统间的系统误差敏感;相关分析只是检验数据同步变化的方向与紧密程度,对随机误差敏感,这些都只是一致性评价的某一个方面[7]。
本次一致性评价试验中,选择卫生部临检中心室间质评优秀的LH750血细胞分析仪全血模式作为比较方法,以期达到本研究的测定结果能够间接地溯源至参考方法[8]。同时依据CLSI EP9-A2文件,选择患者标本和设计试验。在进行统计学判断时,引入Bland-Altman法。将Bland-Altman法用于定量资料的一致性评价是近年来兴起的新方法,Bland-Altman法同时考虑了随机误差和系统误差对一致性的影响,又可结合临床专业意义进行判断,具有独特的优势,该方法已在国内外的研究中广泛应用,是评价一致性的良好方法[5,9]。
按照 CLSI EP9-A2文件要求,计算 WBC、RBC、Hb和PLT 4个项目的可接受限,并判断离群点。结果显示4个项目在2次重复测定方法内及方法间均无超出点和离群点,提示LH750精密度良好,获得的试验数据可以进一步用于统计分析。相关分析结果表明,LH750两种模式4个检测项目的r均大于0.975,相关性良好,且说明标本数据分布范围足够宽,符合要求。
以往的研究表明,在进行血细胞分析仪预稀释模式测定时,由于利用微量管吸样,可能会吸入组织液,且人工加入稀释液等因素,会导致末梢血结果普遍低于全血。本次试验中,从Bland-Altman散点图来看,4个项目的散点分布均匀。这得益于LH750的预稀释检测模式软件和电路优化,使得检测结果更准确。Bland-Altman偏倚分析表明LH750两种模式检测的WBC、RBC和PLT 3个项目一致性较好,符合临床要求;而对于Hb项目,虽然95%的散点位于一致性界限内,但其界限内最大差值偏差具有临床意义,最终判定两种检测模式对Hb的检测结果不具有可比性。
为了弥补Bland-Altman法未能引入医学决定水平进行一致性分析的缺陷,本研究采用CLIA′88允许总误差来判断各个项目医学决定水平的偏差是否能够被临床接受。统计结果表明两种检测模式的WBC、RBC和Hb等3个项目各医学决定水平之间偏倚满足临床可接受水平。而低值PLT医学决定水平处的偏差超出了本次研究设定1/2CLIA′88TEa,但仍在CLIA′88TEa范围内,可暂时认为结果具有可比性,但是在实际临床工作,必要时,应采用静脉全血验证预稀释模式获得的低值血小板结果。
本次试验表明,在进行血细胞分析仪两种系统一致性评价时,应该综合多种统计学方法并结合临床专业实际意义,方能得出合理、正确的结论。根据本次试验结果,应在厂家工程师的帮助下,重新校准两种检测模式的Hb和PLT项目,直至结果为临床所接受。
[1]赵卫国.血细胞分析仪全血和预稀释模式的优劣分析[J].检验医学与临床,2012,9(7):864-865.
[2]韩弋戟,黄润华,郭明琴,等.血细胞分析仪两种模式检测结果比对分析和偏倚评估[J].检验医学与临床,2012,9(21):2662-2663,2666.
[3]中国合格评定国家认可委员会.CNAS-CL02:2008医学实验室质量和能力认可准则[S].北京:中国合格评定国家认可委员会,2008:1-36.
[4]夏寿扬,钱芳.血液细胞分析仪结果比对与一致性评价方法探讨[J].检验医学与临床,2012,9(13):1602-1603.
[5]中国合格评定国家认可委员会.CNAS-CL43:2012医学实验室质量与能力认可准则在临床血液学检测领域的应用说明[S].北京:中国合格评定国家认可委员会,2012:4-5.
[6]李镒冲,李晓松.两种测量方法定量测量结果的一致性评价[J].现代预防医学,2007,34(17):3263-3266.
[7]萨建,刘桂芬.定量测量结果的一致性评价及Bland-Altman法的应用[J].中国卫生统计,2011,28(4):409-411,413.
[8]曾令海.不同血液分析仪的比对试验[J].检验医学与临床,2012,9(3):344-346.
[9]曾宪飞,李军民,谈昀,等.不同评价方案在临床比对试验应用的方法学探讨[J].现代检验医学杂志,2012,27(2):66-69.

