丹参酮ⅡA磺酸钠对急性坏死性胰腺炎大鼠肺损伤的抗炎作用及其机制研究
石亮亮 刘明东 朱 浩 陈 敏 邹晓平
南京大学医学院附属鼓楼医院消化科(210008)
急性胰腺炎(acute pancreatitis,AP)是一种临床常见的急腹症,重症急性胰腺炎(severe acute pancreatitis,SAP)可导致全身性炎症反应综合征(SIRS)和多器官功能障碍综合征(MODS),是造成SAP高死亡率的重要原因[1-2]。SAP相关肺损伤的发生率约为15% ~55%[3],急性肺损伤是SAP早期最主要的死亡原因,然而其发病机制至今尚未完全阐明。c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)是AP发生、发展过程中的关键介质之一,炎症因子可激活JNK信号通路,而该通路激活又可进一步加重炎症反应[4]。丹参酮ⅡA磺酸钠(sodium tanshinoneⅡA sulfonate,STS)是中药丹参提取物丹参酮ⅡA的水溶性衍生物,既往研究发现该制剂能阻断JNK信号通路激活[5],并对急性肺损伤具有保护作用[6]。本研究建立急性坏死性胰腺炎(acute necrotizing pancreatitis,ANP)大鼠模型并予STS预处理,通过观察ANP大鼠的肺组织损伤程度、炎症因子表达和JNK信号通路的活化情况,探讨STS对SAP相关肺损伤的抗炎作用及其可能机制。
材料与方法
一、实验动物和主要试剂
清洁级雄性Sprague-Dawley大鼠36只,体质量200~250 g,由南京鼓楼医院实验动物中心提供。STS注射液(上海第一生化药业有限公司,国药准字 H31022558),大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)ELISA试剂盒(Bender MedSystems,eBioscience Inc.),兔抗大鼠 SAPK/JNK、Phospho-SAPK/JNK单克隆抗体(Cell Signaling Technology,Inc.),抗 GAPDH 兔多克隆抗体(北京康为世纪生物科技有限公司),山羊抗兔 IgG(Molecular Probes®,Thermo Fisher Scientific Inc.)。
二、方法
1.动物分组和ANP模型制备:实验动物随机分为假手术组、ANP组和STS组,每组12只。ANP组和STS组予新鲜配制的5%牛磺胆酸钠(1.0 mL/kg)从十二指肠乳头处逆行穿刺注入主胰管建立ANP模型,假手术组开腹后仅翻动十二指肠并触摸胰腺数次后关腹。STS组于造模前30 min予腹腔注射 STS 1.0 mg/kg预处理[6]。造模后 12 h 和 24 h分批处死动物,进行后续实验。
2.常规病理学检查:取大鼠胰腺组织和部分右肺组织,4%甲醛溶液固定,常规石蜡包埋,切片,HE染色,光学显微镜下观察。
3.肺损伤评分[7]:根据肺组织水肿、出血、炎性细胞浸润和小气道损伤四项病理变化进行评分,每项变化按程度分为5级。0级:无该项病理变化;1级:病理变化轻且很局限;2级:病理变化中等且局限;3级:病理变化中等但广泛或局部很显著;4级:非常显著的广泛性病理变化。
4.肺组织促炎细胞因子含量测定:取部分右肺组织制成5%匀浆,-20℃保存待测。采用ELISA方法,按试剂盒说明书进行操作,测定肺组织TNF-α、IL-1β 含量。
5.蛋白质印迹法检测肺组织JNK、p-JNK蛋白表达:制备肺组织匀浆,提取总蛋白并进行蛋白定量。取50 μg总蛋白,按1∶4加入5×SDS上样缓冲液,沸水浴加热5 min,进行SDS-PAGE电泳,转膜,含5%奶粉的TBST封闭2 h,加入一抗(1∶1000)4℃过夜,TBST洗膜,加入二抗(1∶2000)室温孵育2 h,TBST洗膜,加入 ECL发光液,显影,定影,扫描胶片,Quantity One软件分析各条带光密度值,计算目的蛋白相对表达量。每一样本至少重复检测3次。
三、统计学分析
结 果
一、胰腺和肺组织病理学改变
假手术组大鼠胰腺和肺组织结构基本正常。ANP 12 h组胰腺腺泡间隙明显扩大,小叶结构破坏,细胞结构模糊,边界不清,胰腺内出现片状坏死、出血,大量中性粒细胞浸润;24 h组胰腺坏死区域进一步扩大,中性粒细胞浸润相对减轻。STS组胰腺组织损伤较ANP组减轻,坏死面积减小,可见点状出血。ANP 12 h组肺组织肺泡壁增厚,间隔增宽,间质毛细血管充血、淤血,大量中性粒细胞浸润;24 h组肺组织实变更为明显。STS组肺组织损伤较ANP组减轻,实变面积减小,炎性细胞浸润减轻(见图1)。
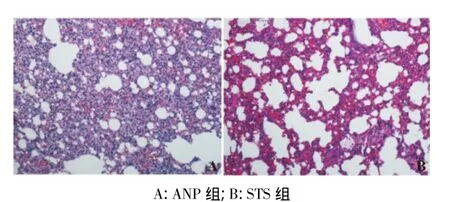
图1 ANP组和STS组造模后24 h肺组织病理学改变(HE染色,×200)
二、肺损伤评分
ANP 12 h组和24 h组肺组织水肿、出血、白细胞浸润和小气道损伤的病理学评分均显著高于同时间点假手术组(P<0.05);STS组与同时间点ANP组相比,各项病理学评分均显著降低(P<0.05)(见表1)。
三、肺组织 TNF-α、IL-1β 表达
ELISA法检测显示,ANP 12 h组和24 h组肺组织TNF-α、IL-1β含量均显著高于同时间点假手术组(P<0.05);STS组与同时间点ANP组相比,TNF-α、IL-1β 含量均显著降低(P <0.05)(见表1)。
四、肺组织JNK、p-JNK蛋白表达
蛋白质印迹法检测显示,ANP 12 h组和24 h组肺组织JNK及其活化形式p-JNK蛋白相对表达量均显著高于同时间点假手术组(P<0.05);STS组与同时间点ANP组相比,JNK表达无明显变化,p-JNK表达显著降低(P <0.05)(见图2、表1)。
讨 论
除胰腺和胰周坏死外,SAP患者还伴有持续且不能自行恢复的呼吸、心血管或肾脏功能衰竭,可累及一个或多个脏器[8],病死率高达36% ~50%。急性肺损伤及其引起的急性呼吸窘迫综合征(ARDS)是SAP最常见的胰外表现,使SAP早期死亡率明显增高[3]。SAP相关肺损伤发生机制复杂,有多种黏附分子、炎症介质参与其间,但确切机制迄今仍未阐明,因此尚无针对病因的有效治疗措施,减轻肺损伤可能降低SAP的死亡率。
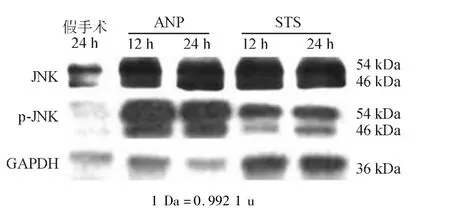
图2 三组各时间点肺组织JNK、p-JNK蛋白表达电泳图
MAPKs广泛存在于哺乳动物细胞的胞质中,参与调节细胞生长、发育、分化、死亡以及细胞间功能的同步等一系列生命活动。JNK是MAPKs家族的重要成员之一,可被应激刺激、细胞因子、生长因子等激活。研究发现在多种因素诱导的肺损伤动物模型中,炎症因子如TNF-α、IL-1等引起的 JNK信号通路激活可通过上调激活蛋白-1(AP-1)的转录活性,调控一系列炎症相关基因表达,促进肺损伤发生[9-14]。因此,JNK信号通路是肺损伤炎症反应的重要介质之一,炎症因子激活JNK信号通路,该通路激活又使炎症反应进一步放大。本课题组前期研究[15]证实JNK信号通路在SAP相关肺损伤中起关键作用,由此推测JNK特异性抑制剂可能有助于减轻SAP相关肺损伤。
表1 三组各时间点肺损伤评分、肺组织促炎细胞因子和JNK、p-JNK蛋白表达比较(n=6,)
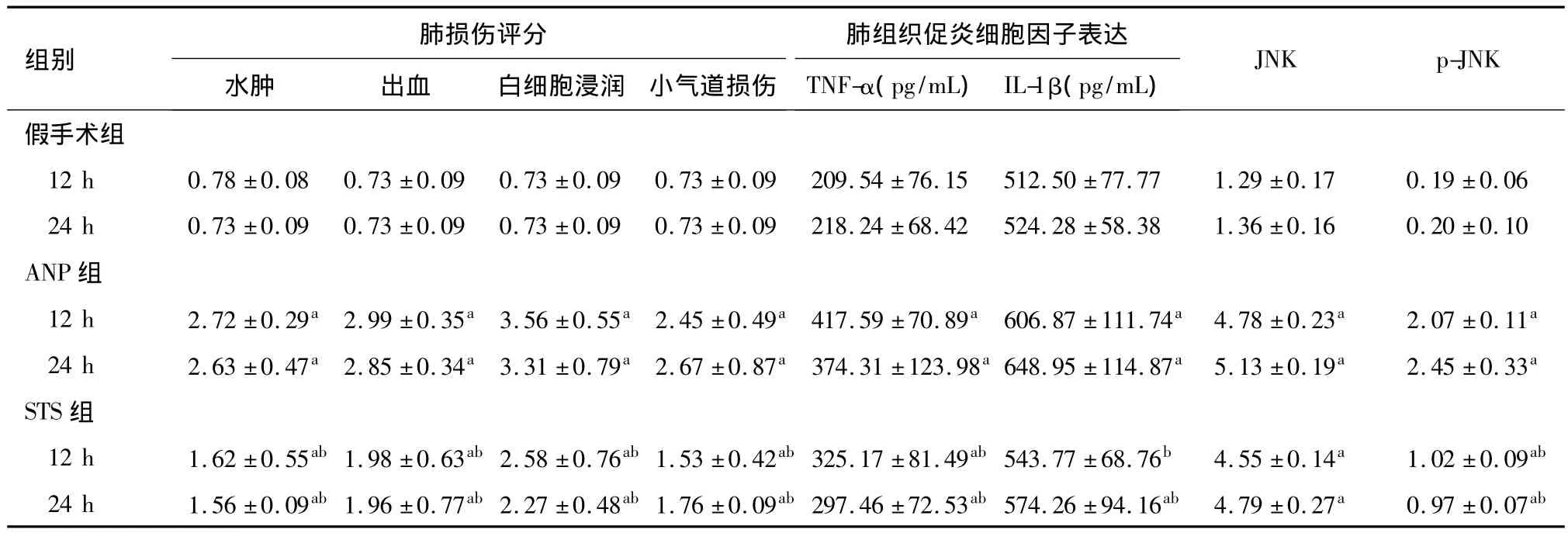
表1 三组各时间点肺损伤评分、肺组织促炎细胞因子和JNK、p-JNK蛋白表达比较(n=6,)
a与同时间点假手术组比较,P<0.05;b与同时间点ANP组比较,P<0.05
本实验对ANP小鼠肺组织的组织病理学检查发现肺组织内中性粒细胞浸润明显,毛细血管通透性增加,肺损伤评分明显增高。中性粒细胞进入肺组织并被激活产生促炎细胞因子在肺损伤中起关键作用,其中IL-1是细胞因子网络中最早释放的炎症介质之一,而TNF-α可诱导单核因子如IL-1β、IL-6合成,触发炎症级联反应,增强其破坏性[16]。本实验对ANP小鼠肺组织的检测显示,造模后12 h和24 h,肺组织TNF-α、IL-1β 含量均明显增高,同时JNK、p-JNK表达上调,提示炎症因子激活JNK信号通路。进一步观察经STS预处理的ANP小鼠,发现该组小鼠肺组织JNK表达无明显变化,但p-JNK表达明显下调,提示JNK信号通路活化受抑,同时肺组织TNF-α、IL-1β含量和肺损伤评分均明显降低,提示STS可能通过抑制JNK信号通路激活而在SAP相关肺损伤中发挥抗炎作用。
综上所述,SAP相关肺损伤有JNK信号通路参与其中,STS干预能下调ANP大鼠的肺组织炎症因子表达,降低肺损伤程度,其机制可能与抑制JNK信号通路激活有关。本实验的缺陷之处在于未能对STS的适宜剂量进行探讨,有待后续研究加以完善。
1 Chan YC,Leung PS.Acute pancreatitis:animal models and recent advances in basic research[J].Pancreas,2007,34(1):1-14.
2 Bumbasirevic V,Radenkovic D,Jankovic Z,et al.Severe acute pancreatitis:overall and early versus late mortality in intensive care units[J].Pancreas,2009,38(2):122-125.
3 Surbatovic'M,Jovanovic'K,Radakovic'S,et al.Pathophysiological aspects of severe acute pancreatitis-associated lung injury(Article in Serbian)[J].Srp Arh Celok Lek,2005,133(1-2):76-81.
4 Minutoli L,Altavilla D,Marini H,et al.Protective effects of SP600125 a new inhibitor of c-jun N-terminal kinase(JNK)and extracellular-regulated kinase(ERK1/2)in an experimental model of cerulein-induced pancreatitis[J].Life Sci,2004,75(24):2853-2866.
5 Yang R,Liu A,Ma X,et al.Sodium tanshinoneⅡA sulfonate protects cardiomyocytes against oxidative stressmediated apoptosis through inhibiting JNK activation[J].J Cardiovasc Pharmacol,2008,51(4):396-401.
6 史雪梅,黄亮,曹春水,等.丹参酮ⅡA对大鼠急性肺损伤保护的实验研究[J].中华结核和呼吸杂志,2005,28(5):350-351.
7 朱列伟,孙波,郑珊,等.实验性急性肺损伤的形态计量[J].复旦学报(医学版),2003,30(2):110-113.
8 Hartwig W,Werner J,Müller CA,et al.Surgical management of severe pancreatitis including sterile necrosis[J].J Hepatobiliary Pancreat Surg,2002,9(4):429-435.
9 谭正怀,余凌虹,魏怀玲,等.乌司他丁对脂多糖致小鼠急性肺损伤的保护作用以及与诱导型一氧化氮合酶和c-Jun表达的关系[J].药学学报,2006,41(7):636-640.
10 Cho HY,Morgan DL,Bauer AK,et al.Signal transduction pathways of tumor necrosis factor-mediated lung injury induced by ozone in mice[J].Am J Respir Crit Care Med,2007,175(8):829-839.
11 Guo RF,Lentsch AB,Sarma JV,et al.Activator protein-1 activation in acute lung injury[J].Am J Pathol,2002,161(1):275-282.
12 Chen LW,Chang WJ,Wang JS,et al.Interleukin-1 mediates thermal injury-induced lung damage through CJun NH2-terminal kinase signaling[J].Crit Care Med,2007,35(4):1113-1122.
13 Ishii M,Suzuki Y,Takeshita K,et al.Inhibition of c-Jun NH2-terminal kinase activity improves ischemia/reperfusion injury in rat lungs[J].J Immunol,2004,172(4):2569-2577.
14 Kanagawa F,Takahashi T,Inoue K,et al.Protective effect of carbon monoxide inhalation on lung injury after hemorrhagic shock/resuscitation in rats[J].J Trauma,2010,69(1):185-194.
15 Liu M,Shi L,Chen M,et al.Effects of c-Jun N-terminal kinase signaling pathway on severe acute pancreatitisassociated lung injury[J].Pancreas,2012,41(3):358-366.
16 Ertel W,Morrison MH,Wang P,et al.The complex pattern of cytokines in sepsis.Association between prostaglandins,cachectin,and interleukins[J].Ann Surg,1991,214(2):141-148.

