补中益气汤含药血清对人肺腺癌A549/DDP细胞耐药作用的影响*
刘亚莉, 王 莹, 易佳丽, 史妍婷, 刘春英△
肺癌是严重威胁人类健康与生命的恶性肿瘤,病人诊断时多处于中晚期,是我国恶性肿瘤致死的首要因素。化疗是治疗肺癌的常用手段,但肺癌对化疗药物产生耐药是影响疗效的重要因素。顺铂是肺癌常用的化疗药物,其抗肿瘤的毒性和有效性已经得到肯定。但顺铂毒副反应重且易于形成耐药,这严重影响了肺癌的临床疗效,限制了顺铂的应用[1-2]。尽管目前采用多种药物联合配伍、加大药物剂量等策略应对肿瘤耐药的发生,但药物的毒副作用也随之增加,加重患者机体功能的衰竭。因此,寻找有效的能够逆转其耐药的药物成为抗肿瘤治疗的一个重要辅助手段。本实验运用补中益气汤含药血清作用于人肺腺癌细胞株A549和A549/DDP,观察其对耐药细胞株A549/DDP增殖的抑制作用及探讨其可能的作用机制。
材料和方法
1 主要试剂
DMEM培养液、胎牛血清和0.25%胰蛋白酶购自HyClone;四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒购自北京鼎国生物技术有限公司;顺铂购自齐鲁制药厂;磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)和蛋白激酶 B(protein kinase B,Akt)抗体购于南京凯基生物技术有限公司。Trizol Reagent购于Invitrogen Life Technologies;PI3K和Akt荧光定量PCR试剂盒购于宝生物工程(大连)有限公司;引物合成由北京华大基因公司完成。
2 制备含药血清
补中益气汤由中药黄芪、炙甘草、人参、当归、陈皮、升麻、柴胡和白术组成,全部药材均购于辽宁中医药大学附属医院药房,并经辽宁中医药大学药理实验室鉴定。根据《药理实验方法学》[3]“动物与人体的每千克体重剂量折算系数表”,设立补中益气汤高、中、低剂量组分别为成人推荐日用量的2、1和1/2倍,常规煎煮,过滤、水浴蒸发至每毫升含生药2.626 g、1.313 g和0.657 g。冷却后4 ℃保存。SD大鼠由辽宁中医药大学动物部提供,动物许可证号为辽实动(字)(2012-0012号),清洁级,体重(200±10)g,雌雄不限,40只,随机分为补中益气汤高剂量组、补中益气汤中剂量组、补中益气汤低剂量组和对照组,给予高、中、低剂量的补中益气汤13.13 g/kg、6.57 g/kg、3.29 g/kg及等量生理盐水灌胃,每天1次,连续3 d,末次给药1 h腹主动脉采血,2 000 r/min离心 5 min,取上清,56 ℃水浴30 min 灭活,0.22 μm 微孔滤膜过滤,-20℃保存。
3 方法
3.1 细胞培养 人肺腺癌细胞株A549和A549/DDP由中国医科院肿瘤研究中心细胞库提供。置于含10%胎牛血清的DMEM培养液,5%CO2、37℃培养箱中培养,每2 d换液1次,0.25%胰蛋白酶消化,4~6 d传代1次。
3.2 A549细胞和A549/DDP细胞的生长曲线测定用含10%胎牛血清的DMEM培养基200 μL培养A549细胞和A549/DDP细胞,待细胞贴壁后分别于12 h、24 h、48 h和72 h收集细胞进行MTT比色法检测。以时间为横轴、每一时点的吸光度(absorbance,A)为纵轴绘制细胞生长曲线。
3.3 最佳含药血清筛选 取对数生长期的A549细胞和A549/DDP细胞,调整密度为1×105/L,分为:(1)正常对照组,用含10%对照组大鼠血清的DMEM 200 μL培养;(2)含药血清高剂量组;(3)含药血清中剂量组;(4)含药血清低剂量组。(2)~(4)组分别加含10%高、中、低剂量大鼠含药血清的DMEM培养液200 μL,每组设5个复孔,同时设不加细胞的调零孔,各组细胞继续培养12 h、24 h、48 h和72 h后,加5 g/L MTT 20 μL,37 ℃培养 4 h 吸弃上清液,每孔加入二甲基亚砜(dimethyl sulfoxide,DMSO)150 μL,振荡10 min,用酶标仪在波长570 nm 测定各孔的A值,重复3次取平均值。细胞生长抑制率(%)=(实验组平均A值-空白组平均A值)/(对照组平均A值-空白组平均A值)×100%。
3.4 最佳含药血清对A549细胞和A549/DDP细胞耐药逆转作用的测定 取对数生长期的A549细胞和A549/DDP细胞,调整密度为1×105/L,分为顺铂+对照血清组和顺铂+最佳含药血清组,每组顺铂设7个浓度。待细胞贴壁后,顺铂+对照血清组加入含10 μL顺铂和含10%大鼠对照血清的DMEM培养液 200 μL,顺铂设有 6 μmol/L、12 μmol/L、25 μmol/L、50 μmol/L、100 μmol/L、200 μmol/L 和 400 μmol/L的浓度梯度;顺铂+最佳含药血清组加入含10 μL顺铂和含10%最佳含药血清的DMEM培养液200 μL,顺铂的浓度梯度同上。每组设5个复孔,保证各组加入的血清总量相同,同时设不加细胞的调零孔,置于5%CO2、37℃孵育培养48 h,每孔加入5 g/L的MTT溶液20 μL,培养4 h后,弃上清液,每孔加DMSO 150 μL,摇床混匀10 min,用酶标仪在波长570 nm处测各孔A值。上述实验重复3次取平均值。计算细胞生长抑制率(方法同上),采用直线回归方法计算药物的半数抑制浓度(half maximal inhibitory concentration,IC50);耐药指数(resistance index,RI)=耐药细胞株IC50/敏感细胞株IC50,逆转指数(reversal index,RI)=药物IC50(不加逆转剂)/药物IC50(加逆转剂)。
3.5 免疫细胞化学法检测A549细胞和A549/DDP细胞中PI3K和Akt蛋白的表达 将A549细胞和A549/DDP细胞接种于预先置有盖玻片的12孔板中,培养至对数生长期,2种细胞株各分为对照血清组、最佳含药血清组、LY294002组、LY294002+最佳含药血清组(联合组)和阴性对照组。对照血清组和阴性对照组加含有10%SD大鼠对照血清的DMEM培养基200 μL;最佳含药血清组加入含有10%最佳含药血清的DMEM培养基200 μL;LY294002组在对照血清组的基础上加LY294002 1 μL;联合组在最佳含药血清组的基础上加LY294002 1 μL。继续培养48 h,取出盖玻片,4%多聚甲醛固定,3%H2O2孵育20 min,10%山羊血清封闭30 min,Ⅰ抗孵育,阴性对照组以PBS代替Ⅰ抗,4℃过夜,加Ⅱ抗作用30 min,二氨基联苯胺(diaminobenzidine,DAB)显色,苏木素复染,封片。采用Image-Pro Plus医学图像分析系统进行图像分析,在400倍高倍镜下,随机取5个视野,每个视野为2 592×1 944像素点,分别测出阳性反应细胞的总面积和积分吸光度(integral absorbance,IA),每组设3个平行孔,实验重复3遍。
3.6 Western blotting检测 PI3K和Akt蛋白水平
取对数生长期的A549/DDP细胞,分组及培养条件同3.5。培养48 h后,收集细胞,提取总蛋白,离心取上清,BCA试剂盒测定蛋白浓度,与5×SDS上样缓冲液100℃煮沸5 min,以每孔60 μg上样至10%SDS-PAGE凝胶中,电泳分离(120 V),转印(50 V、2 h),TBS浸泡10 min,含5%脱脂奶粉的TBS 37℃封闭1 h。TBS洗膜5 min×2,Ⅰ抗4℃孵育过夜,TTBS洗膜5 min×2,Ⅱ抗37℃孵育2 h,TTBS洗膜5 min×2,TBS洗膜5 min。在暗室用ECL发光,图像扫描并分析结果。采用所测的PI3K和Akt条带与内参GAPDH条带的吸光度比值表示PI3K和Akt蛋白的表达水平。
3.7 Real-time PCR检测A549/DDP细胞中PI3K和Akt中mRNA的表达 取对数生长期的A549/DDP细胞,分组同3.5。给予相应的干预因素继续培养48 h后,收集各组细胞。采用Trizol试剂提取细胞总RNA,检验样本RNA纯度,计算RNA浓度(g/L)=A260×40×稀释倍数/1 000。按逆转录试剂盒说明逆转录合成cDNA,反应条件为37℃ 15 min,85℃ 5 s,1个循环。PCR扩增的反应条件为95℃ 0.5 min;95℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95℃ 15 s。反应体系为20 μL,每个实验重复3次,取平均值。PCR引物采用Primer Premier 5.0软件设计如下:GAPDH 5’-CAATGACCCCTTCATTGACC-3’,5’-TGGAAGATGGTGATGGGATT-3’,产 物 135 bp;PI3K 5’-CCGAGACACTGCTGATG-3’,5’-GGTATTTGGACACTGGGTA-3’,产物254 bp;Akt 5’-CTCATTCCAGACCCACGAC-3’, 5’-CAGCCCGAAGTCCGTTA-3’,产物241 bp。
4 统计学处理
采用SPSS 17.0软件分析,计量资料用均数±标准差(mean±SD)表示,各组间数据的比较用单因素方差分析(One-way ANOVA),组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
结 果
1 A549细胞和A549/DDP细胞生长曲线的测定
MTT结果显示,2种细胞在培养12 h、24 h和48 h时A值逐渐增加,在48 h达高峰;而在72 h时,2种细胞的A值大幅下降,提示在72 h细胞的生长能力已经降低,死亡细胞增多,见图1。

Figure 1.Growth curves of A549 cells and A549/DDP cells.Mean±SD.n=5.图1 A549细胞和A549/DDP细胞的生长曲线
2 最佳含药血清的筛选结果
不同剂量补中益气汤含药血清对A549细胞和A549/DDP细胞生长的抑制率见表1。结果表明,A549细胞和A549/DDP细胞分别在含药血清高、中、低剂量作用下,随着作用时间的的增加,其生长抑制率逐渐增加,至48 h达到高峰,具有时间-剂量效应。在作用至72 h时的抑制率较48 h时降低,这与72 h时细胞的增殖能力已经下降、死亡细胞较多有关。中剂量含药血清对A549/DDP细胞作用48 h时的抑制率为9.14%,与高剂量含药血清作用24 h和48 h的抑制率比较,差异有统计学意义。但根据文献[4-5],抑制率小于10%时,对敏感株和耐药株细胞均无明显细胞毒作用。要采用无细胞毒性剂量作为逆转剂量,因此选择10%的中剂量含药血清作用48 h为最佳含药血清和最佳作用时间。
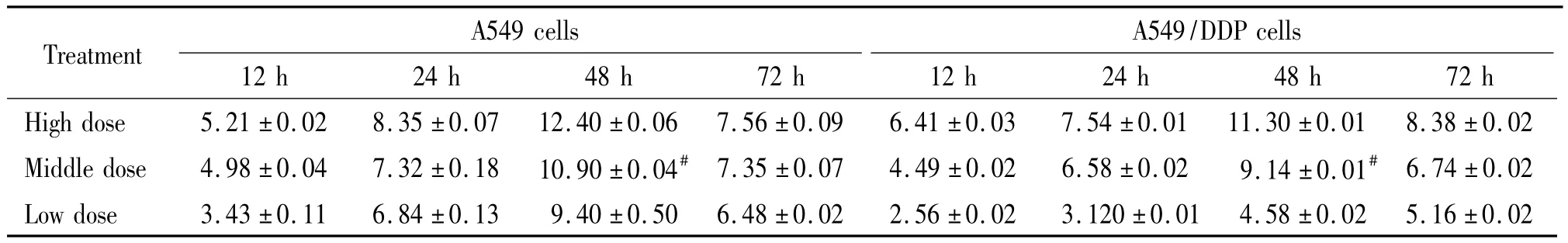
表1 含药血清对A549细胞和A549/DDP细胞的生长抑制率Table 1.The inhibitory rate of medicated serum for A549 cells and A549/DDP cells(%.Mean±SD.n=5)
3 最佳含药血清对A549/DDP细胞耐药逆转的测定
顺铂对 A549细胞的 IC50为(28.62±0.12)μmol/L,对 A549/DDP 细胞的 IC50则为(210.57 ±1.02)μmol/L,A549/DDP细胞对顺铂的耐药指数为7.35;顺铂和最佳含药血清联合作用对A549细胞的IC50为(22.73 ±0.31)μmol/L,对 A549/DDP 细胞的IC50为(85.52 ±0.17)μmol/L,A549/DDP 细胞对顺铂和最佳含药血清联合作用的耐药指数为3.76,提示最佳含药血清可协同顺铂抑制A549/DDP细胞的生长,降低A549/DDP细胞对顺铂的耐药性。最佳含药血清与顺铂联合作用时,A549/DDP细胞对各剂量顺铂的敏感性明显增强,逆转指数约为2.46。
4 免疫组化法检测最佳含药血清对A549/DDP细胞PI3K和Akt蛋白的表达
PI3K和Akt蛋白在A549/DDP细胞的细胞膜和细胞浆中均有表达,对照血清组和LY294002组可见较多棕黄色颗粒,最佳含药血清组和联合组的棕黄色颗粒较之减少,阴性对照组则看不到棕黄色颗粒,见图2、3。与对照血清组比较,最佳含药血清组和联合组PI3K和Akt的表达明显降低,差异均有统计学意义(P<0.05);LY294002组与对照血清组比较差异无统计学意义(P>0.05),见图4。
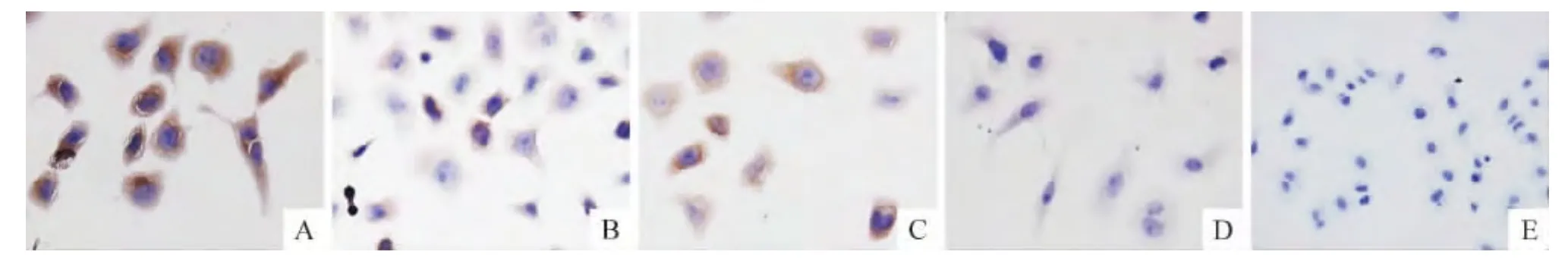
Figure 2.Expression of PI3K in A549/DDP cells(immunocytochemical method,×200).A:control serum group;B:optimal medicated serum group;C:LY294002 group;D:LY294002+optimal medicated serum group;E:negative group.图2 免疫细胞化学法检测A549/DDP细胞PI3K的表达
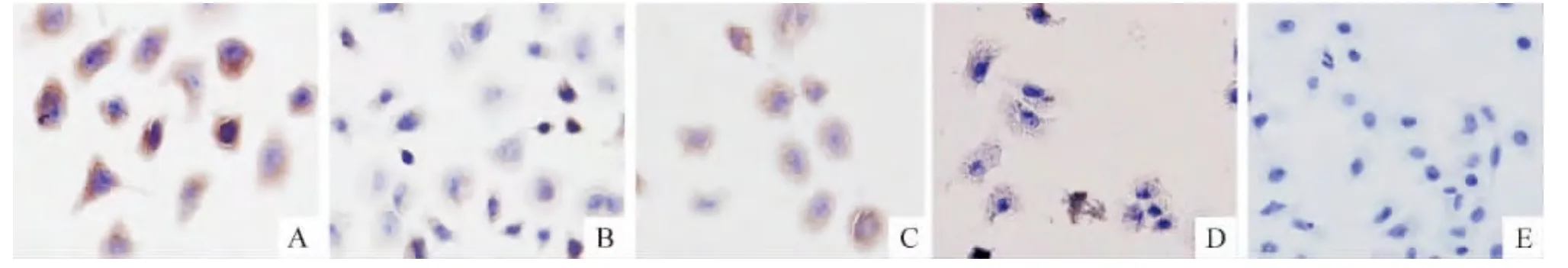
Figure 3.Expression of Akt in A549/DDP cells(immunocytochemical method,×200).A:control serum group;B:optimal medicated serum group;C:LY294002 group;D:LY294002+optimal medicated serum group;E:negative group.图3 免疫细胞化学法检测A549/DDP细胞Akt的表达
5 Western blotting检测最佳含药血清对A549/DDP细胞中PI3K和Akt蛋白表达的影响
对照血清组与LY294002组比较,A549/DDP细胞的PI3K表达差异没有统计学意义(P>0.05),而最佳含药血清组和联合组的表达明显减少,与对照血清组比较均差异有统计学意义(P<0.05);Akt蛋白的表达在最佳含药血清组和联合组减少,与对照血清组比较差异有统计学意义(P<0.05),而LY294002组与对照血清组比较差异无统计学意义(P >0.05),见图5。
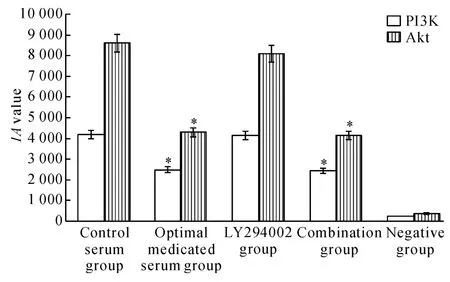
Figure 4.The protein expression of PI3K and Akt in A549/DDP cells with different treatments.Mean ± SD.n=5.*P <0.05 vs control serum group.图4 免疫组化方法检测不同处理的A549/DDP细胞PI3K、Akt蛋白的表达
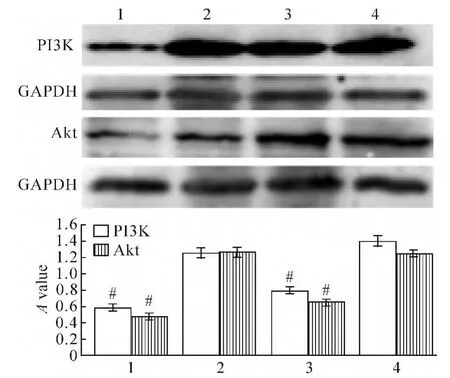
Figure 5.Expression of PI3K and Akt in A549/DDP cells detected by Western blotting.1:combination group;2:LY294002 group;3:optimal medicated serum group;4:control serum group.Mean ± SD.n=5.#P < 0.05 vs 2 or 4.图5 Western blotting检测不同干预的A549/DDP细胞PI3K和Akt蛋白的表达
6 RT-PCR检测最佳含药血清对A549/DDP细胞PI3K和Akt mRNA表达的影响
最佳含药血清组与联合组的PI3K mRNA的表达水平与对照血清组比较,差异有统计学意义(P<0.05);LY294002组PI3K mRNA的表达水平与正常动物血清组比较,差异无统计学意义(P>0.05);Akt mRNA表达在最佳含药血清组和联合组均减少,与对照血清组比较,差异有统计学意义,与正常动物血清组比较,差异也有统计学意义(P<0.05),见表2。
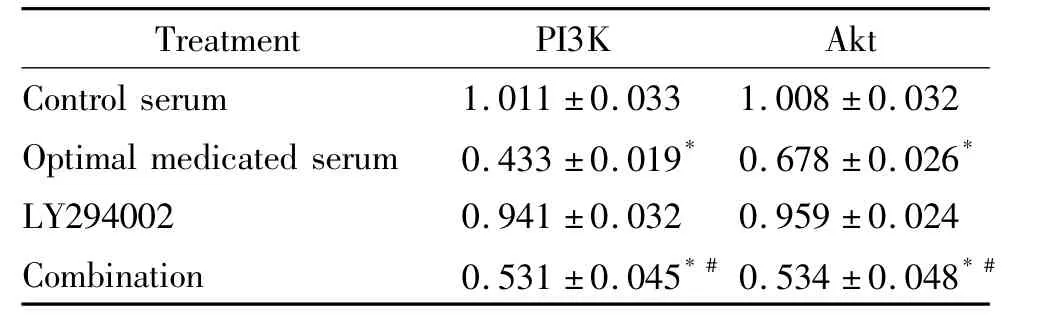
表2 各组A549/DDP细胞中PI3K和Akt mRNA表达水平比较Table 2.The mRNA expression levels of PI3K and Akt in the A549/DDP cells with different treatments(Mean±SD.n=5)
讨 论
补中益气汤由金元时期著名医家李东垣所创,由黄芪、炙甘草、人参、当归、陈皮、升麻、柴胡和白术八味中药组成,临床应用发现其可改善肺癌患者气短、咳嗽、咳血等症状,提高患者生存质量。既往药理研究表明方中含有的皂甙类、多糖类、黄酮类、生物碱、氨基酸及挥发油等,对多种肿瘤有不同程度的抑制作用,此外还有抗突变、调节免疫功能、耐缺氧、抑菌消炎等综合作用[3]。但补中益气汤对肺癌细胞抑制的作用机制以及通过何种途径改善顺铂的耐药作用却鲜有报道,本研究通过血清药理学的方法探讨补中益气汤对肺腺癌耐顺铂细胞株A549/DDP的逆转作用及其与顺铂联合作用时对PI3K/Akt信号通路的的干预作用。
血清药理学是中药药理体外研究较为科学的方法,本实验用不同剂量的补中益气汤灌服大鼠,在血药浓度达到稳定后取血清,以不同浓度的含药血清作用于A549/DDP细胞,通过MTT法筛选出10%中剂量含药血清作用48 h为最佳含药血清及最佳作用时间。通过MTT法测得A549/DDP细胞对顺铂的耐药指数为7.35,而对顺铂和最佳含药血清联合作用的耐药指数为3.76,提示补中益气汤可以提高A549/DDP细胞对顺铂的敏感性,补中益气汤参与了A549/DDP细胞抗顺铂耐药的逆转机制。
研究表明,顺铂对肺癌疗效降低的主要原因是产生了耐药性[6],PI3K/Akt通路激活后能够抑制肿瘤细胞的凋亡。研究表明,PI3K/Akt通路和肺癌顺铂耐药有关,文献报道在细胞水平上,有Akt过表达的人肺癌细胞对顺铂出现耐药,在肺腺癌细胞A549中,PI3K/Akt的过表达明显减弱A549细胞对顺铂的化疗敏感性[7];顺铂作用下人非小细胞肺癌细胞株NCI H460中的PI3K/Akt过表达,使抗凋亡蛋白Bcl-xL表达增加,p53通路激活延迟,导致肺癌细胞凋亡抑制对顺铂产生耐药[8]。本研究发现,补中益气汤可使A549/DDP细胞中PI3K蛋白和mRNA表达减少(P<0.05,与对照血清组比较),提示补中益气汤可通过抑制PI3K mRNA的表达而减少蛋白的表达量,其是在基因水平发挥逆转A549/DDP的耐顺铂作用。据文献[9]报道,在顺铂耐药人的肺癌细胞株中,抑制PI3K/Akt的表达会表现为对顺铂的敏感性增加,因此推断补中益气汤是通过增加肺癌耐药细胞A549/DDP对顺铂的敏感性而实现逆转作用的;LY294002是PI3K/Akt通路中广泛应用的PI3K抑制剂,能特异性地抑制PI3K p110亚单位的催化活性,使磷酸化Akt的表达下降,明显抑制生长和诱导凋亡,且其抑制作用呈剂量依赖性[10]。本研究应用LY294002后,LY294002组 PI3K、Akt蛋白和 mRNA的表达与对照血清组比较差异没有统计学意义(P>0.05),而联合组的PI3K、Akt蛋白和mRNA的表达与对照血清组比较明显降低(P<0.05),提示LY294002抑制PI3K p110亚单位的催化活性是在蛋白水平上进行的,不影响PI3K mRNA的表达,也不影响总Akt蛋白和mRNA的表达;最佳含药血清可减少PI3K、Akt mRNA和蛋白的表达。Akt是PI3K/Akt通路中该信号转导通路的活性中心,它能通过磷酸化下游的多种底物如caspase-9、Bad、survivin等促进细胞凋亡[11-12]。究竟补中益气汤是对PI3K的抑制导致Akt表达的减少还是药物也同时作用于Akt的位点以及对下游因子是否有作用,都有赖于进一步的研究。
综上所述,本研究表明补中益气汤干预A549/DDP细胞耐顺铂作用是通过PI3K/Akt信号通路实现的,补中益气汤通过减少 PI3K的表达而降低A549/DDP细胞的耐药指数,增加A549/DDP细胞对顺铂的敏感性,干预或调整着A549/DDP细胞的耐药性。
[1] 岳文涛,王小敏,王 玥.PI3K/Akt/mTOR信号转导途径与非小细胞肺癌的关系[J].中国肺癌杂志,2009,12(4):312-315.
[2] 郭其森.非小细胞肺癌内科治疗的现状[J].中华肿瘤防治杂志,2009,16(10):721-725.
[3] 季宇彬.中药复方化学与药理[M].北京:人民卫生出版社,2003:315-322.
[4] 吴翠芳,曾 嵘,周于露,等.芦荟大黄素对人肺腺癌细胞顺铂多药耐药性的逆转作用[J].中国医院药学杂志,2008,28(13):1061-1063.
[5] 王 玲,刘世昆,周于禄,等.华蟾素对人乳腺癌细胞阿霉素多药耐药性的逆转作用[J].中国药理学通报,2007,23(5):677-680.
[6] 曹 勇,李 亮,钟安朴,等.补肾化瘀解毒方药物血清对肺癌A549/DDP细胞的耐药逆转及MRP表达的影响[J].中国病理生理杂志,2008,24(3):591-593.
[7] Schmidt M,Hovelmann S,Beckers TL .A novel form of constitutively active farnesylated Akt1 prevents mammary epithelial cells from anoikis and suppresses chemotherapy induced apoptosis[J].Br J Cancer,2002,87(8):924-932.
[8] Hovelmann S,Beckers TL,Schmidt M.Molecular alterations in apoptotic pathways after PKB/Akt-mediated chemoresistance in NCI H460 cells[J].Br J Cancer,2004,90(12):2370-2377.
[9] Liu LZ,Zhou XD,Qian G,et al.AKT1 amplification regulates cisplatin resistance in human lung cancer cells through the mammalian target of rapamycin/p70S6K1 pathway[J].Cancer Res,2007,67(13):6325-6332.
[10]方海生,马 晔,刘 柳,等.LY294002抑制 PI3K-Akt信号通路对人甲状腺癌细胞的影响[J].南京医科大学学报,2011,31(6):18-22.
[11] Page C,Lin HJ,Jin Y,et al.Overexpression of Akt/AKT can modulate chemotherapy-induced apoptosis[J].Anticancer Res,2000,20(1A):407-416.
[12]曾 葭,刘成成,祝爱珍,等.盐霉素抑制人肺腺癌耐顺铂细胞株A549/DDP增殖及诱导凋亡的机制[J].中国病理生理杂志,2012,28(5):834-838.

