Hsa-miR-150过表达诱导弥漫大B淋巴瘤细胞系OCI-Ly10再分化*
严金海,王志强,韩西群,陈少红,周新华,简文静,葛娟,赵彤
(南方医科大学南方医院病理科,基础医学院病理学系,广东广州 510515)
Hsa-miR-150过表达诱导弥漫大B淋巴瘤细胞系OCI-Ly10再分化*
严金海,王志强,韩西群,陈少红,周新华,简文静,葛娟,赵彤△
(南方医科大学南方医院病理科,基础医学院病理学系,广东广州 510515)
目的:探究hsa-miR-150过表达诱导弥漫大B淋巴瘤细胞系OCI-Ly10再分化的机制。方法:运用real-time PCR检测hsa-miR-150在永生化CD19+B细胞和OCI-Ly10细胞中的表达,利用Western blotting和免疫荧光细胞化学检测hsa-miR-150靶基因c-myb的表达;通过LipofectamineTM2000脂质体法将含有重组慢病毒质粒的病毒上清转染OCI-Ly10细胞(Ly10-control组和Ly10-miR-150组);对新构建的细胞亚系,通过MTT法检测细胞增殖能力,流式细胞术检测细胞周期及凋亡;运用real-time PCR、免疫荧光细胞化学和Western blotting检测Ly10-control 和Ly10-miR-150的B细胞分化相关基因及c-Myb的表达;利用干扰片段干扰OCI-Ly10细胞c-myb表达后,运用real-time PCR和Western blotting检测干扰效率及干扰后转录调节因子BCL6和浆细胞分化开关蛋白PRDM1的表达。结果:(1)CD19+B淋巴细胞的hsa-miR-150表达量明显高于OCI-Ly10细胞(P<0.05);c-Myb在OCI-Ly10细胞中表达较强,而在CD19+B淋巴细胞表达较弱。(2)OCI-Ly10细胞经转染hsa-miR-150后,B细胞分化相关基因的表达都明显发生了变化,B细胞特异性激活蛋白(PAX5)和BCL6表达下调(P<0.05);干扰素调节因子4(IRF4)、PRDM1和X盒结合蛋白1(XBP1)的表达上调(P<0.05);和对照组相比,c-Myb在Ly10-miR-150细胞中表达明显下调(P<0.05)。(3)干扰OCI-Ly10细胞c-myb表达后,BCL6表达明显下调,而PRDM1表达明显上调。结论:(1)hsa-miR-150过表达对OCI-Ly10细胞抑制增殖和诱导凋亡作用非常明显。(2)过表达hsa-miR-150可诱导该瘤细胞向末端B细胞方向分化,作用机制可能与下调其靶基因c-myb的表达有关。
弥漫大B细胞淋巴瘤;分化;Hsa-miR-150;基因,c-myb
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一种高度异质性恶性淋巴瘤,约占成人非霍奇金淋巴瘤30%~40%,近年来发病率逐年升高[1]。许多证据表明淋巴瘤的发生是由于正常淋巴细胞分化紊乱或分化阻滞的结果[2]。研究发现miRNA在B细胞分化过程中发挥重要作用,Zhou等[3]研究发现hsa-miR-150对B细胞的发育分化至关重要,随着B细胞发育的不断成熟,hsa-miR-150的表达量逐步升高。有文献报道与正常B细胞相比,在不同亚类DLBCL细胞系中hsa-miR-150普遍低表达[4]。本课题组前期研究发现hsa-miR-150在伯基特淋巴瘤细胞株中明显低表达,再表达hsamiR-150后可以通过调控其靶基因c-myb诱导EB病毒阳性伯基特淋巴瘤细胞株向末端B细胞方向分化[5]。那么在DLBCL细胞系中,hsa-miR-150的表达紊乱是否与瘤细胞分化相关呢?本研究通过构建含有hsa-miR-150重组慢病毒质粒的病毒上清转染的DLBCL细胞系OCI-Ly10,探讨hsa-miR-150与DLBCL细胞系OCI-Ly10分化的关系,为后续研究hsa-miR-150在侵袭性B细胞淋巴瘤分化的作用机制提供更多信息。
材料和方法
1 细胞系来源和培养
OCI-Ly10细胞是人弥漫大B淋巴瘤细胞株,由复旦大学附属肿瘤医院惠赠[6]。CD19+B细胞是EB病毒转化的永生化B淋巴细胞,为本实验室保存。细胞在含10%胎牛血清的RPMI-1640培养基中,置于37℃、5%CO2培养箱中培养,取对数期、生长状态良好的细胞进行后续实验。
2 主要试剂
鼠抗人转录调节因子BCL6抗体、鼠抗人干扰素调节因子4(interferon regulatory factor 4,IRF4)抗体、免疫荧光Ⅱ抗和Western blottingⅡ抗均购自北京中杉金桥生物公司;兔抗c-Myb单抗购自Abcam。MTT为广州市威佳科技有限公司产品。DMSO和RPMI-1640、IMDM培养基均购自吉诺生物医药技术有限公司。胎牛血清为杭州四季青生物工程材料有限公司产品。miRNA快速提取试剂盒购自BioTeke。miRNA逆转录和real-time PCR试剂盒All-in-OneTMmiRNA Q-PCR Detection Kit购自Genecopoeia。DAB显色试剂盒购自武汉博士德生物工程有限公司。蛋白提取试剂盒、蛋白质浓度测定试剂盒购自上海申能博彩生物科技有限公司。PVDF膜购自Millipore。其它生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成,见表1。靶向c-myb的siRNA序列(5’-AAGCTGAAGAAGCTGGTGGAA-3’)由Sigma公司合成。

表1 引物序列Table 1.Sequences of the primers
3 主要方法
3.1 Real-time PCR采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照TaKaRa试剂盒实验操作说明进行real-time PCR,总反应体积25.0 μL,其中Premix Taq 12.5 μL,cDNA 2.0 μL,上、下游引物各0.5 μL,去RNA酶水9.5 μL。扩增条件为:37℃逆转录15 min,85℃灭活5 s;95℃10 min;95℃10 s,60℃20 s,72℃34 s,40个循环。7500荧光定量PCR仪(Ambion)上机,反应结束后,立即进行扩增曲线和融解曲线分析,由公式2-ΔΔCt计算各目的基因与内参照基因相对表达量。实验重复3次。
3.2 Western blotting和免疫荧光细胞化学染色离心收集对数生长期状态良好细胞。采用RIPA裂解液提取细胞总蛋白,用BCA法测定蛋白质浓度,进行10%SDS-PAGE,100 mA电转PVDF膜2 h,5%脱脂奶粉室温封闭1.5 h。用Ⅰ抗稀释液按1∶10 000稀释c-myb抗体,1∶500稀释β-actin抗体,抗体和PVDF膜4℃孵育过夜。1∶5 000稀释山羊抗兔lgG/辣根酶标记Ⅱ抗和1∶5 000稀释山羊抗鼠IgG/辣根酶标记Ⅱ抗,孵育1 h,增强化学发光显影。共聚焦显微镜免疫荧光细胞化学染色操作步骤:收集悬浮培养细胞后洗涤并用4%多聚甲醛室温固定20~30 min。每孔加入Triton X-100 150 μL破膜;10%羊血清(150 μL/well)封闭20 min,弃去上清,不洗;用Ⅰ抗稀释液按1∶100稀释兔抗c-Myb单抗;1∶100稀释兔抗BCL6多克隆抗体;1∶100稀释鼠抗PRDM1单抗,4℃冰箱过夜,次日室温孵育30 min。根据Ⅰ抗属性,每孔分别加入羊抗兔Ⅱ抗(TRITC标记)和羊抗鼠Ⅱ抗(TRITC标记),稀释比例均为1∶100,室温避光孵育1 h;DAPI复染;荧光共聚焦显微镜(Olympus)观察,每组细胞取5个不同高倍镜视野观察并计数。
3.3 Hsa-miR-150慢病毒载体的构建及转染构建的pEZX-miR-150-EGFP重组慢病毒载体送Invitrogen公司测序,结果表明,所获得的has-miR-150前体基因及其侧翼序列与GenBank所公布的相应序列相符,无碱基缺失及错误。将测序结果输入PubMed数据库,运用BLAST程序进行比对分析,与GenBank所公布的相应序列has-miR-150前体基因及其侧翼序列完全一致。将包膜质粒(pMD2.G)、包装结构质粒(psPAX2)和目的基因重组质粒(感染组含有pEZX-hsa-miR-150-EGFP,即含有hsa-miR-150病毒和EGFP;未感染组仅含pEZX-EGFP,即仅含EGFP)3种质粒,通过LipofectamineTM2000共同转染至包装细胞293FT中,共感染24 h,换新鲜培养基。感染后每天倒置荧光显微镜下观察各组细胞EGFP表达情况,并计算EGFP阳性细胞的百分比。收集病毒上清;将含有重组慢病毒质粒(感染组和未感染组)的病毒上清转染OCI-Ly10细胞株,分别命名为Ly10-control和Ly10-miR-150组。
3.4 MTT比色法和流式细胞术将对数生长期的Ly10-miR-150和Ly10-control两组细胞悬液分别接种到96孔板中,每种细胞每天设置5个复孔,每孔接种细胞约2×103个,观察7 d。37℃、5%CO2培养箱中培养6 h。每孔加20 μL MTT,继续培养4~5 h,将细胞培养液上清弃去,每孔加入200 μL DMSO,摇床混匀约10 min;以生长时间为横坐标,连续检测7 d,以波长570 nm处吸光度(A)为纵坐标绘制细胞生长曲线。流式细胞术检测细胞增殖,收取对数生长期的Ly10-control和Ly10-miR-150细胞,进行PI染色:加无水乙醇固定30 min,用冷PBS离心洗涤1次,去上清后加入DNA染液室温30 min,上机,计算细胞增殖中各期的百分数。流式细胞术检测细胞凋亡根据Hoechst 33342/PI双染试剂盒操作要求进行。
3.5 mRNA干扰取1 OD的干扰片段加250 μL DEPC水重悬,配成浓度为20 μmol/L,分装后-20℃避光保存;取对数期、生长状态良好的实验细胞,细胞计数,用RPMI-1640培养基调整至1×109/L,每孔1.5 mL接种于6孔板;实验分为实验组(c-myb siRNA,即含干扰片段)、空白对照组(Negative siRNA,即不含干扰片段),每组设3个复孔;转染过程参照LipofectamineTM2000说明书:先分别将10 μL LipofectamineTM2000和250 μL Opti-MEM培养基混合配成A液,室温孵育5 min,再加入到配好的B液中(10 μL实验干扰片段稀释液和空白对照组分别与250 μL Opti-MEM培养基混合)配制转染混合液,十字法混匀,分别加至实验细胞;48 h后收细胞提取总RNA或者蛋白。
4 统计学处理
采用SPSS 13.0统计软件分析。数据以均数±标准差(mean±SD)表示。组间比较采用两独立样本t检验或两独立样本非参数检验。以P<0.05为差异有统计学意义。
结果
1 Hsa-miR-150和c-Myb在CD19+B及OCI-Ly10细胞中的表达
Real-time PCR结果显示CD19+B淋巴细胞的hsa-miR-150表达明显高于OCI-Ly10细胞(P<0.01),见图1A。Western blotting和免疫荧光细胞化学的结果都显示c-Myb在OCI-Ly10细胞中表达较高,而在CD19+B淋巴细胞中表达较低,见图1B、C。
2 转染OCI-Ly10细胞48 h后2组细胞hsa-miR-150的表达
转染48 h后,与Ly10-control组(1.00±0.00)相比,Ly10-miR-150组中hsa-miR-150表达量(44.23± 0.81)明显增高(P<0.05)。
3 转染OCI-Ly10细胞48 h后2组细胞的增殖、细胞周期和凋亡
转染48 h后,MTT比色法结果显示Ly10-miR-150细胞的增殖能力明显低于Ly10-control细胞(P<0.05),见图2A;流式细胞术检测Ly10-control 和Ly10-miR-150细胞的细胞周期,计算各组细胞的增殖率[(S期+G2期)%],Ly10-miR-150细胞的增殖率明显低于Ly10-control细胞(P<0.05),见图2B、C;Ly10-miR-150细胞的凋亡率明显高于Ly10-control细胞(P<0.05),见图2D。
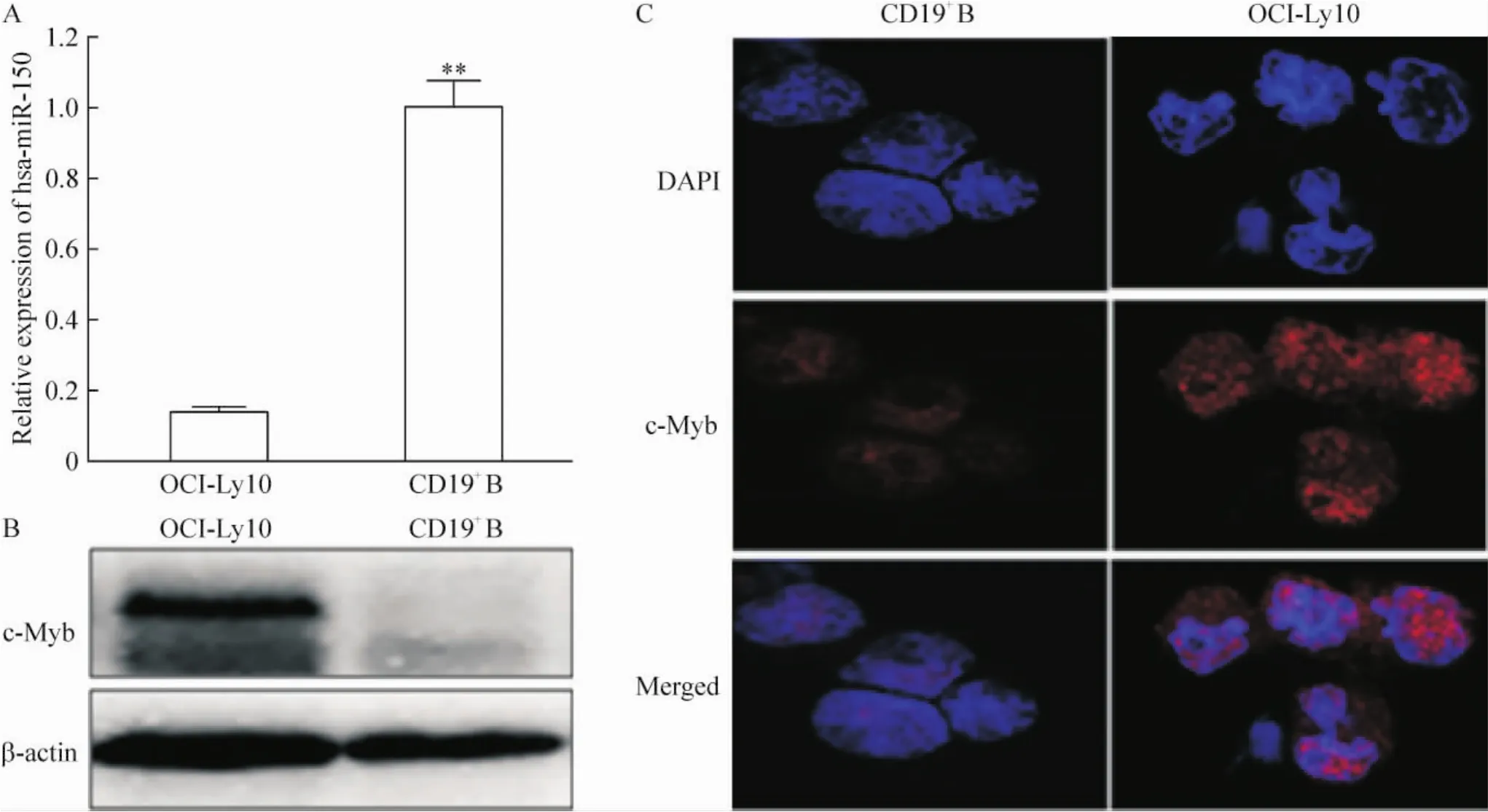
Figure 1.Expression of hsa-miR-150 in OCI-Ly10 and CD19+B cell lines detected by real-time PCR(A)and expression of c-Myb protein in the 2 cell lines detected by Western blotting(B)and immunofluorescence cytochemistry(C).Mean±SD.n= 3.**P<0.01 vs OCI-Ly10.图1 Hsa-MiR-150和c-Myb在CD19+B及OCI-Ly10细胞中的表达

Figure 2.The cell proliferation detected by MTT assay(A)and flow cytometry(B,C),and the cell apoptosis detected by flow cytometry(D)48 h after transfection.Mean±SD.n=5.*P<0.05 vs Ly10-control.图2 转染48 h后检测各细胞亚系的增殖和凋亡
4 转染OCI-Ly10细胞48 h后2组细胞的B细胞分化相关基因和c-Myb的表达
Real-time PCR检测结果发现,与Ly10-control细胞相比,Ly10-miR-150细胞B细胞分化相关基因的表达发生了明显变化,PAX5和BCL6表达明显下调(P<0.05),而IRF4、PRDM1和XBP1的表达显著上调(P<0.05),见图3;real-time PCR、Western blotting及免疫荧光细胞化学检测2组细胞c-Myb的表达,与Ly10-control细胞相比,Ly10-miR-150细胞中c-Myb表达明显下调,差异有统计学意义(P<0.05),见图4。
5 干扰OCI-Ly10细胞c-myb表达48 h后B细胞分化相关基因的表达
干扰片段干扰OCI-Ly10细胞c-myb表达48 h后,c-myb mRNA表达明显下调(P<0.05),见图5A。Real-time PCR和Western blotting结果显示,干扰OCI-Ly10细胞c-myb表达48 h后BCL6表达明显下调,而PRDM1表达明显上调(P<0.05),见图5B、C。
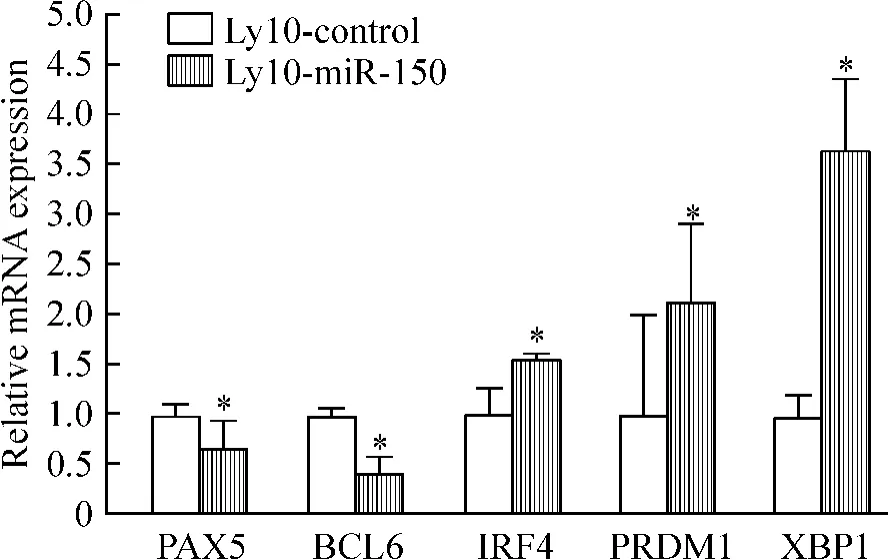
Figure 3.The mRNA expression of B-lymphocyte differentiationrelated genes 48 h after transfection.Mean±SD.n= 5.*P<0.05 vs Ly10-control.图3 转染48 h后检测各细胞亚系的B细胞分化相关基因的表达
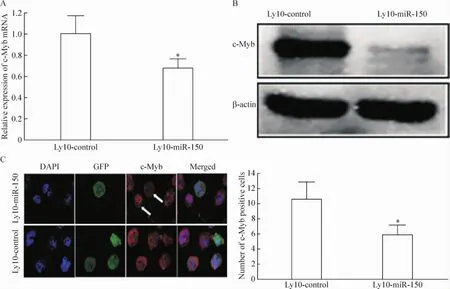
Figure 4.Expression of c-Myb detected by real-time PCR(A),Western blotting(B)and immunofluorescence cytochemistry(C)48 h after transfection.Mean±SD.n=5.*P<0.05 vs Ly10-control.图4 转染48 h后检测各细胞亚系c-Myb的表达
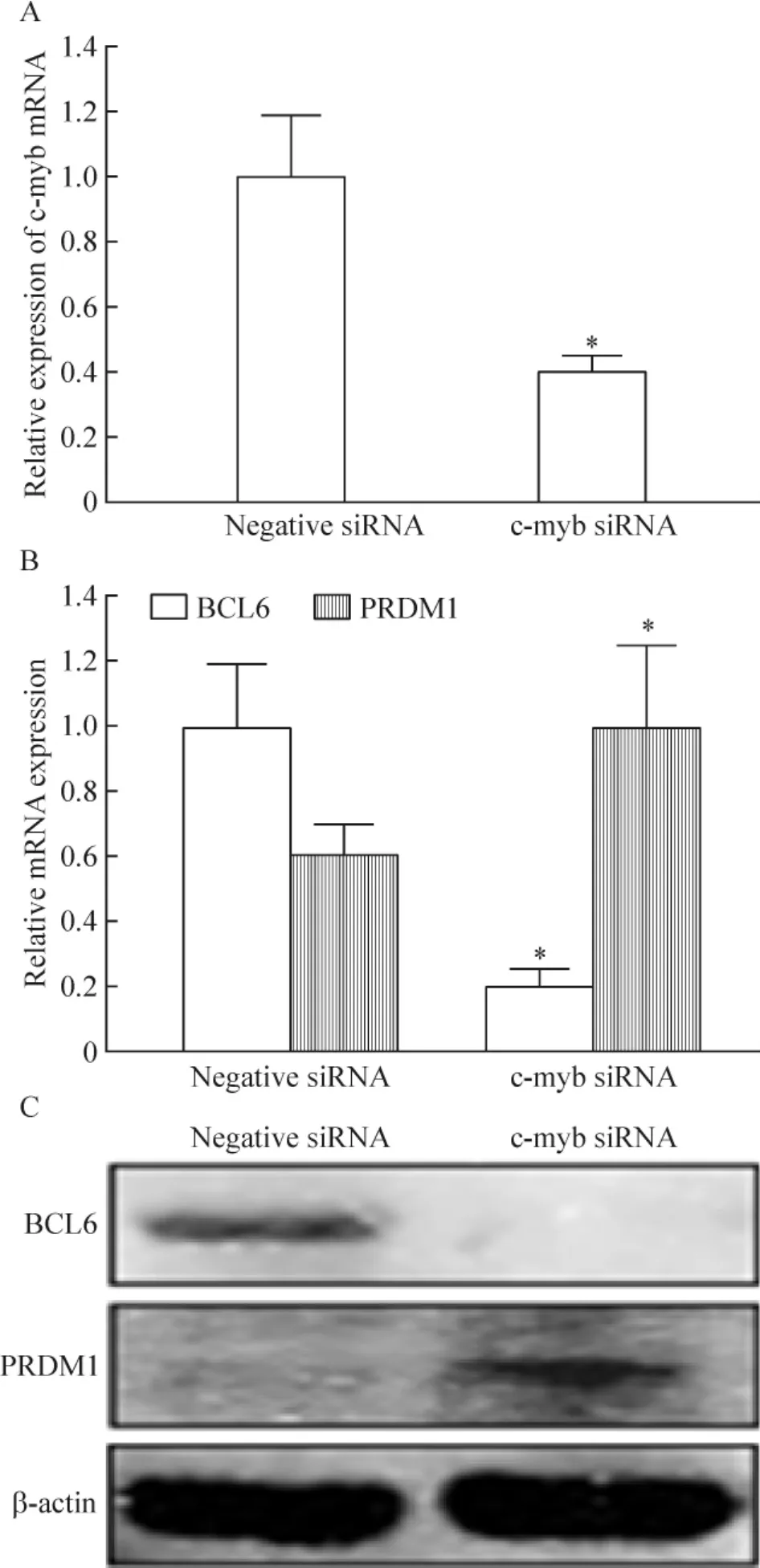
Figure 5.Expression of c-myb mRNA detected by real-time PCR (A)and expression of BCL6 and PRDM1 detected by real-time PCR(B)and Western blotting(C)48 h after interfernce.Mean±SD.n=3.*P<0.05 vs Negative siRNA.图5 干扰48 h后检测c-myb mRNA表达及BCL6和PRDM1的表达
讨论
1 Hsa-miR-150过表达对OCI-Ly10细胞增殖、细胞周期和凋亡的影响
miRNA是一类内源性RNA小分子,miRNA具有高度保守性、时序性、组织细胞特异性,能在转录后水平调控基因的表达,主要作为基因表达的负性调控因子[7]。本研究发现hsa-miR-150在DLBCL细胞系OCI-Ly10细胞中表达很弱,甚至基本不表达。为进一步探究hsa-miR-150的生物学功能,我们构建了稳定表达hsa-miR-150的DLBCL细胞亚系Ly10-miR-150,先运用MTT法和流式细胞术检测新构建的细胞亚系的增殖能力、细胞周期及凋亡。结果发现上调hsa-miR-150的表达,OCI-Ly10细胞的增殖能力明显下降,凋亡指数显著增加,证实hsa-miR-150具有明显抑制弥漫大B淋巴瘤细胞系OCI-Ly10增殖、促进该瘤细胞凋亡的作用。
2 Hsa-miR-150过表达诱导OCI-Ly10细胞向末端B细胞方向分化
许多证据表明淋巴瘤的发生是由于正常淋巴细胞分化紊乱或分化阻滞的结果[2]。有研究证实hsamiR-150的表达水平与造血细胞的分化关系非常密切,尤其是B细胞的分化发育,随着B淋巴细胞从祖B细胞向成熟B细胞方向分化发育,hsa-miR-150表达水平逐步升高[8]。如果我们纠正该弥漫大B淋巴瘤细胞系OCI-Ly10中hsa-miR-150的紊乱表达是否也对其瘤细胞分化产生影响呢?为此,我们对新构建的细胞亚系检测了几个与B细胞分化密切相关基因的表达。PAX5是一个非常重要的转录因子,在B细胞的分化中起非常重要的作用;PAX5在B细胞分化成熟过程中持续表达,但在浆细胞(末端B细胞)阶段不表达,PAX5可以通过抑制PRDM1和XBP1的表达,阻止B细胞向浆细胞方向分化,维持B细胞的特征[9];在某些淋巴瘤中,PAX5异常持续高表达有可能阻止了B细胞向浆细胞方向分化,导致B细胞分化阻滞或紊乱,促进肿瘤的发生[10]。BCL6是一种转录抑制因子,它可以调控生发中心B细胞的分化,是生发中心B细胞的重要标记[11];BCL6通过抑制PRDM1的表达,阻止生发中心B细胞向浆细胞方向分化[12];在部分DLBCL病例中,可以检测到BCL6对p53的抑制,阻止肿瘤细胞凋亡,说明BCL6的持续高表达与淋巴瘤的发生也存在着密切关系[13]。IRF4是干扰素调控因子家族中的重要成员,它在调控B细胞向浆细胞分化中起着非常重要的作用[14];在正常淋巴结的生发中心,IRF4和BCL6的表达相互排斥。也就是说IRF4可以抑制BCL6的表达,促使B细胞向浆细胞方向分化。XBP1是除PRDM1外另一个重要的浆细胞的免疫分化标记,随着浆细胞的分化成熟,XBP1的表达量逐步升高; PRDM1的表达可以进一步促进XBP1的表达上调,进而促使B细胞向浆细胞方向分化[10]。总之,PAX5 和BCL6抑制B细胞向末端B细胞方向分化,而IRF4、XBP1和PRDM1促进B细胞向末端B细胞方向分化。我们的研究发现在OCI-Ly10细胞上调hsamiR-150后,B细胞分化相关基因PAX5、BCL6、IRF4、PRDM1和XBP-1的表达水平都发生了明显变化:PAX5和BCL6表达水平的下调打破了肿瘤细胞的分化阻滞状态;而IRF4、PRDM1和XBP-1的表达水平上调,促进了OCI-Ly10细胞朝末端B细胞方向分化。
有研究在大鼠动物模型体内发现,hsa-miR-150是通过负性调节c-Myb表达来控制pro-B向pre-B细胞分化的[8]。本课题组前期实验结果中也发现hsa-miR-150可以通过调控c-Myb诱导人类EB病毒阳性伯基特淋巴瘤细胞向末端B细胞方向分化[5]。那么在本实验中hsa-miR-150是否是通过下调其靶基因c-myb从而打开分化开关蛋白PRDM1、诱导DLBCL细胞系OCI-Ly10细胞再分化的呢?本实验结果发现c-Myb在OCI-Ly10细胞过表达hsa-miR-150后无论在mRNA水平还是蛋白水平,其表达水平都明显下调。那么OCI-Ly10细胞分化基因的明显改变是否由于c-Myb下调引起的呢?因此,我们利用干扰片段干扰了OCI-Ly10细胞中c-myb的表达,然后在mRNA和蛋白水平分别检测了2个最重要的分化免疫标记BCL6和PRDM1的表达。在cmyb干扰48 h后的OCI-Ly10细胞,BCL6的表达显著下调,同时分化开关蛋白PRDM1的表达显著上调,呈现了与过表达hsa-miR-150相似的结果。这表明过表达hsa-miR-150可以诱导OCI-Ly10细胞朝末端B细胞方向再分化,其机制可能与下调其靶基因c-myb的表达有关。
综上所述,hsa-miR-150对DLBCL细胞系OCILy10细胞的增殖抑制和诱导凋亡作用非常显著,过表达hsa-miR-150可以诱导该瘤细胞朝末端B细胞方向再分化,其机制可能与下调其靶基因c-myb的表达有关。本研究结果为后续探究hsa-miR-150在侵袭性B细胞淋巴瘤分化中的作用机制提供了更多的信息。
[1]Balague O,Mozos A,Martinez D,et al.Activation of the endoplasmic reticulum stress-associated transcription factor X box-binding protein-1 occurs in a subset of normal germinal-center B cells and in aggressive B-cell lymphomas with prognostic implications[J].Am J Pathol,2009,174 (6):2337-2346.
[2]Mishra PJ,Merlino G.MicroRNA reexpression as differentiation therapy in cancer[J].J Clin Invest,2009,119 (8):2119-2123.
[3]Zhou B,Wang S,Mayr C,et al.miR-150,a microRNA expressed in mature B and T cells,blocks early B cell development when expressed prematurely[J].Proc Natl Acad Sci U S A,2007,104(17):7080-7085.
[4]Malumbres R,Sarosiek KA,Cubedo E,et al.Differentiation stage-specific expression of microRNAs in B lymphocytes and diffuse large B-cell lymphomas[J].Blood,2009,113(16):3754-3764.
[5]Chen SH,Wang ZQ,Dai XZ,et al.Re-expression of microRNA-150 induces EBV-positive Burkitt lymphoma differentiation by modulating c-Myb in vitro[J].Cancer Sci,2013,104(7):826-834.
[6]张铁成,周晓燕,于宝华,等.AKT蛋白激酶活化对弥漫性大B细胞淋巴瘤细胞生物学行为影响的体外研究[J].中华病理学杂志,2007,36(5):318-323.
[7]Auer RL.The coming of age of microRNA for B cell lymphomas[J].Histopathology,2011,58(1):39-48.
[8]Xiao C,Calado DP,Galler G,et al.MiR-150 controls B cell differentiation by targeting the transcription factor c-Myb[J].Cell,2007,131(1):146-159.
[9]Kallies A,Hasbdd J,Fairfax K,et al.Initiation of plasma cell differeraiation is independent of the transcription factor Blimp-1[J].Immunity,2007,26(5):555-566.
[10]Calame KL,Lin KI,Tunyaplin C.Regulatory mechanisms that determine the development and function of plasma cells[J].Annu Rev Immunol,2003,21:205-230.
[11]Bodoor K,Matalka I,Hayaineh R,et al.Evaluation of BCL-6,CD10,CD138 and MUM-1 expression in diffuse large of B-cell lymphoma patients:CD138 is a marker of poor prognosis[J].Asian Pac J Cancer Prev,2012,13 (7):3037-3046.
[12]Martinez MR,Corradin A,Klein U,et al.Quantitative modeling of the terminal differentiation of B cells and mechanisms of lymphomagenesis[J].Proc Natl Acad Sci U S A,2012,109(7):2672-2677.
[13]Phan RT,Dalla-Favera R.The BCL6 proto-oncogene suppresses p53 expression in germinal-centre B cells[J].Nature,2004,432(7017):635-639.
[14]Bollig N,Brüstle A,Kellner K,et al.Transcription factor IRF4 determines germinal center formation through follicular T-helper cell differentiation[J].Proc Natl Acad Sci U S A,2012,109(22):8664-8669.
Over-expression of hsa-miR-150 induces re-differentiation of diffuse large B-cell lymphoma cell line OCI-Ly10
YAN Jin-hai,WANG Zhi-qiang,HAN Xi-qun,CHEN Shao-hong,ZHOU Xin-hua,JIAN Wen-jing,GE Juan,ZHAO Tong
(Department of Pathology,Nanfang Hospital,Department of Pathology,School of Basic Medical Science,Southern Medical University,Guangzhou 510515,China.E-mail:zhaotongketizu@126.com)
AIM:To investigate the mechanism that over-expression of hsa-miR-150 induces the re-differentiation of diffuse large B-cell lymphoma cell line OCI-Ly10.METHODS:The expression level of hsa-miR-150 in CD19+B and OCI-Ly10 cell lines was detected by real-time PCR.The expression level of c-Myb was detected by Western blotting and immunofluorescence cytochemistry methods.Lentiviral supernatant containing recombinant plasmids was transfected into OCI-Ly10 cells by LipofectamineTM2000 and named Ly10-control and Ly10-miR-150.The biological functions of the 2 cell sublines were identified by MTT assay.The cell cycle and apoptotic rates were detected by flow cytometry.The expression levels of B-lymphocyte differentiation-related genes and c-myb in Ly10-control and Ly10-miR-150 cells were detected by real-time PCR and Western blotting.When c-myb was interfered in by interference fragment in OCI-Ly10 cells,the interference efficiency and the expression levels of BCL6 and PRDM1 were detected by real-time PCR and Western blotting.RESULTS:The expression level of hsa-miR-150 in CD19+B cells was significantly higher than that in OCI-Ly10 cells.The expression level of c-Myb in OCI-Ly10 cells was higher than that in CD19+B cells.The expression levels of B-lymphocyte differentiation-related genes were changed significantly in OCI-Ly10 cells after transfected with hsa-miR-150.The expression levels of PAX5,BCL6 and c-Myb in Ly10-miR-150 cells were lower than those in Ly10-control cells,but the expression levels of IRF4,PRDM1 and XBP1 were higher than those in Ly10-control cells.The expression level of BCL6 waslower and PRDM1 was higher after interference.CONCLUSION:Hsa-miR-150 plays a significant role in inhibiting proliferation and inducing apoptosis of OCI-Ly10 cells.The mechanism that over-expression of hsa-miR-150 induces OCI-Ly10 cell differentiation toward terminal B cells may be related to the down-regulation of c-myb.
Diffuse large B-cell lymphoma;Differentiation;Hsa-miR-150;Genes,c-myb
R329.21
A
10.3969/j.issn.1000-4718.2014.02.006
1000-4718(2014)02-0226-07
2013-10-11
2013-12-23
国家自然科学基金资助项目(No.81272634)
△通讯作者Tel:020-61648228;E-mail:zhaotongketizu@126.com

