新生大鼠心肌成纤维细胞培养方法的比较*
孙刚,薛睿聪,刘晨,董吁钢
(中山大学1附属第一医院心血管医学部,2卫生部辅助循环重点实验室,广东广州 510080)
新生大鼠心肌成纤维细胞培养方法的比较*
孙刚,薛睿聪,刘晨,董吁钢△
(中山大学1附属第一医院心血管医学部,2卫生部辅助循环重点实验室,广东广州 510080)
目的:建立并比较新生大鼠心肌成纤维细胞的培养方法。方法:分别通过胶原酶+胰酶消化法和胰酶消化法对新生大鼠心肌组织进行消化,利用贴壁时间差分离心肌细胞和心肌成纤维细胞,然后对收集的心肌成纤维细胞进行形态、纯度及对药物反应方面的检测。结果:在细胞形态和纯度方面,2种方法收集的心肌成纤维细胞没有明显差异,但用胶原酶+胰酶消化法可以获得更多数量的心肌细胞;在药物反应方面,采用胰酶消化法获得的心肌成纤维细胞比胶原酶+胰酶消化法具有更强的增殖能力。结论:采用胶原酶+胰酶消化法和胰酶消化法可以获得相同形态和纯度的心肌成纤维细胞,但是采用胰酶消化法获得的心肌成纤维细胞对药物具有更强的增殖反应能力。
心肌成纤维细胞;胶原酶;胰酶
心肌纤维化是各种心血管疾病发生、发展到一定阶段的共同病理改变,是心肌重构的主要表现之一,而心肌成纤维细胞在这一过程中发挥着极其重要的作用。心肌成纤维细胞占整个心脏体积的25%,但数目占整个心脏细胞总数的60%~70%[1],它不仅提供了心肌细胞赖以生存的结构支架,而且还赋予心肌组织某些生理和病理学上的特征,因此,对心肌成纤维细胞的研究也受到越来越多的重视[2-4]。本研究应用血管紧张素II(angiotensinⅡ,AngⅡ)作为刺激因素[5-6],对目前常用的2种心肌成纤维细胞的培养方法进行比较,为基础实验心肌成纤维细胞的培养和研究提供了一定的依据。
材料和方法
1 动物
出生1~2 d的SD乳鼠(清洁级,由中山大学实验动物中心提供)。
2 试剂
DMEM/F12培养基、胎牛血清(fetal bovine serum,FBS)和D-Hanks液购于HyClone;0.25%胰蛋白酶(含EDTA)和I型胶原酶购自Gibco;抗vimentin、抗von Willebrand factor、抗desmin和抗Ⅰ型胶原蛋白α1链(collagen type I alpha 1 chain,Col1A1)抗体购自Santa Cruz Biotechnology;Ang II购自Anaspec;BCA Protein Assay Kit购于Pierce;Cell Counting Kit-8(CCK-8)购于Dojindo Molecular Technology;5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine,EdU)试剂盒购自Ribobio;Trizol试剂盒购自Life Technologies。
3 主要方法
3.1 心肌成纤维细胞的培养取1~2 d的新生SD乳鼠,乙醇消毒后开胸挤出心脏,去除心底结缔组织后将心室剪成大小约1 mm×1 mm×1 mm的小块,以Simpson等[7]的方法为基础加于改进,分别用胶原酶+胰酶消化法和胰酶消化法对心室组织团块进行消化。对于胶原酶+胰酶法,将配制好的0.05%I型胶原酶加入心肌组织,置于37℃恒温槽振荡约2 h,取出后倒掉胶原酶,加入0.125%胰酶放入37℃水浴箱孵育5 min,清洗并适当吹散细胞,收集细胞至含血清的培养基中,反复2~3次,直至细胞团块消失;离心(1 000 r/min)后收集细胞,加入含血清培养基置于37℃、5%CO2培养箱中贴壁90 min[8];对于胰酶消化法,将0.25%胰酶加入心肌组织团块中,37℃水浴箱振荡约20 min,取出后吹散并收集细胞,放入培养箱中贴壁90 min;根据心肌细胞和心肌成纤维细胞贴壁时间的不同(心肌成纤维细胞贴壁快,较易附于皿底),收集贴壁细胞并加入含血清培养基继续培养,待细胞融合后传代用于实验。
3.2 心肌成纤维细胞纯度的鉴定我们采用免疫荧光技术对心肌成纤维细胞的纯度进行鉴定。细胞爬片待其达到约80%融合后,进行4%多聚甲醛固定,0.25%Triton破膜及山羊血清封闭后,加入Ⅰ抗(抗vimentin、抗von Willebrand factor和抗desmin抗体),4℃过夜封闭;避光条件下加入Ⅱ抗孵育,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染细胞核后置于荧光显微镜下观察。
3.3 CCK-8检测细胞的数目变化将细胞接种于96孔培养板,待其达到约80%融合时加入Ang II孵育24 h,后加入CCK-8工作液孵育3~4 h,置于450 nm波长下测细胞吸光度(A)。
3.4 EdU检测细胞DNA的合成将细胞接种于24孔培养板,待其达到约80%融合后加入Ang II孵育24 h,将EdU工作液以50 μmol/L的浓度加入细胞中孵育3 h,冲洗后,对细胞进行固化、破膜和染色,避光条件下对DNA进行染色,最后置于荧光显微镜下进行观察。
3.5 Real-time PCR采用Trizol法提取细胞的总RNA,分光光度法测定其浓度。双链cDNA的合成采用M-MLV逆转录体系完成,总反应体积为20 μL,其中RNA为1 μg(用无核酶水配成10 μL),随机引物为2 μL,5×M-MLV Buffer 4 μL,dNTP mixture(10 mmol/L)1 μL,ribonuclease inhibitor 0.5 μL,M-MLV 1.5 μL,RNase-free water 1 μL,扩增条件为:30℃10 min,42℃60 min,70℃15min,共30~35个循环。Real-timePCR通过SYBRGreenI体系在LightCycler®480 System仪器上进行,反应参数为95℃预变性5 min,后95℃10 s,60℃10 s,72℃20 s,共45个循环。引物序列:Col1A1正义链5'-GAGCCAGCAGATTGAGAACAT-3',反义链5'-TACTCTCCGCTCTTCCAGTCA-3';GAPDH正义链5'-ACAGCAACAGGGTGGTGGAC-3',反义链5'-TTTGAGGGTGCAGCGAACTT-3'。
3.6 Western blotting细胞蛋白浓度通过BCA Protein Assay Kit测定,实验步骤按照Zhang等[9]报道的方法。等量的蛋白提取物加入SDS分离胶后,转移至PVDF膜上,用Ⅰ抗对目的蛋白进行孵育过夜,加入Ⅱ抗后用增强型化学发光试剂进行曝光。
4 统计学处理
数据均以均数±标准差(mean±SD)表示,差异采用多个样本均数比较的ANOVA方差分析,以P<0.05为差异有统计学意义。
结果
1 心肌成纤维细胞形态学的观察
对细胞进行形态学观察,发现2种方法培养的心肌成纤维细胞在分离初期均呈圆形,悬浮于培养基中,90 min后大多已完成贴壁,细胞伸展成梭形,胞核明显,零星分散生长;心肌成纤维细胞生长迅速,2~3 d即可达到80%~90%的融合,如图1所示,2 d后2种方法培养的成纤维细胞均排列均匀,部分交叉重叠,细胞呈梭形或者多角形,可形成“编织状”外观,胞体较大,胞浆透明,胞核明显,呈椭圆形,整个细胞具有明显的折光性,无自发性搏动,这与其他学者培养的细胞形态相似[10],所以2种方法得到的细胞在形态学上没有明显差异,都是典型的心肌成纤维细胞的形态。
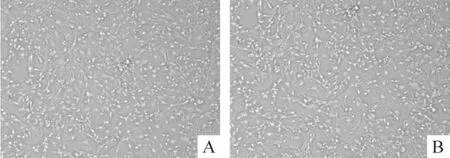
Figure 1.The morphology of cardiac fibroblasts harvested with two culture methods(×100).A:cardiac fibroblasts harvested with collagenase+trypsin digestion;B: cardiac fibroblasts harvested with trypsin digestion.图1 2种培养方法获得的心肌成纤维细胞的形态
2 心肌成纤维细胞纯度的鉴定
我们利用免疫荧光法对心肌成纤维细胞的纯度进行检测,视野中蓝色部分为非特异细胞核分布情况,绿色部分为特异性抗体的显色,如图2所示,2种方法培养的细胞中,抗vimentin抗体表达阳性的细胞数占总细胞数目的95%以上,而内皮细胞和血管平滑肌细胞的标志性抗体(抗von Willebrand factor和抗desmin抗体)表达均为阴性,表明2种方法培养出的细胞纯度无明显差异,且都达到了95%以上。

Figure 2.The identification of cellular purity.A:anti-vimentin antibody;B:anti-desminantibody;C:anti-von Willebrand factor antibody.图2 细胞纯度的鉴定
3 心肌成纤维细胞增殖能力的检测
Ang II是最常用的刺激可增殖细胞进行增殖生长的药物之一[11],在本实验中,我们采用Ang II (10-6mol/L)对心肌成纤维细胞进行刺激,首先通过CCK-8增殖实验和EdU合成实验来分别检测心肌成纤维细胞数目和DNA合成的变化,结果发现基础条件下,2种方法获得的细胞均能在2~3 d内达到80%~90%的融合,药物刺激后,用胰酶消化法获得的心肌成纤维细胞其DNA合成能力明显高于胶原酶+胰酶消化法获得的细胞(图3A),并且在CCK-8增殖实验中,胰酶法获得的细胞其增殖能力也明显高于胶原酶+胰酶法(图3B),差异均有统计学意义(P<0.05)。如图4所示,在基础条件下,2种方法获得的细胞表达Col1A1 mRNA和蛋白的能力基本相同,没有明显的差别,加入Ang II后,2种方法获得的心肌成纤维细胞表达Col1A1 mRNA和蛋白的能力均明显高于对照组,差异有统计学意义(P<0,05);同时用胰酶法获得的细胞Col1A1 mRNA和蛋白的表达水平均高于胶原酶+胰酶法,差异有统计学意义(P<0.05)。
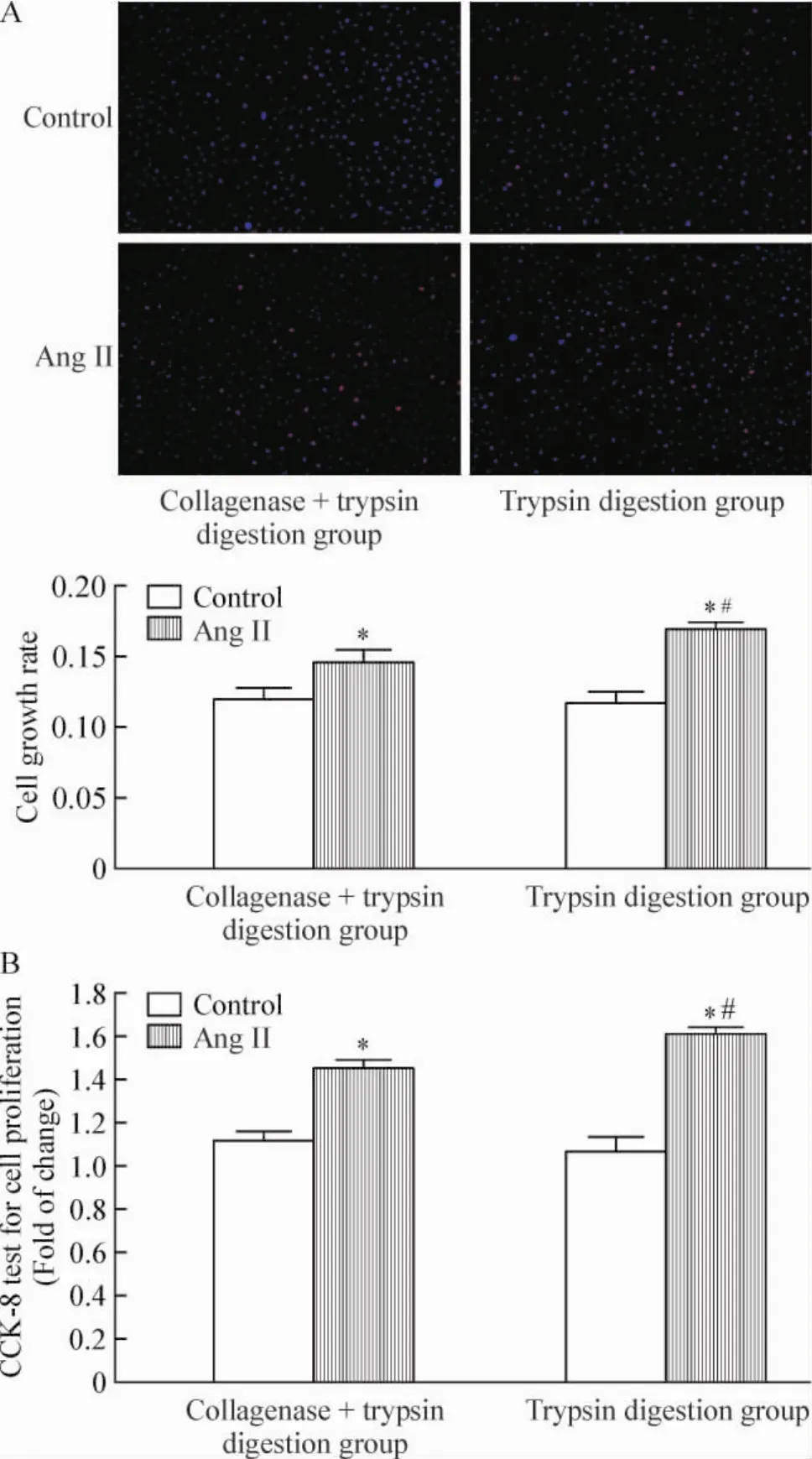
Figure 3.Ang II regulated the proliferation of cardiac fibroblasts.A:DNA synthesis tested by EdU incorporation assay;B:prolifertion tested by CCK-8 assay.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs collagenase+trypsin digestion group.图3 Ang II刺激心肌成纤维细胞后增殖能力的检测
讨论
细胞培养对于心脏细胞实验的开展有着十分重要的作用,目前心肌细胞的培养已经趋于成熟,但是心肌成纤维细胞的培养方法繁多,各有特点,根据实验要求不同,对细胞的要求也有所不同,在本实验中我们就目前存在的2种主要的心肌成纤维细胞的培养方法,分别从形态、纯度及对药物的反应等几个方面进行比较,结果发现2种方法培养的心肌成纤维细胞在形态和纯度方面没有明显区别,但是在对药物刺激后其细胞的增殖反应有所差异。我们首先从细胞代谢和DNA合成2个方面进行检测,结果发现胶原酶+胰酶消化法培养的心肌成纤维细胞其增殖速度明显低于胰酶消化法获得的细胞。同时我们还对药物刺激后细胞基因和蛋白的合成变化进行了检测,结果发现相对于胶原酶+胰酶消化法,胰酶消化法获得的细胞其主要成分Col1A1 mRNA和蛋白合成也明显增多,说明胰酶消化法获得的细胞对药物的增殖效应,不论从分子水平还是细胞水平都明显优于胶原酶+胰酶消化组。在细胞培养实验中,胰酶主要用于心脏组织间质蛋白的消化,其作用强,对细胞膜的破坏性也较大,因此许多研究对于胰酶消化法培养细胞持否定态度,认为其对细胞的存活有负面影响;而胶原酶(主要是I型胶原酶)作用温和,对细胞的损伤小,长时间消化对细胞的损伤不大,故大多数实验室倾向于采用短时间胰酶+长时间胶原酶双酶消化法对细胞进行培养。在本研究中我们发现采用胶原酶+胰酶法可以获得更多的心肌细胞,但对贴壁心肌成纤维细胞的数目没有明显影响,而胰酶法虽然对心肌细胞的影响较大(心肌细胞成活率明显降低),但是该法获得的心肌成纤维细胞对药物刺激后具有更强的增殖能力;对于这一现象我们可以解释为:第一,从细胞本身方面,心肌细胞活性明显低于心肌成纤维细胞,对外界的环境要求颇高,故采用消化强度较低的胶原酶+胰酶法可以获得更多的成活心肌细胞,而心肌成纤维细胞其活力较心肌细胞强,对环境要求偏低,故2种方法得到的原代心肌成纤维细胞从外形和纯度上都没有明显区别;第二,采用胰酶法时其中的胶原酶主要是对细胞间质的胶原纤维进行消化,在这一过程中,胶原酶是否也会对分泌胶原纤维的心肌成纤维细胞产生影响目前没有相关的研究,但在我们的实验中我们发现采用胰酶法获得的心肌成纤维细胞其对药物刺激后的增殖能力明显优于胶原酶+胰酶法获得的细胞,故我们认为采用胶原蛋白酶消化心肌组织时也会对心肌成纤维细胞产生一定程度的影响。
综上所述,在本研究中我们比较了目前较常用的2种培养心肌成纤维细胞的方法,从不同的角度对其特点进行了观察,发现采用胰酶法获得心肌细胞的效果不理想,但从某种程度上避免了胶原蛋白酶对心肌成纤维细胞的潜在损害,从而更好地保存了其自身的特点,为心肌纤维化研究中心肌成纤维细胞增殖模型的建立提供更好的方法依据。
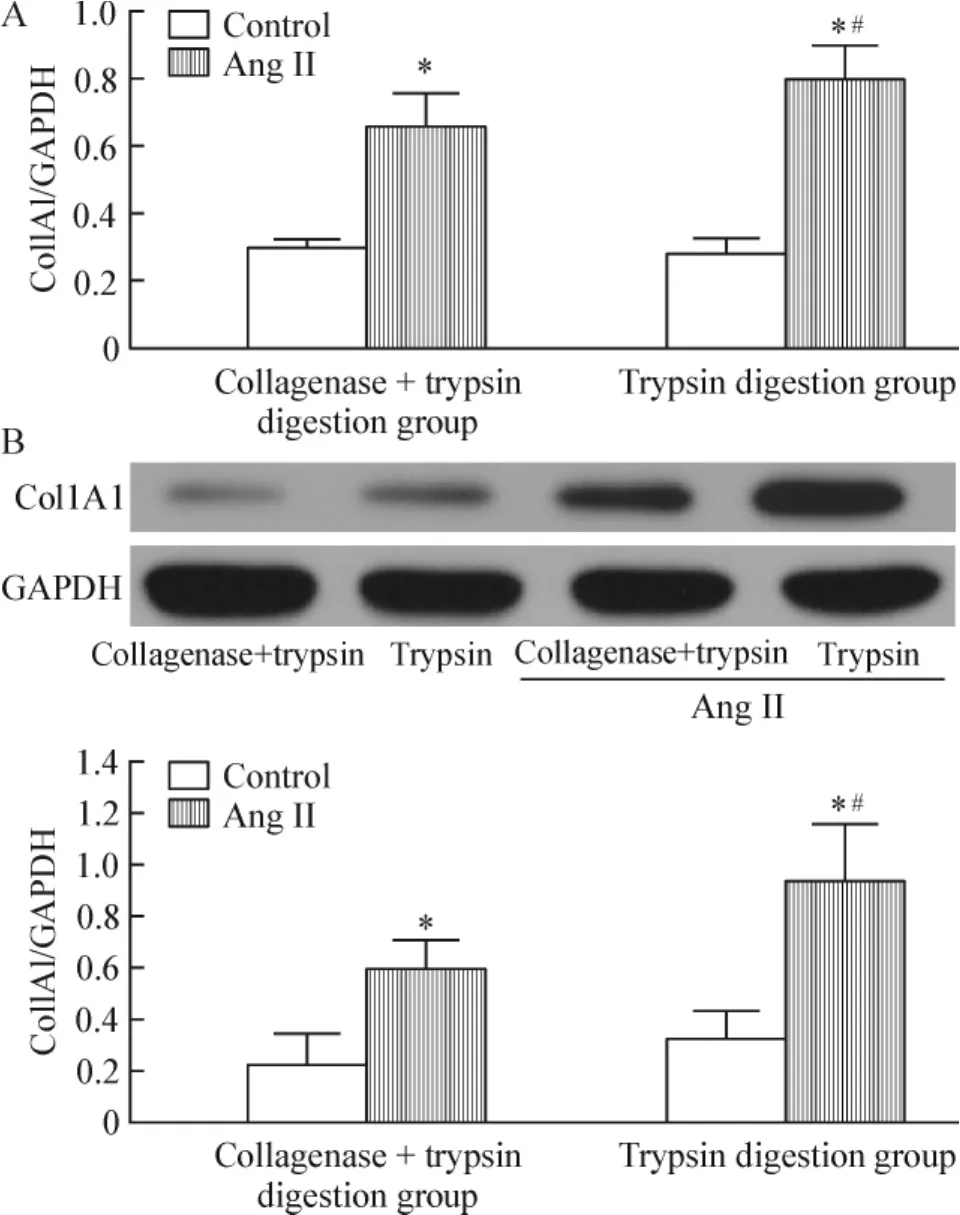
Figure 4.The expression of Col1A1 mRNA and protein in cardiac fibroblasts harvested with the two methods.A: Col1A1 mRNA expression was determined by realtime PCR.The cells were treated with or without Ang II for 2 h.B:Col1A1 protein expression was determined by Western blotting.The cells were treated with or without Ang II for 24 h.Mean±SD.n=3.*P<0.05 vs control;#P<0.05 vs collagenase+trypsin digestion group.图4 2种方法培养的心肌成纤维细胞Col1A1 mRNA与蛋白的表达
[1]Mackenna D,Summerour SR,Villarreal FJ.Role of mechanical factors in modulating cardiac fibroblast function and extracellular matrix synthesis[J].Cardiovasc Res,2000,46(2):257-263.
[2]Brown RD,Ambler SK,Mitchell MD,et al.The cardiac fibroblast:therapeutic target in myocardial remodeling and failure[J].Annu Rev Pharmacol Toxicol,2005,45:657-687.
[3]Yu H,Gallagher AM,Garfin PM,et al.Prostacyclin release by rat cardiac fibroblasts:inhibition of collagen expression[J].Hypertension,1997,30(5):1047-1053.
[4]Guo W,Kamiya K,Kada K,et al.Regulation of cardiac Kv1.5 K+channel expression by cardiac fibroblasts and mechanical load in cultured newborn rat ventricular myocytes[J].J Mol Cell Cardiol,1998,30(1):157-166.
[5]Haudek SB,Cheng J,Du J,et al.Monocytic fibroblast precursors mediate fibrosis in angiotensin-II-induced cardiac hypertrophy[J].J Mol Cell Cardiol,2010,49(3): 499-507.
[6]田斌,卢兴,陈雁群,等.血管紧张素在培养乳鼠心肌细胞肥大发生中的作用[J].中国病理生理杂志,1992,8(1):1-4.
[7]Simpson P,Savion S.Differentiation of rat myocytes in single cell cultures with and without proliferating nonmyocardial cells.Cross-striations,ultrastructure,and chronotropic response to isoproterenol[J].Circ Res,1982,50 (1):101-116.
[8]Acosta D,Li CP.Injury to primary cultures of rat heart endothelial cells by hypoxia and glucose deprivation[J].In Vitro,1979,15(11):929-934.
[9]Zhang Y,He X,Liu D,et al.Enhanced external counterpulsation attenuates atherosclerosis progression through modulation of proinflammatory signal pathway[J].Arterioscler Thromb Vasc Biol,2010,30(4):773-780.
[10]陈勇兵,陈如坤,陈力,等.乳鼠心肌成纤维细胞培养方法的改进[J].江苏医药,2005,31(3):189-190.
[11]Schorb W,Booz GW,Dostal DE,et al.Angiotensin II is mitogenic in neonatal rat cardiac fibroblasts[J].Circ Res,1993,72(6): 1245-1254.
Comparison of two methods for culturing neonatal rat cardiac fibroblasts
SUN Gang,XUE Rui-cong,LIU Chen,DONG Yu-gang
(1Department of Cardiology,The First Affiliated Hospital,2Key Laboratory of Assisted Circulation,Ministry of Health,Sun Yat-sen University,Guangzhou 510080,China.E-mail:dongxg@mail.sysu.edu.cn)
AIM:To establish and compare the methods for culturing neonatal rat cardiac fibroblasts culture.METHODS:Neonatal rat hearts were isolated by collagenase+trypsin or trypsin digestion.The cardiomyocytes and cardiac fibroblasts were isolated by different attachment techniques.The cellular morphology,purity and reactions to the reagent were tested.RESULTS:For morphology and purity,no difference between the 2 methods was observed,though more myocytes were harvested by the method of collagenase+trypsin digestion.For the cellular responses to reagent,the cardiac fibroblasts harvested with trypsin digestion had more potent proliferative ability than those with collagenase+trypsin digestion.CONCLUSION:There is no difference of cellular morphology and purity in the cardiac fibroblasts isolated by collagenase+trypsin digestion and trypsin digestion,but the fibroblasts with trypsin digestion have more potent proliferative ability.
Cardiac fibroblasts;Collagenase;Trypsin
Q253
A
10.3969/j.issn.1000-4718.2014.02.035
1000-4718(2014)02-0380-05
2013-09-05
2013-11-06
广东省自然科学基金资助项目(No.S2011040003614);广东省科技计划(No.B2011071)
△通讯作者Tel:020-87755766-8140;E-mail:dongxg@mail.sysu.edu.cn

