微钙化动脉粥样硬化斑块兔模型的建立与染色方法的比较*
郭倩倩,张鹏飞,王琳,孔静,张运,张梅
(山东大学齐鲁医院心内科,山东济南 250012)
·实验技术·
微钙化动脉粥样硬化斑块兔模型的建立与染色方法的比较*
郭倩倩,张鹏飞△,王琳,孔静,张运,张梅
(山东大学齐鲁医院心内科,山东济南 250012)
目的:建立微钙化动脉粥样硬化斑块兔模型,并比较茜素红S和冯·科萨染色方法对微钙化的识别。方法:30只雄性新西兰兔,在高脂饲料喂养和腹主动脉内皮球囊损伤基础上,随机分为套管组(给予腹主动脉双楔形套管缩窄)和非套管组,喂养12周,对比茜素红S和冯·科萨染色方法对微钙化识别的价值,并比较两组微钙化的发生率。结果:两组均形成动脉粥样硬化斑块,套管组微钙化发生率和钙化面积高于非套管组(P<0.05)。茜素红S和冯·科萨染色识别微钙化的敏感性相同,前者具有荧光活性的优势,但对于微钙化的定位准确性逊于后者。结论:本研究成功建立了一种微钙化动脉粥样硬化斑块兔模型。茜素红S和冯·科萨染色均能较好识别微钙化。
微钙化;动脉粥样硬化;茜素红S染色;冯·科萨染色;模型,动物
在动脉粥样硬化斑块的发展过程中会出现钙质沉积。钙化对动脉粥样硬化斑块稳定性的作用一直存在争议。有限元函数分析发现,钙化并不增加斑块纤维帽处的局部应力,对斑块的力学稳定性没有影响[1-2]。而近期有学者发现斑块表面的钙化结节,特别是直径在10 μm以下的微钙化能增加斑块易损性,促使斑块破裂[3-6]。但由于缺乏微钙化动脉粥样硬化斑块动物模型和敏感的病理学染色技术,对微钙化与斑块稳定性间关系的研究有限。
兔腹主动脉内皮机械性损伤加高脂饲料喂养是复制动脉粥样硬化斑块常用的动物模型,尤其适用于介入性诊疗技术的研究。但该模型所形成的斑块以脂质和胶原成分为主,尚未见有微钙化成分的报道[7-10]。业已证实,血流剪切力的变化不仅参与动脉粥样硬化的发生[11],还与斑块内钙化密切相关[12]。Cheng等[13]在体外实验中证实,利用符合流体力学原理的套管可同时模拟不同形式的剪切力。故本研究拟在腹主动脉内皮球囊损伤加高脂饲料喂养的传统模型基础上引入腹主动脉套管缩窄,改变局部的血流剪切力,以期建立微钙化动脉粥样硬化斑块动物模型;并利用此模型对比茜素红S(alizarin red S)和冯·科萨(von Kossa)这2种常用的钙质染色技术用于微钙化染色的可行性和异同点。
材料和方法
1 动物与模型建立
雄性纯种新西兰兔30只,体重1.5~2.5 kg(购自山东省农业科学院,合格证号为鲁动质字D20021135)。随机分为套管组和非套管组,每组各15只,均给予2%高胆固醇饲料喂养12周,并按课题组前期发表的方法[7],于第1周末,经股动脉入路,以充盈球囊反复损伤腹主动脉内膜3次。在套管组,球囊损伤操作结束后,开腹,于右肾动脉开口下方2 cm处分离腹主动脉并置入硅胶材质的双楔形套管,见图1。
2 血流剪切力检测
在球囊损伤操作前和第12周末利用超声(GE公司Vivid q彩色超声仪,探头8L-RS,频率4.0~13.0 MHz)对套管组近心端、套管内最狭窄处、套管远心端部位的腹主动脉和非套管组相应部位的腹主动脉进行长轴和横切面扫查,分别测量舒张末期内径(diastolic diameter,Dd)和平均血流速度(mean flow velocity,Vm)。同时自兔耳缘静脉抽血,于2 h内完成血液黏滞度(η)测定(中外合资北京中勤世帝公司LG-R-80全自动流变仪),并按下述公式计算血流剪切力(fluid shear stress,τm):τm=η×4×Vm/ Dd。
3 取材
第12周末,实验动物麻醉成功后开腹,分离腹主动脉全长,随后经耳缘静脉注射过量3%戊巴比妥钠安乐死处死动物,并立即将灌注针插入右肾动脉开口水平稍下方的腹主动脉腔内,下腔静脉剪小口,以4%多聚甲醛行腹主动脉局部灌注固定。取套管近心端、套管内及远心端的腹主动脉,修剪成2mm长的小块后至于预冷的4%多聚甲醛中,4℃下充分固定48 h;在非套管组,则取对应于套管组套管近心端至套管远心端之间的腹主动脉为样本。
4 常规病理学及免疫组织化学染色
固定后的腹主动脉,分别进行石蜡和冰冻包埋,以5 μm厚度制片,行HE、天狼星红、油红O染色和抗β-肌动蛋白(武汉博士德生物工程有限公司)、抗巨噬细胞(monoclonal mouse anti-rabbit macrophage,clone RAM11;Dako)免疫组织化学染色以显示斑块内的胶原纤维、脂质、平滑肌成分和巨噬细胞的浸润。
5 微钙化染色
连续2张石蜡切片分别行茜素红S染色和冯·科萨染色。
5.1 茜素红S染色石蜡切片常规脱蜡后置入0.5%茜素红S溶液30 min,蒸馏水速洗3次,梯度乙醇脱水,二甲苯透明,环保树胶封片。
5.2 冯·科萨染色石蜡切片常规脱蜡后置入1% AgNO3溶液,紫外线下照射30 min,蒸馏水速洗3次,加入5%硫代硫酸钠5 min去除未反应的银,蒸馏水速洗3次后加入0.1%核固红溶液1 min复染细胞核,梯度乙醇脱水,二甲苯透明,环保树胶封片。
6 微钙化的观察与分析
茜素红S和冯·科萨染色的切片,先后在激光共聚焦显微镜(ZEISS LSM 710)和光学显微镜(Leica DM2500)下观察。在60倍光学显微镜下选取相同视野拍照,以Image-Pro Plus 6.0图像分析软件计算钙化面积占斑块面积的百分比。
7 统计学处理
采用SPSS 17.0软件分析。计量数据以均数±标准差(mean±SD)表示。两组间比较采用t检验。多组间比较采用单因素方差分析。计数资料采用Fisher精确检验。以P<0.05为差异有统计学意义。
结果
套管组因手术意外死亡3只,术后腹泻死亡3只,2组分别有9和15只完成实验。
12 组间血流剪切力的比较
非套管组兔球囊损伤操作前与12周末腹主动脉血流剪切力间无显著差异[(33.19±3.30)dyn/cm2vs(27.86±4.17)dyn/cm2,P>0.05]。而套管组,12周末时套管近心端的剪切力显著低于球囊损伤操作前,构建出低剪切力模型;套管内的剪切力明显高于球囊损伤操作前,构建出高剪切力模型;而套管远心端的剪切力显著低于球囊损伤操作前且彩色多普勒超声显示紊乱的血流图像,提示存在振荡剪切力,见图2、表1。
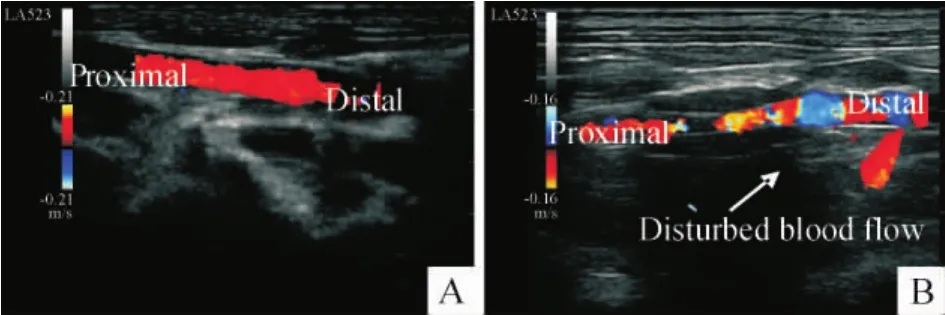
Figure 2.Color Doppler ultrasonography of the cast-placement group before surgery(A)and 12 weeks after surgery (B).图2 套管组术前(A)术后(B)血流图

表1 套管组术前、术后各部位血流剪切力的比较Table 1.Comparison of the shear stress between pre-and postsurgery in the group with the abdominal cast(dyn/cm2.Mean±SD)
22 组间动脉粥样硬化斑块组成成份的比较
12周末非套管组和套管组近心端、远心端处腹主动脉均发现动脉粥样硬化斑块形成。病理学染色结果表明套管组近心端和远心端巨噬细胞、胶原纤维的含量均显著高于非套管组,而平滑肌细胞、脂质含量与非套管组无统计学差异;套管组近心端与远心端各种组织含量间无显著差异,见图3。

Figure 3.Comparison of different components in the atherosclerotic plaques between non-cast-placement and cast-placement groups at the 12th week.Histological changes of the abdominal aortas were observed(HE staining),and the atherosclerotic plaques were stained for macrophages(anti-RAM11),vascular smooth muscle cells(VSMCs;anti-β-actin),collagen(Sirius red staining)or lipids(oil red O staining).Scale bar=20 μm.Mean±SD.*P<0.05 vs non-cast-placement group.图3 2组间动脉粥样硬化斑块组成成份的比较
32 组间微钙化发生率的比较
非套管组只有1只兔的1个部位发生微钙化,钙化面积为0.12%;而套管组中有4只兔共计10个部位发生微钙化,均位于套管近心端和远心端,钙化面积平均为0.27%。套管内高剪切力区域未发现微钙化。2组的钙化率有显著差异(P<0.05),见图4。
42 种染色方法对微钙化的识别比较
4.1 普通光学显微镜下观察结果2种染色方法均可识别斑块内微钙化,且2种染色方法测得的钙化面积并无显著差异(P>0.05),见图5。

Figure 5.Comparison of the calcification area index measured by alizarin red S and von Kossa staining.Mean±SD.n= 5.图5 2种染色方法测得的钙化面积比较
冯·科萨染色下,微钙化为黑灰色或黑色,细胞核为粉红色,细胞轮廓清楚,组织结构清晰,60倍镜下可分辨出细胞内钙化与细胞外基质钙化,见图6B、D。茜素红S染色技术将钙化染为粉红或红色,但由于该技术不能复染细胞核,细胞轮廓不清晰,钙化部位定位不准确,见图6A、C。

Figure 6.Microcalcification stained by alizarin red S(A,C)and von Kossa(B,D).Microcalcification was black or black-grey signals under von Kossa staining whereas vivid red signals under alizarin red S staining.Both cellular(blue arrow)and extracellular(green arrow) microcalcification could be observed with von Kossa straining.Black arrow points to the nucleus.Scale bars represent 100 μm in A and B,and 20 μm in C and D.图6 光学显微镜下观察微钙化
4.2 激光共聚焦显微镜下观察结果茜素红S染色的切片在共聚焦图片中,背景的自发荧光可忽略,阳性信号为红色,对比鲜明,见图7A。在本研究建立的动物模型中可见球形和长条形2种形态的微钙化,直径范围自1~15 μm不等,见图7B、C。冯·科萨染色无荧光活性,无法在激光共聚焦扫描显微镜下成像观察。
讨论
动脉粥样硬化斑块破裂和继发血栓形成是急性心血管事件的主要病因。在动脉粥样硬化发展过程中伴随着钙化的发生:早期,平滑肌细胞、巨噬细胞的凋亡与坏死可导致细胞水平或亚细胞水平的微钙化;中晚期,脂质核心形成,在坏死区域可出现较大的钙化颗粒,最终可发生骨化。钙化对动脉粥样硬化斑块稳定性的影响愈发受到关注。Vengrenyuk等[3]利用Goodier数学模型证实薄纤维帽处的微钙化可使其周围的应力加倍,引起界面的分离,导致斑块破裂。Bluestein等[4]利用流固耦合(fluid-structure interaction,FSI)模型提出微钙化能增加局部应力并导致斑块破裂的理论假说。但由于缺少适宜的微钙化动脉粥样硬化斑块动物模型及可识别微钙化的病理学染色方法,这些理论模型的体内验证研究受到限制。

Figure 7.Microcalcification observed under laser scanning confocal microscope.Microcalcification was shown as vivid red signals in two-dimensional image(A).Spherical and rectangular microcalcification could be illustrated with three-dimensional reconstructed images(B and C).Cartoons inserted at the right upper corner of each image demonstrated the location of the microcalcification within the atherosclerotic plaque.The blue area represents the plaque.Red spots represent microcalcification.图7 激光共聚焦显微镜观察微钙化
传统的高脂饲料喂养加腹主动脉内皮球囊损伤的兔模型中,可见斑块内富含脂质、胶原,炎性细胞浸润亦可在该类动物模型中得以复制,但钙化发生较少[7-10]。本研究证实,腹主动脉套管缩窄导致血流剪切力的改变,而剪切力与钙化发生密切相关。Stefan等[12]通过血管内超声及虚拟组织显像技术分析冠状动脉分支处斑块负荷及组织成份,发现在分支的对侧壁,即一般认为的低剪切力区,斑块负荷大且钙化严重。本实验结果与之相符,套管近心端与远心端为低剪切力区且微钙化发生明显增加。同时,本研究证实振荡剪切力促进微钙化的发生,这在文献中鲜有报道。本实验结果表明在传统模型存在的高脂环境和内皮炎症基础上,剪切力导致斑块内微钙化发生率增加,成功建立了一种适合研究微钙化动脉粥样硬化斑块的动物模型。
茜素红S和冯·科萨是常用的钙质染色技术。茜素红S通过结构中的硫酸基团及羟基基团与钙离子反应形成粉红色或红色钙盐[14]。茜素红S染料可自发红色荧光,呈色反应可借助激光共聚焦显微镜观察[3]。冯·科萨染色利用硝酸银溶液与钙盐的磷酸根或碳酸根反应生成相应的磷酸银或碳酸银,后者可被日光或者紫外线还原为黑灰或黑色的金属银[14]。本研究证实2种方法同样适用于微钙化染色,对微钙化的敏感性相同。冯·科萨染色颜色对比鲜明,组织细胞结构清楚,能明确微钙化发生于细胞内或细胞外基质。茜素红S是一种阴离子蒽醌类染料,具有自发荧光,可通过激光共聚焦扫描显微镜观察,利用其在深度识别能力(最大深度为200~400 μm)和纵向分辨率的优势,进行三维重建,灵活、直观地显示微钙化的空间形态[15],且茜素红S的荧光活性可用于流式细胞术等技术,对细胞、分子水平的研究提供便利,但茜素红S染色不能准确显示细胞核,对于钙化位置的定位有一定的局限性。鉴于微钙化的位置及形状对斑块稳定性有各异的作用[3,5],2种染色技术的联合应用对于全面分析微钙化与斑块稳定性间的关系更具价值。
[1]Alexopoulos N,Raggi P.Calcification in atherosclerosis [J].Nat Rev Cardiol,2009,6(11):681-688.
[2]Huang H,Virmani R,Youniset H,et al.The impact of calcification on the biomechanical stability of atherosclerotic plaques[J].Circulation,2001,103(8):1051-1056.
[3]Vengrenyuk Y,Carlier S,Xanthos S,et al.A hypothesis forvulnerableplaqueruptureduetostress-induced debonding around cellular microcalcifications in thin fibrous caps[J].Proc Natl Acad Sci U S A,2006,103 (40):14678-14683.
[4]Bluestein D,Alemu Y,Avrahami I,et al.Influence of microcalcifications on vulnerable plaque mechanics using FSI modeling[J].J Biomech,2008,41(5):1111-1118.
[5]Vengrenyuk Y,Cardoso L,Weinbaum S.Micro-CT based analysis of a new paradigm for vulnerable plaque rupture: cellular microcalcifications in fibrous caps[J].Mol Cell Biomech,2008,5(1):37-47.
[6]Virmani R,Kolodgie FD,Burke AP,et al.Lessons from sudden coronary death:a comprehensive morphological classification scheme for atherosclerotic lesions[J].Arterioscler Thromb Vasc Biol,2000,20(5):1262-1275.
[7]Chen WQ,Zhang Y,Zhang M,et al.Establishing an animal model of unstable atherosclerotic plaques[J].ChinMed J(Engl),2004,117(9):1293-1298.
[8]仲琳,张运,张梅,等.兔动脉粥样硬化易损斑块模型的建立[J].基础医学与临床,2005,25(4):370-374.
[9]陈文强,张运,张梅,等.转染野生型p53基因诱发家兔动脉粥样硬化斑块不稳定性的实验研究[J].中国病理生理杂志,2005,21(5):838-843.
[10]王朝晖,龚平,杜林林,等.动脉粥样硬化并发血栓形成家兔模型的研究[J].中国病理生理杂志,2006,22 (10):2071-2073.
[11]Li YS,Hags JH,Chien S.Molecular basis of the effects of shear stress on vascular endothelial cells[J].J Biomech,2005,38(10):1949-1971.
[12]Toggweiler S,Urbanek N,Schoenenberger AW,et al. Analysis of coronary bifurcations by intravascular ultrasound and virtual histology[J].Atherosclerosis,2010,212 (2):524-527.
[13]Cheng C,Tempel D,van Haperen R,et al.Atherosclerotic lesion size and vulnerability are determined by patterns of fluid shear stress[J].Circulation,2006,113(23): 2744-2753.
[14]McGee-Russell SM.Tissues for assessing histochemical methods for calcium[J].Q J Microsc Sci,1957,98(1): 1-8.
[15]戴毅,顾玲,步宏.激光扫描共聚焦显微镜在缺血性心脏病研究中的应用[J].中国病理生理杂志,2001,17(10): 1034-1037.
Development of a New Zealand rabbit model of microcalcified atherosclerotic plaques and comparison of staining methods for determining microcalcification
GUO Qian-qian,ZHANG Peng-fei,WANG Lin,KONG Jing,ZHANG Yun,ZHANG Mei
(Department of Cardiology,Qilu Hospital of Shandong University,Jinan 250012,China.E-mail:pengf-zhang@163.com)
AIM:To develop a New Zealand rabbit model of microcalcified atherosclerotic plaques and to compare alizarin red S staining and von Kossa staining for identifying the microcalcification.METHODS:Thirty New Zealand rabbits were randomly divided into cast-placement group and non-cast-placement group.All animals were fed with high-cholesterol diets and underwent aortic endothelial denudation.Double-wedge-shaped casts were implanted around the aorta in the animals in cast-placement group.At the end of the 12th week,the rabbits were sacrificed and the arterial samples were collected to stain the possible microcalcification within the plaques by the techniques of alizarin red S staining and von Kossa staining.RESULTS:Atherosclerotic plaques were found in abdominal aorta in both groups.Microcalcification was evidenced more frequently in cast-placement group,and the calcification area index was also much larger.The alizarin red S staining and von Kossa staining had similar sensitivity for identifying microcalcification.The von Kossa staining was superior to illuminate the accurate localization of the microcalcification,while the alizarin red S staining held the benefit of fluorescence.CONCLUSION:A new animal model of microcalcified atherosclerotic plaques is developed successfully.Both alizarin red S staining and von Kossa staining could be used to identify microcalcification sensitively.
Microcalcification;Atherosclerosis;Alizarin red S staining;von Kossa staining;Models,animal
R541.4
A
10.3969/j.issn.1000-4718.2014.02.034
1000-4718(2014)02-0374-06
2013-09-16
2013-12-14
国家重点基础研究计划(973)项目(No.2010CB732605);国家自然科学基金资助项目(No.30972809)
△通讯作者Tel:0531-82169429;E-mail:pengf-zhang@163.com

