电针联合BMSCs移植治疗对出血性脑卒中大鼠血清BMP表达的影响*
郑宇杰 汤华军 范光碧 杨朝鲜
研究表明将骨髓间充质干细胞(bone marrow stromal cells,BMSCs)移植入脑出血大鼠,BMSCs能存活、迁徙、分化为神经元和胶质细胞,减少损伤体积,促进神经功能的恢复[1-2]。临床实践与动物实验表明电针对脑出血运动功能恢复具有明显促进作用[3],但对其机制的研究还不够深入。髓鞘碱性蛋白(Myelin basic protein,MBP)是构成中枢神经系统髓鞘的一种碱性蛋白,神经组织损伤时髓鞘崩解,MBP从神经纤维髓鞘上脱落,MBP含量较正常生理状态下急剧增高,其血清含量的增高是急性脑实质损伤和脱髓鞘改变的特异性生化指标[4]。本研究旨在探讨电针联合BMSCs移植治疗对脑出血大鼠血清MBP表达的影响,为电针联合BMSCs移植治疗脑出血的神经保护机制提供实验依据。
1 材料与方法
1.1 动物、试剂与仪器 成年SD雄性大鼠110只,体质量200~300 g,由泸州医学院实验动物中心提供;Rat Mesenchymal Stem cell购自赛业生物科技有限公司;肝素钠注射液购自上海市医药股份有限公司;I型胶原酶购自Sigma公司;α-MEM培养基购自美国Gibco公司;MBP抗体,MBP酶标抗体,SABGCy3购自武汉博士德;HM 6805-Ⅱ型经穴治疗仪购自四川恒明科技开发有限公司;Multiskan MK3全自动酶标仪购自博奥通科科技(北京)有限公司。
1.2 大鼠脑出血动物模型制备 用5 μL微量注射器抽取2 U/μL的肝素钠1 μL和0.125 U/μL的胶原酶2 μL,然后固定在立体定位仪上。实验大鼠用1%戊巴比妥钠按40 mg/kg的标准进行腹腔注射麻醉;然后固定于立体定位仪上,作颅顶中线切口12 mm,用30%H2O2腐蚀暴露前囟及冠状缝,以前囟为基点,向前0.2 mm,向右3 mm,开颅钻钻孔至硬脑膜,沿钻孔进针6 mm,将肝素钠和胶原酶溶液缓慢注入尾壳核内,留针5 min,缓慢退针,速度为1 mm/min,骨蜡封闭钻孔,消毒缝合切口。
1.3 BMSCs复苏、培养、传代及诱导 在超净工作台内打开冻存管,将解冻后的细胞转入离心管中加入10倍体积的改良型α-MEM培养基,吸管轻吹均匀。1000 rpm离心4 min。弃上清,加入含15%胎牛血清的的α-MEM培养基,调整细胞密度以5×105/mL[5]。转入25 mm2培养瓶置于37 ℃、5%CO2恒温培养箱培养,当细胞生长铺满培养瓶壁75%~80%左右时传代。细胞移植前,将贴壁达80%融合BMSCs的培养基,更换为预诱导液培养24 h,再更换为诱导液诱导6 h后,收集细胞,调整细胞密度以2.5×107/mL,置于培养基中备用。
1.4 BMSCs移植及电针治疗 在造模成功后第3天,用脑立体定位仪进行固定,取细胞悬液20 μL沿造模孔缓慢注入尾壳核,速度为5 μL/min,留针5 min,缓慢退针,骨蜡封闭钻孔,消毒缝合切口。在造模成功后第3天,对大鼠捆绑固定,参照林文注等[6]编著的《实验针灸学》,应用30号l寸毫针,选取百会穴及大椎穴进针,毫针接HM 6805-Ⅱ型经穴治疗仪,频率3 Hz,强度1 V,连续波,持续10 min,1次/d,直至取材时间点。
1.5 实验分组 实验设对照组和实验组。正常对照组(Normal组)5只,不做任何处理;假手术组(FO组)5只,造模和移植都同步麻醉和进针但不注入任何药物。将NSS评分≥9分的模型大鼠随机分为4个实验组:生理盐水组(NS组);电针组(Ea组);BMSCs移植组(BMSCs组);电针联合BMSCs移植组(Ea BMSCs组),每组25只,按照取材时间(1、3、5、7、14 d)不同分为5个亚组,每个时间点5只。NS组大鼠注射20 μL生理盐水,BMSCs组大鼠注射20 μL细胞悬液,Ea BMSCs组大鼠注射20 μL细胞悬液后再进行电针刺激,Ea组只进行电针治疗不移植。
1.6 标本采集 在相应时间点麻醉大鼠,剪开胸腔,用采血针刺入左心室采血3~5 mL,用不抗凝专用试管收集标注,4 ℃静置30 min后,4000 r冷冻离心10 min,取血清分装标注,-80 ℃冰箱保存待检。
1.7 血清MBP检测 用酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)检测。将预包被MBP抗体的酶标板、试剂等平衡至室温,分别在相应孔内加入待检血清、阴性对照、阳性对照。每孔滴加酶标抗体,置37 ℃温育60 min。室温平衡5 min,甩干孔内液体,用洗液洗涤5次,扣干。每孔加显色剂,轻拍混匀。酶标仪测定OD值,用空白调零。样品OD值/临界值≥1为阳性,样品OD值/临界值<1为阴性,阴性对照OD值≥0.1时,重复试验。
1.8 统计学处理 应用SPSS 13.0统计软件,所有数据以(±s)表示,单因素方差分析组内差异,独立样本t检验分析组间差异,以P<0.05表示差异有统计学意义。
2 结果
各组MBP第1天表达最高,随即下降第3天达谷底,随后快速上升第7天达到波峰后下降。与NS组比较:Ea组第5、7、14天MBP表达低于NS组(P<0.05);BMSCs组MBP 表达第 14天低于 NS组(P<0.05);Ea BMSCs组第 5、7、14天MBP表达显著低于NS组(P<0.01)。与Ea BMSCs组比较:Ea组第1、3天MBP表达低于Ea BMSCs组(P<0.05),第14天高于Ea BMSCs组(P<0.05);BMSCs组MBP表达第5、7、14天高于Ea BMSCs组(P<0.05);脑出血各治疗组14天时仍高于FO组和Normal组(P<0.05)。见表1、图1、图2。
3 讨论
研究证实脑出血大鼠进行BMsCs移植,细胞能存活、迁徙,分化为神经元和胶质细胞,减少损伤体积,促进神经功能的恢复[1-2]。百会与大椎均为督脉穴位,督脉与脑密切相关[7],电针百会与大椎穴可增加脑的供血,减轻脑的缺血缺氧,减轻脑水肿,减轻膜脂质过氧化,进而抑制自由基的损伤,调节细胞内氧化/抗氧化平衡,减少钙超载,起到保护神经元的作用[8]。
表1 各组不同时间血清MBP检测结果(±s) U/L
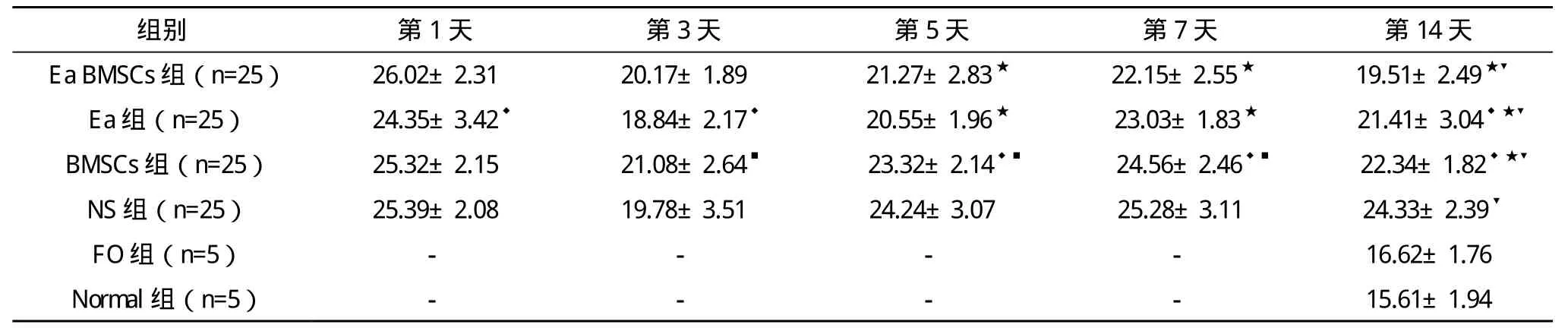
表1 各组不同时间血清MBP检测结果(±s) U/L
★同一时间点与NS组比较,P<0.05;◆同一时间点与Ea BMSCs组比较,P<0.05;■同一时间点与Ea组比较,P<0.05;▼第14天与FO组和Normal组比较,P<0.05
组别 第1天 第3天 第5天 第7天 第14天Ea BMSCs组(n=25) 26.02±2.31 20.17±1.89 21.27±2.83★ 22.15±2.55★ 19.51±2.49★▼Ea组(n=25) 24.35±3.42◆ 18.84±2.17◆ 20.55±1.96★ 23.03±1.83★ 21.41±3.04◆★▼BMSCs组(n=25) 25.32±2.15 21.08±2.64■ 23.32±2.14◆■ 24.56±2.46◆■ 22.34±1.82◆★▼NS 组(n=25) 25.39±2.08 19.78±3.51 24.24±3.07 25.28±3.11 24.33±2.39▼FO组(n=5) - - - - 16.62±1.76 Normal组(n=5) - - - - 15.61±1.94
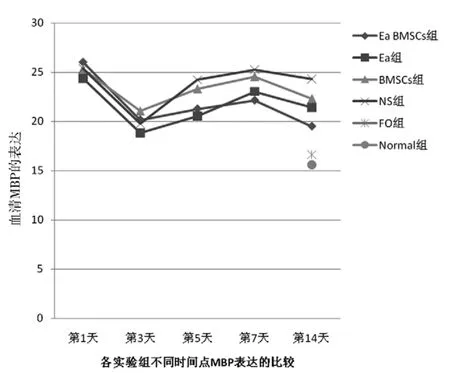
图1 各组不同时间血清MBP检测结果分析折线图
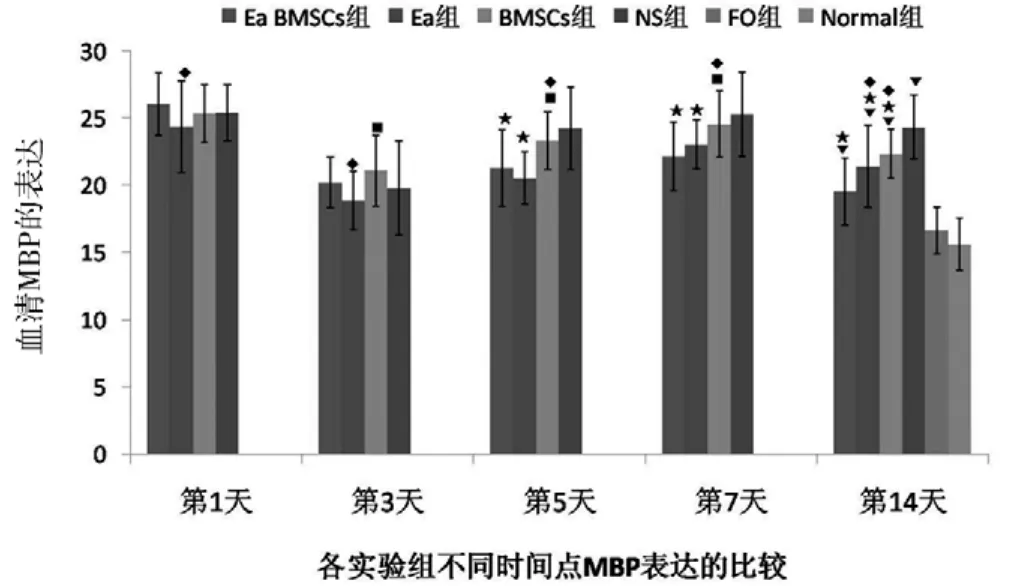
图2 各组不同时间血清MBP检测结果分析柱形图
神经系统功能主要体现在于信息的转化、传递、整合、记忆和运用。其中信息有效及时的传递非常重要,而信息的传递主要依赖神经纤维结构和功能的健全。髓鞘碱性蛋白(MBP)是构成神经系统髓鞘的一种碱性蛋白,与髓鞘脂质紧密结合,髓鞘结构与功能的稳定,MBP是重要的物质基础,在正常情况下,血清中的MBP含量较低,在有髓纤维发生脱髓鞘病变时会明显上升[9-10]。故MBP含量变化能特异地反映脱髓鞘损害程度,也是神经病损的判断指标之一[4,11-12]。脑出血后因为占位效应,可引起髓鞘的崩解,神经元的坏死、脑水肿形成等继发性损伤,导致细胞膜破坏,使MBP进入血液,其含量升高。研究证实外伤性脑出血患者,血清MBP含量在早期即显著升高,与损伤程度和预后紧密相关[4,13],MBP可作为特异的生化指标,判断颅脑损伤程度及预后。MBP由于降解作用,在伤后24 h应下降至正常,艾文兵等[4]研究却发现,血清MBP含量常持续较高水平7~9 d,目前认为与颅脑损伤后继发性脑损害有关[4,13]。笔者的研究发现各治疗组在第1天MBP表达明显增高,随后下降,第3天达波谷后再次上升到第7天达波峰,随后下降,但都高于假手术组和正常组,与艾文兵等[4]研究基本一致。笔者研究同时发现,NS组MBP的表达在第5、7、14天明显高于其他治疗组,Ea BMSCs组MBP表达比单一电针治疗和单一BMSCs移植治疗分别在第14天和第5、7、14天有明显下降。表明电针联合BMSCs移植治疗更能保护神经纤维减轻脱髓鞘反应,减少MBP的产生,从而促进出血脑性脑损伤的恢复。
[1] Seyfried D,Ding J,Han Y,et al.Effects of intravenous adminis-tration of human bone marrow stromal cens after intracerebralhemorrhagein rats[J].J Neurosurg,2006,104(2):313-318.
[2] Seyfried D M,Han Y,Yang D,et al.Mannitol enhances delivery of marrow stromal cellsto the brain after experimental intracerebral hemorrhage[J].Brain Res,2008,1224(1):12-19.
[3]段希栋,李康增,李守艳.针刺治疗脑出血研究纂要[J].实用中医内科杂志,2010,24(1):24-26.
[4]艾文兵,陈玉宏,杨启建,等.三七总皂普对急性重型颅脑损伤患者血清NSE和MBP含量的影响[J].中国实用神经疾病杂志,2007,10(2):1-3.
[5]杨朝鲜,周玲,马芳,等.绿色荧光蛋白标记对大鼠骨髓间充质干细胞生长的影响[J].中国组织工程研究与临床康复,2007,11(46):9234-9237.
[6]林文注,王佩.实验针灸学[M].上海:上海科学技术出版社,1994:286-290.
[7]莫飞智,赖新生,陈振虎,等.电针与氢化麦角碱对血管性痴呆大鼠脑内乙酰胆碱酯酶的作用[J].中国老年医学杂志,2001,21(3):119-121.
[8]程为平,原田俊英,陈伊,等.针刺“百会”、“大椎”对血管性痴呆大鼠脑内NO及NOS的影响[J].中华现代内科学杂志,2007,3(4):198-200.
[9]曾琳,龙在云,陈恒胜,等.大鼠坐骨神经离断后髓鞘碱性蛋白的变化研究[J].中国临床康复,2002,6(23):3502-3505.
[10]曾琳,杨恒文,邵阳,等.NGF对坐骨神经损伤后腰髓与损伤神经MBP含量变化的影响[J].第三军医人学学报,2002,24(3):326.
[11] Omana-Zapata l,Khabbaz M A,Hunter J C,et al.QX-314 inhabbits ectopic nerve activityassociated with neuropathic pain[J].Brain Res,1997,771(2):228-231.
[12] Fisher J,Levkovitch V H,Schori H,et al.Vaccination for neuroprotection in themouse optic nerve: implications for optic neuropathies[J].J Neurosci,2001,21(3):136-139.
[13]范小璇,赵晓平,梁格婷,等.健脑益智胶囊对外伤性脑出血患者血清人髓鞘碱性蛋白含量的影响[J].现代中西医结合杂志,2011,20(4):400-404.

