调控辅因子水平减少酿酒酵母积累副产物乙醇*
徐国强,陈修来,吴满珍
1(江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡,214122)
2(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
3(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
C4二元羧酸(苹果酸、延胡索酸和琥珀酸等)在食品、医药、材料等行业有着重要的应用价值。2004年,美国能源部专门成立了1,4-二羧酸组,研究苹果酸、延胡索酸和琥珀酸的生产工艺和应用[1]。以可再生生物质为原料的微生物发酵工艺生产C4二元羧酸的生产工艺具有原料来源广泛、对环境污染小等优势,因而备受各国研究人员的关注。酿酒酵母作为一种真核模式微生物,具有以下优点:(1)营养需求简单、易于培养、下游分离提取工艺低廉;(2)能够耐受较低的pH条件和高浓度的底物产生的渗透压胁迫;(3)长期用于食品、酿造等行业,被美国FDA认证为GRAS(Generally Regarded As Safe)微生物,发酵产品具有安全性[2]。因此,酿酒酵母被认为是生产C4二元羧酸的潜在最适微生物。
然而,酿酒酵母本身并不具备过量积累C4二元羧酸的代谢途径,而且在分批发酵中容易生成大量的副产物乙醇。这是酿酒酵母生产C4二元羧酸所面临的两大挑战[3]。酿酒酵母可以分别通过线粒体氧化途径[4]和胞质还原途径[5]来积累 C4二元羧酸,或者同时利用这两种途径来积累目标羧酸[6]。但是,对于以C4二元羧酸为目标产物来说,乙醇的产生导致了碳流的损失。针对这一难题,国外研究者主要采用了两种策略。一是敲除编码乙醇脱氢酶的ADH1-4基因,但这种策略不但没有消除乙醇的产生,还导致了甘油和乙醛的积累。二是敲除丙酮酸脱羧酶的关键基因PDC1,5,6,这种策略可以阻断乙醇的合成代谢,但导致细胞不能在高糖浓度条件下进行分批发酵[7]。荷兰代尔夫特工业大学的Pronk课题组,采用该策略获得的菌株在恒化条件下,通过添加乙酸和乙醇等二碳化合物,可以正常生长,但工艺较为复杂,且发酵周期较长[8-9]。
辅因子(如维生素、NADH等)水平在调控各种生化反应及碳代谢流方面扮演着重要的角色[10]。如图1所示,作为一种重要的辅因子,硫胺素的活性形式是硫胺素二磷酸(ThDP),而ThDP同为丙酮酸脱羧酶和丙酮酸脱氢酶复合体的辅因子[11],THI2是硫胺素合成途径中正调控因子[12]。NADH是碳代谢的关键辅因子。通过调控微生物细胞内辅因子的形式和水平,可以定向改变微生物细胞的代谢流。
该研究通过敲除THI2基因,阻断硫胺素的合成途径,并通过外源添加适量的硫胺素二磷酸,弱化丙酮酸的进一步代谢,以达到减少副产物乙醇的目的,在此基础上,通过外源添加NAD+,调控胞内NAD+/NADH比率,进一步促进糖代谢和菌体生长。
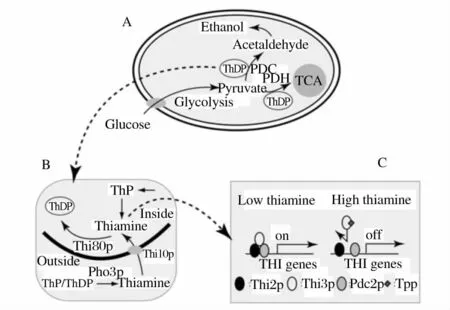
图1 酿酒酵母中乙醇合成途径、硫胺酸代谢途径和THI调控机制的相互关系[5]Fig.1 The relationships among the ethanol pathway,thiamine metabolism and THI regulatory system in S.cerevisiae.(a)Thiamine diphosphate(ThDP)in yeast pyruvate metabolism;(b)Schematic outline of thiamine metabolism in yeast;(c)A hypothetical model of the yeast THI regulatory system
1 材料与方法
1.1 菌株和质粒
酿酒酵母菌株Saccharomyces cerevisiae CEN.PK2-1C、敲除用质粒pUG27、标记回收质粒pSH47相关信息见表1。
1.2 培养基
固体培养基:葡萄糖 20 g,Yeast Nitrogen Base(without(NH4)2SO4)1.7 g,(NH4)2SO45 g,加水定容到1 000 mL,pH5.5,琼脂粉 20 g,115 ℃条件下灭菌15 min。倒平板前根据酵母的缺陷营养标记相应加入适量的灭过菌的氨基酸、嘌呤和嘧啶。
种子培养基:酵母粉10 g,蛋白胨 20 g,葡萄糖20,用1 000 mL水定容,pH自然,115℃条件下灭菌15 min。
发酵培养基(g/L):葡萄糖 60,NH4Cl 7,KH2PO45,MgSO4·7H2O 0.8,CaCO340,微量元素10 mL,pH5.0,115℃灭菌20 min,装液量为100 mL/250 mL,ThDP 单独添加,0.04 μmol/L。根据酵母的缺陷营养标记相应加入适量的灭过菌的氨基酸、嘌呤和嘧啶。
微量元素母液:称取 FeSO4·7H2O 2 g,CuSO4·5H2O 0.05 g,MnCl2·4H2O 0.2 g,CaCl2·2H2O 2 g,ZnCl20.5 g,用2 mol/L HCl溶液溶解后定容到1 000 mL,4 ℃保存。

表1 该研究所用的菌株、质粒和引物Table 1 Lists of strains,plasmids and primers used in this study
1.3 培养方法
保藏于甘油管里的酵母菌种经活化后接种到YPD种子培养基,培养至对数生长后期,离心弃上清,用无菌水洗涤1次,按4%的接种量接种到发酵培养基。置入30℃摇床培养,200 r/min,分别于4、8、12 h取样,取样后(此时为对数生长中期),添加不同浓度的 NAD+(200、1 000、5 000 μg/L),然后于16、24、36、48、60、72、84、96 h 取样,每次 1.0 mL,其中0.2 mL用于测定生物量(用1.0 mol/L的HCl溶解残留的Ca2CO3),0.8 mL用于代谢物的检测。
1.4 工程菌株的构建
以质粒 pUG27为模板,利用引物 THI2-F和THI2-R(表1)进行PCR扩增,PCR条件为94℃ 5 min;94℃ 30 s;55℃ 30 s,72℃ 2 min,29个循环;72℃延伸10 min。获得的PCR产物即为敲除盒,它包含有标记基因kanMX,loxP位点和THI2基因同源的序列。然后利用LiAc转化法将敲除盒直接转化到S.cerevisiae CEN.PK2-1C,涂布在SD(His-)平板上,培养3~5 d。长出的单菌落,接入SD(His-)液体培养基,培养后提取基因组,PCR验证确定为阳性菌落。考虑到进一步的代谢改造需要筛选标记,将用以消除标记的Cre表达质粒pSH47转化到酵母阳性转化子中,切除标记后,并将pSH47移除,最终获得的阳性转化子,将其命名为FMME-002△THI2。
1.5 分析方法
1.5.1 生物量的测定
取0.2 mL混合均匀的发酵液,用0.25 mol/L的HCl除掉发酵液中的CaCO3,并稀释适当的倍数,振荡混匀。待溶液澄清后,以稀HCl为空白,在600 nm波长处测定吸光值,以测得的OD值作为菌体生物量。
1.5.2 代谢物分析
HPLC检测代谢物,葡萄糖、乙醇用RID检测器;色谱柱为 Aminex HPX-87H,流动相为体积分数为0.0275%的H2SO4。
2 结果与讨论
2.1 THI2的敲除对菌株发酵的影响
考察了硫胺素合成缺陷对乙醇形成及菌株发酵特性的影响,结果如表2所示。发酵进行到96 h时,对照菌株FMME-002可积累乙醇5.27±0.23 g/L;相比之下,THI2敲除后,乙醇产量减少到0.53±0.12 g/L。但是,THI2的敲除,导致了菌体生长的减弱,进入稳定期时(24 h),生物量仅为1.32±0.11,是对照菌株的46.8%;24 h后,FMME-002△THI2几乎停止消耗葡萄糖,发酵进行到96 h时,对照菌株FMME-002已将葡萄糖消耗完,而此时FMME-002△THI2仍有约45.80±0.22 g/L的葡萄糖尚未消耗完。
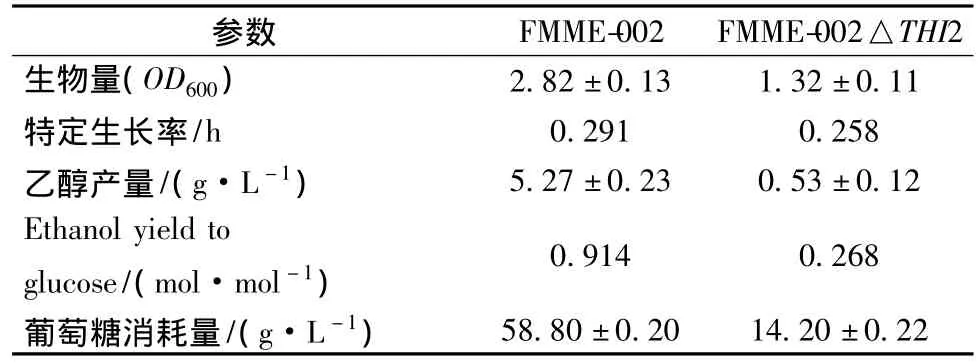
表2 THI2敲除前后生长及代谢物的比较Table 2 Comparison of growth and metabolite yields of FMME-002 and FMME-002△THI2
在该研究中,THI2基因的敲除,阻断了硫胺素的合成,进而影响了丙酮酸脱氢酶、丙酮酸脱羧酶及α-酮戊二酸脱氢酶的活性。丙酮酸脱氢酶是丙酮酸参与TCA循环的第一个关键酶,而α-酮戊二酸脱氢酶又是TCA循环的关键酶[11],其活性的下降,会导致TCA循环的减弱,从而影响菌体的生长。此外,ThDP是HMP途径总转酮酶的辅酶,当胞内硫胺素供应不足时,HMP途径代谢受阻,而NADPH又是通过HMP途径代谢产生的,硫胺素的不足会导致NADPH的不足,从而影响到细胞的合成代谢,进而导致葡萄糖的消耗停止[14]。
2.2 VB1的添加对菌株发酵特性的影响
作为一种重要的辅因子,硫胺素在调控菌体生长和代谢中扮演着重要的角色。为了既达到减少乙醇的目的,又对生长和葡萄糖消耗不造成过多的影响,进一步考察了外源添加ThDP对菌体发酵特性的影响,研究结果如图2所示。不添加ThDP时,菌体生物量仅有1.56±0.11,乙醇产量为1.87±0.11 g/L,消耗的葡萄糖为17.32±1.14 g/L。相比之下,添加0.04 μmol/L ThDP时,菌体生物量上升到2.24±0.08,乙醇产量上升到2.56±0.15 g/L,葡萄糖消耗量为24.93±0.63 g/L,较不添加时分别提高了43.6%,36.9%,43.9%。尽管进一步提高 ThDP的添加量,可以进一步促进葡萄糖的消耗和菌体生长,但会导致乙醇的产量提高,违背了减少副产物乙醇的目的。

图2 硫胺素的添加对菌株FMME-002△THI2发酵特性的影响Fig.2 Effect of thiamine on the growth and compound yields of FMME-002△THI2 during aerobic batch growth on 6%glucose
在外源添加 0.04 μmol/L ThDP的条件下,FMME-002△THI2的菌体生长仍然较弱,且仍有较多的残糖不能被消耗。可能的原因有两点:一是硫胺素的不足影响了HMP途径的进行,进而影响了细胞的合成代谢;二是糖酵解产生的NADH不能被进一步氧化,导致胞内NAD+的不足,影响了糖酵解途径的进行,进而导致葡萄糖不能被消耗。糖酵解途径产生的NADH主要通过2种途径被氧化:一是进入TCA循环,将电子传递个分子氧;二是通过丙酮酸脱氢酶旁路代谢,利用底物水平磷酸化将电子传递给乙醛,进而生成乙醇[15]。在该研究中,硫胺素的供应不足同时影响了TCA循环和丙酮酸脱氢酶旁路代谢,因此,可以通过外源增加NAD+的浓度来维持胞内NAD+/NADH的平衡来促进葡萄的消耗。
2.3 NAD+的添加对菌株发酵特性的影响
考察了在发酵进行到12 h外源添加不同浓度的NAD+(200、1 000、5 000 μg/L)对菌体生长、葡萄糖消耗等的影响。研究发现,添加1 000 μg/L NAD+时,对菌体生长、葡萄糖消耗等参数的促进作用最为显著,过多的添加NAD+会导致菌体生长和葡萄糖消耗速率有所下降。以下详细考察了添加1 000 μg/L NAD+对菌株 FMME-002△THI2发酵特性的影响。结果如图3所示,当发酵进行到12 h,添加1 000 μg/L的NAD+能促进菌体的生长,发酵进行到48 h时,生物量为3.12±0.11,较对照提高了47.2%(图3-a);NAD+的添加能明显地促进葡萄糖的消耗,发酵进行到96 h时,葡萄糖消耗量为53.8±1.1 g/L,较对照糖耗(36.2±1.2g/L)提高了48.6%(图3-b);当添加的NAD+的终浓度为1 000 μg/L时,发酵进行到24 h时,乙醇的积累量为3.12±0.2 g/L,较不添加时(2.56±0.15 g/L)仅提高了0.56 g/L(图33-c)。
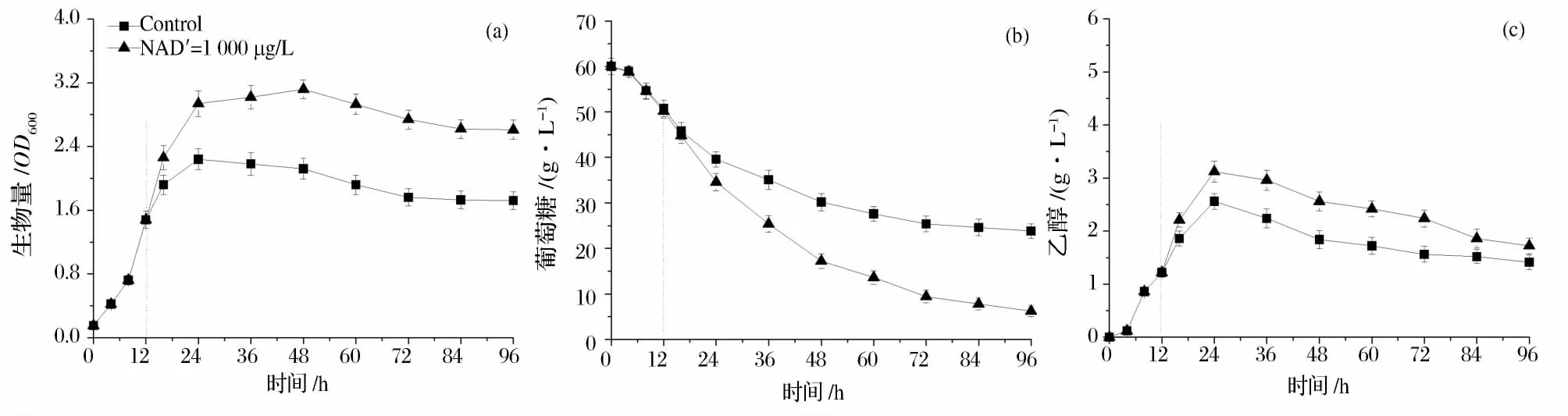
图3 NAD+的添加对菌株FMME-002△THI2发酵特性的影响Fig.3 Effect of NAD+on the fermentation profile of the strain FMME-002△THI2
通过调控NAD+/NADH能有效地调节微生物细胞的生长及其代谢功能[16]。Liu等[17]在光滑球拟酵母发酵生产丙酮酸过程添加8 mg/L NAD+合成前体烟酸,使得葡萄糖消耗速率和丙酮酸产量分别提高了48.4%和29%。在该研究中,NAD+的添加有效地促进了葡萄糖的消耗和菌体的生长,同时也没有明显促进乙醇的形成。通过这种策略,达到了在对葡萄糖的消耗及菌体生长影响很小的前提下,实现了减少副产物乙醇的形成的目的。
3 结论
THI2的敲除可以减少乙醇的形成,但极大地影响了葡萄糖的消耗和菌体的生长;外源添加ThDP,可以促进葡萄糖的消耗和菌体的生长,但同时也促进了乙醇的积累;在外源添加少量(0.04 μmol/L)的ThDP 的基础上,添加适量(1 000 μg/L)的 NAD+,可以明显地促进葡萄糖的消耗和菌体的生长,但又不会明显地促进乙醇的积累。因此,通过敲除硫胺素合成途径中的基因THI2,阻断硫胺素的合成,同时外源添加少量的ThDP,并通过添加适量的NAD+,可以实现减少乙醇的目标,但又不影响葡萄糖消耗和菌体的生长,是减少副产物乙醇形成的一个有效的策略。
[1]Zelle R M,de Hulster E,van Winden W A,et al.Malic acid production by Saccharomyces cerevisiae:Engineering of pyruvate carboxylation,oxaloacetate reduction,and malate export[J].Appl Environ Microb,2008,74(9):2 766 -2 777.
[2]Nevoigt E.Progress in metabolic engineering of Saccharomyces cerevisiae[J].Microbiol Mol Biol Rev,2008,72(3):379-412.
[3]Abbott D A,Zelle R M,Pronk J T,et al.Metabolic engineering of Saccharomyces cerevisiae for production of carboxylic acids:current status and challenges[J].FEMS Yeast Res,2009,9(8):1 123-1 136.
[4]XU G Q,ZOU W,CHEN X L,et al.Fumaric acid production in Saccharomyces cerevisiae by in silico aided metabolic engineering[J].Plos One,2012,7(12):
[5]XU G,HUA Q,DUAN N,et al.Regulation of thiamine synthesis in Saccharomyces cerevisiae for improved pyruvate production[J].Yeast,2012,29(6):209 -217.
[6]XU G Q,CHEN X L,LIU L M,et al.Fumaric acid production in Saccharomyces cerevisiae by simultaneous use of oxidative and reductive routes[J].Bioresource Technol,2013,148:91-96.
[7]Drewke C,Thielen J,Ciriacy M.Ethanol formation in adh0 mutants reveals the existence of a novel acetaldehydereducing activity in Saccharomyces cerevisiae[J].J Bacteriol,1990,172(7):3 909 -3 917.
[8]Flikweert M T,van Dijken J P,Pronk J T.Metabolic responses of pyruvate decarboxylase-negative Saccharomyces cerevisiae to glucose excess[J].Appl Environ Microbiol,1997,63(9):3 399-3 404.
[9]van Maris A J,Geertman J M,Vermeulen A,et al.Directed evolution of pyruvate decarboxylase-negative Saccharomyces cerevisiae,yielding a C2-independent,glucose-tolerant,and pyruvate-hyperproducing yeast[J].Appl Environ Microbiol,2004,70(1):159 -166.
[10]San K Y,Bennett G N,Berrios-Rivera S J,et al.Metabolic engineering through cofactor manipulation and its effects on metabolic flux redistribution in Escherichia coli[J].Metab Eng,2002,4(2):182 -192.
[11]Hohmann S,Meacock P A.Thiamin metabolism and thiamin diphosphate-dependent enzymes in the yeast Saccharomyces cerevisiae:genetic regulation[J].Biochim Biophys Acta,1998,1385(2):201-219.
[12]Nishimura H,Kawasaki Y,Kaneko Y,et al.Cloning and characteristics of a positive regulatory gene,THI2(PHO6),of thiamin biosynthesis in Saccharomyces cerevisiae[J].FEBS Lett,1992,297(1 -2):155 -158.
[13]Guldener U,Heck S,Fielder T,et al.A new efficient gene disruption cassette for repeated use in budding yeast[J].Nucleic Acids Res,1996,24(13):2 519 -2 524.
[14]HUA Q,YANG C,Shimizu K.Metabolic flux analysis for efficient pyruvate fermentation using vitamin-auxotrophic yeast of Torulopsis glabrata[J].J Biosci Bioeng,1999,87(2):206-213.
[15]Vemuri G N,Eiteman M A,McEwen J E,et al.Increasing NADH oxidation reduces overflow metabolism in Saccharomyces cerevisiae[J].Proc Natl Acad Sci U S A,2007,104(7):2 402-2 407.
[16]YING W.NAD+and NADH in cellular functions and cell death[J].Front Biosci,2006,11:3 129 -3 148.
[17]LIU L,LI Y,SHI Z,et al.Enhancement of pyruvate productivity in Torulopsis glabrata:Increase of NAD+availability[J].J Biotechnol,2006,126(2):173 -185.

