超声-微波协同萃取法提取油菜蜂花粉中黄酮类物质
孙岩,郭庆兴,童群义
1(江南大学食品学院,江苏无锡,214122)
2(百威英博(佛山)啤酒有限公司,广东 佛山,528100)
油菜蜂花粉是工蜂从油菜花蕊内采集的花粉粒,主要成分为蛋白质、多糖、多酚、黄酮、必需氨基酸、维生素[1]等。因富含黄酮类化合物,常具有抗氧化、降血压、降血脂、防治糖尿病和前列腺炎[2-9]等功效。黄酮类化合物种类繁多,目前从油菜蜂花粉中发现的黄酮类化合物有山奈酚、槲皮素、异鼠李素、杨梅黄酮、柚皮素等多种黄酮苷类和苷元。郭娟丽等[10]利用NMR、MS等方法鉴定出油菜蜂花粉含有山奈酚、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷,山奈酚-3,4'-双-O-β-D-吡喃葡萄糖苷,槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷等9种单体。陈莲君[11]利用NMR鉴定出油菜蜂花粉主要含有3种黄酮类,为山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、槲皮素-3-O-β-D-吡喃葡萄糖苷和山奈酚-3-O-β-D-吡喃葡萄糖苷。而鲁国庆[12]则从油菜蜂花粉残渣中鉴定出了山奈酚、异鼠李素、山柰酚-3-O-β-D-葡萄糖苷、山柰酚-3-O-β-D-葡萄糖-(1→2)-β-D-葡萄糖苷、异鼠李素-3-O-β-L-鼠李糖-(1→2)-β-D-葡萄糖苷。
目前常用的以固体原料来提取黄酮类倾合物的方法主要有热回流法、超声波法、微波法、超临界CO2萃取法[13]。热回流法成本低,操作简便易行,因此最为常用,但存在耗时长、提取效率低的弊端,此外,在提取过程中更多的非目标成分被提取出来,使得后续的分离纯化步骤难度增加[14]。超声法和微波法提取效率相对较高,前者是利用空穴作用破坏植物细胞结构,提高有效成分溶出和扩散,后者则是通过高能作用破坏植物细胞结构,增加有效成分溶出,利用微波电磁场加速扩散,并且不同物质的微波吸收能不同,可实现选择性萃取[15]。超声-微波协同萃取法即是充分结合了超声波及微波的优点,实现了低温常压环境下对固体样品快速、高效、可靠的处理,成本相对超临界CO2萃取也较低。
目前对上述常用方法的研究较多[16-18],但用超声-微波协同萃取油菜蜂花粉中黄酮类物质的研究少有报道。实验通过单因素实验和正交实验优化了提取工艺,同时与上述几种常用方法进行了比较,并利用LC-MS对制得的黄酮类化合物种类进行了分析。
1 材料与方法
1.1 材料与仪器
油菜蜂花粉(烘干粉碎过100目筛,低温保藏),江苏省庆缘康生物科技有限公司;芦丁(标准品,≥98%),阿拉丁试剂有限公司;无水乙醇、石油醚(30℃~60℃)、Al(NO3)3、NaNO2、NaOH,国药试剂有限公司,分析纯;甲醇、乙腈、甲酸,国药试剂有限公司,色谱纯。
CW-2000超声-微波协同萃取仪(超声波固定频率40 kHz,功率50 W),上海新拓分析仪器科技有限公司;UV-2100紫外可见分光光度计,尤尼柯(上海)仪器有限公司;AB104-N电子天平,Mettler-ToledoInstr(ShangHai)Ltd;FA1004电子天平,上海天平仪器厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司;FW-80-I高速万能粉碎机,天津泰斯特仪器有限公司;101-2-BS电热恒温鼓风干燥箱,上海跃进医疗器械厂;液相色谱四级杆飞行时间质谱仪(LC-Q-TOF),美国Waters公司;Waters 600高效液相色谱仪,Waters公司(美国)。
1.2 实验方法
1.2.1 原料预处理
准确称取2.0 g过筛后的油菜蜂花粉,用滤纸和脱脂棉线包成滤纸包,于索氏抽提器中抽提8 h,除去油脂和色素等杂质,抽提完成后挥干石油醚,低温储藏,备用。
1.2.2 芦丁标准曲线的绘制
参照中国药典[16]描述的方法并加以改进测定总黄酮含量。
准确称取芦丁标准品30.00 mg,用无水乙醇溶解,超声10 min使其完全溶解,然后转移入100 mL容量瓶,用无水乙醇定容至刻度线,配制成0.300 0 mg/mL 的芦丁标准溶液。分别取 0、1、2、3、4、5 mL芦丁标准溶液,依次加入0~5号25 mL容量瓶中,并用蒸馏水补足体积到6 mL;加入1 mL质量分数5.0%NaNO2,摇匀,静置6 min;然后加入1 mL质量分数10%Al(NO3)3,摇匀,静置6 min;再加入10 mL质量分数4.0%NaOH,用体积分数50%乙醇定容至刻度,摇匀,静置10 min;于510 nm下测定吸光值。以芦丁溶液浓度为横坐标x,吸光值为纵坐标y,绘制标准曲线。标准曲线为:y=11.457 2x-0.002 3,R2=0.999 5。
1.2.3 样品总黄酮含量的测定
将样品液稀释到适宜浓度,然后取1 mL置于25 mL容量瓶,根据1.2.2测定方法,在510 nm下测定样品吸光值。用标准曲线方程计算得出样品液浓度,然后计算总黄酮提取率(以芦丁计,%)。
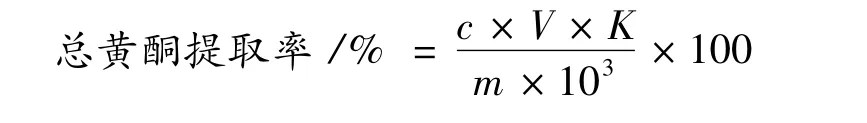
式中:c为从标准曲线查得的总黄酮浓度,mg/mL;V为提取液总体积,mL;K为提取液稀释倍数;m为原料质量,g。
1.2.4 超声微波协同萃取油菜蜂花粉中黄酮类物质
1.2.4.1 单因素实验
以油菜蜂花粉总黄酮提取率为指标,考察乙醇体积分数(%)、提取时间(s)、液料比(mL∶g)、微波功率(W)4个因素对提取效果的影响,以确定后续正交实验各因素水平。
(1)乙醇体积分数
准确称取2.0 g油菜蜂花粉,按1.2.1进行预处后,依照固定液料比20∶1,提取时间180 s,微波功率200 W不变,分别在乙醇体积分数为50%、60%、70%、80%、90%、100%的条件下进行超声微波协同萃取。
(2)提取时间
准确称取2.0 g油菜蜂花粉,按1.2.1进行预处后,固定乙醇体积分数90%,液料比20∶1,微波功率200 W 不变,分别在提取时间为 60、120、180、240、360、480 s的条件下进行萃取。
(3)料液比(mL∶g)
准确称取2.0 g油菜蜂花粉,按1.2.1进行预处后,固定乙醇体积分数90%,提取时间240 s,微波功率200 W 不变,分别在液料比为 10∶1、20∶1、30∶1、40∶1、50∶1、60∶1的条件下进行萃取。
(4)微波功率
准确称取2.0 g油菜蜂花粉,按1.2.1进行预处后,依照固定乙醇体积分数90%,提取时间240 s,液料比 30∶1不变,分别在 50、100、200、300、400、500 W的条件下进行萃取。
1.2.4.2 提取工艺优化
根据单因素实验结果,采用L9(34)的正交实验设计,进一步优化油菜蜂花粉黄酮类物质的提取工艺参数。每个实验重复3次。实验因素水平见表1。
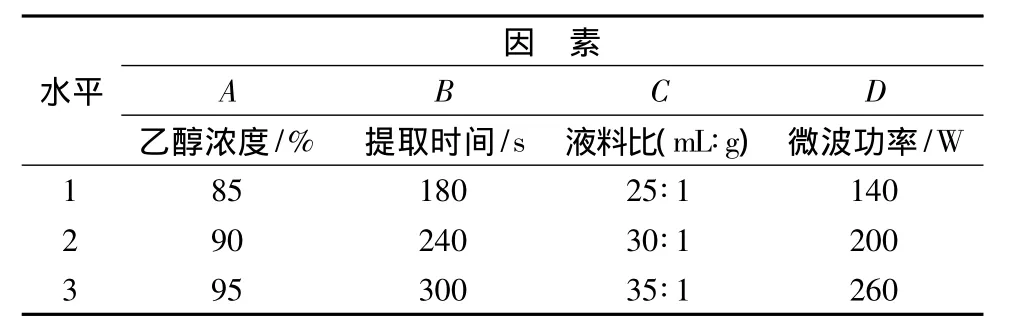
表1 正交因素水平设计表Table 1 Design of orthogonal experiment
1.2.5 油菜蜂花粉黄酮类物质的LC-MS分析
采用优化的超声-微波协同萃取最佳工艺进行提取,抽滤提取液,然后旋转蒸发浓缩滤液,浓缩液经冷冻干燥制得黄酮粗提物,取适量,用色谱纯甲醇溶解,再用0.45 μm微孔滤膜过滤,制成澄清透明的液体,供LC-MS分析。
色谱条件:流速0.3 mL/min;进样体积:0.3 μL;检测波长:200~400 nm;色谱柱:Waters Acquity UP-LC BEH Shield RP C18柱(100 mm ×2.1 mm,1.7 μm);柱温:45℃;样品温度20℃;流动相:乙腈/0.1%甲酸,梯度洗脱:0~8 min,乙腈体积分数10%~60%;8~15 min,乙腈体积分数60%~100%。
质谱条件:离子源:ESI电离源;电喷雾离子化负离子采集模式(ESI-);m/z范围:50~1 000;毛细管电压:3.0 kV;锥孔电压:20.0 V;碰撞能量:4.0 eV,离子源温度:100℃;脱溶剂温度:400℃。
2 结果与讨论
2.1 单因素实验结果与讨论
2.1.1 乙醇体积分数对提取效果的影响
如图1所示,总黄酮提取率随乙醇体积分数的增加而提高。这是因为黄酮类物质是弱极性化合物,易溶于弱极性溶剂。因此,综合考虑选择体积分数90%~95%的乙醇作为后续提取溶剂。
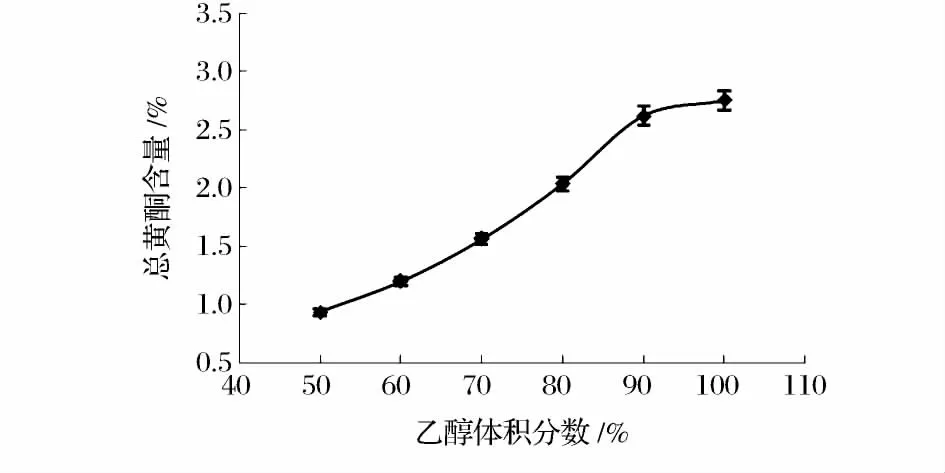
图1 乙醇体积分数对提取效果的影响Fig.1 Influence of ethanol concentration on extraction effect
2.1.2 时间对提取效果的影响
如图2所示,在240 s以前总黄酮提取率随时间延长而提高,大于240 s后提取率基本不变,在360 s之后略有下降,可能是因为作用时间延长使得提取液温度较高,破坏了黄酮母核的结构。为尽量降低高温对黄酮结构的造成破坏的可能性,尽量选择较的处理短时间。因此,实验选择提取时间240 s。

图2 提取时间对提取效果的影响Fig.2 Influence of extraction times on extraction effect
2.1.3 液料比对提取效果的影响
如图3所示,液料比从10∶1增加到30∶1的过程中,总黄酮提取率显著提高,在料液比达到30∶1之后随着溶剂用量的增加提取率变化平缓。这可能是由于液料比达到30∶1时,总黄酮几乎已经被萃取完全。另外,进一步加大溶剂用量,会增加原料及后续浓缩工艺的成本,因此选用液料比30∶1较合理。
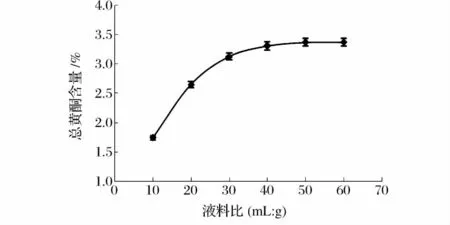
图3 液料比对提取效果的影响Fig.3 Influence of liquid-solid ratio on extraction effect
2.1.4 微波功率对提取效果的影响
如图4所示,200 W以前总黄酮提取率随微波功率增加而提高,200 W以后随功率增加而下降。由于微波对花粉细胞壁的破碎作用随着功率的增加而逐渐增强,从而有利于黄酮溶出,当达到300 W左右后,提取液温度较高,使得部分黄酮母核结构发生改变,从而降低提取率,因此实验中选取200 W。

图4 微波功率对提取效果的影响Fig.4 Influence of microwave power on extraction effect
2.2 提取工艺优化结果与讨论
极差分析结果表明(见表2),各因素对提取效果影响大小顺序为A>C>D>B,正交试验结果确定最佳提取条件为A2C3D3B3。方差分析结果表明(见表3),A、C和D因素的不同水平对总黄酮提取率有显著差异,而B因素在所实验范围内没有显著差异。因此,综合考虑节能,在实验条件范围内,油菜蜂花粉总黄酮最佳提取条件为A2C3D3B1,即乙醇体积分数90%,液料比30∶1,微波功率260 W,时间180 s。
最佳提取工艺确定:分析确定最佳提取工艺A2C3D3B1,即乙醇体积分数90%,液料比30∶1,微波功率260 W,时间180 s。
根据选择的最佳提取条件A2C3D3B1进行实验,计算总黄酮提取率,验证最佳实验条件,实验重复3次。结果表明,在该实验条件下,总黄酮提取率为3.36%,符合正交实验(表2)的结果,因此选择的最佳提取工艺可行。

表3 正交试验方差分析Table 3 Variance analysis of orthogonal experiment
2.3 不同提取方法比较
根据正交实验所选最优工艺及陈莲君[11]、杨洁[20]、焦士蓉[21]等报道的热回流、超声法最优提取工艺,确定不同提取方法比较的实验参数,固定乙醇体积分数90%,液料比30∶1不变,其他参数如表4所示。结果表明,超声-微波协同萃取总黄酮得率明显高于超声法和微波法,略高于热回流法,但提取时间明显短于热回流法,在提取效率上具有明显优势。可能是因为超声波的空化作用,加之微波的高能作用,共同促进了乙醇的浸入,加速了黄酮在溶剂中的溶解和扩散,大大减少了提取用时。
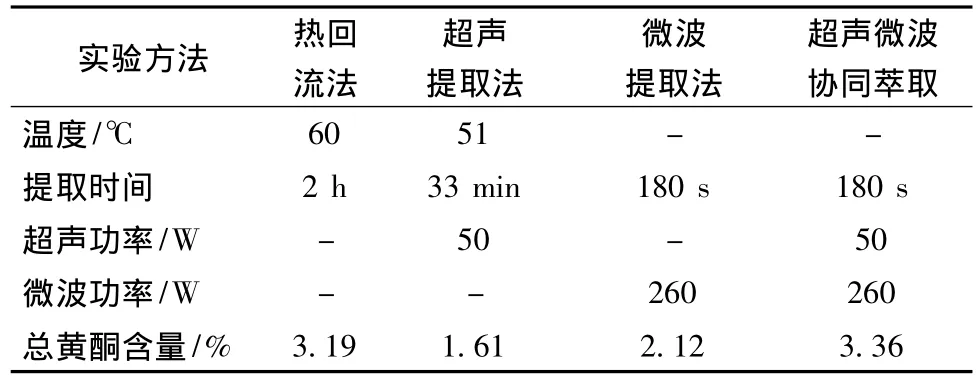
表4 不同提取方法的比较Table 4 Comparison of different extraction method
2.4 油菜蜂花粉黄酮类物质的LC-MS分析
黄酮类化合物的结构特点使得其在HPLC条件下具有特征紫外光谱吸收带,图5为超声微波协同萃取得到的油菜蜂花粉黄酮类物质在350 nm下的液相色谱图。

图5 油菜蜂花粉黄酮液相色谱图Fig.5 HPLC diagram of flavonoids extracted fromBrassica napus L.pollen
MS分析对液相色谱图中出现的色谱峰分别进行负离子的1、2级飞行时间质谱研究,得到1、2级质谱图,见图6~图9,其中a、b分别为1、2级质谱图。
化合物1:色谱峰1在4.02 min时的1级质谱给出准分子离子峰[M-H]-625.068 2;2级质谱给出[M-H]-丢失1个葡萄糖的碎片离子峰[(M-H)-162]-463.054 0,及[M-H]-丢失2个葡萄糖的槲皮素苷元的碎片离子峰[(M-2H)-162×2]-299.999 5。
化合物2:色谱峰4.12 min的1级质谱给出准分子离子峰[M-H]-609.065 2,2级质谱给出[M-H]-丢失1个葡萄糖的碎片离子峰[(M-H)-162]-447.056 7,及[M-H]-丢失2个葡萄糖的山奈酚苷元的碎片离子峰[(M-H)-162×2]-285.019 8。
化合物3:色谱峰4.50 min的1级质谱给出准分子离子峰[M-H]-639.088 5,2级质谱给出[M-H]-丢失2个葡萄糖的碎片离子峰[(M-2H)-162×2]-314.023 3,可能是异鼠李素苷元的碎片离子峰。
化合物4:色谱峰4.68 min的1级质谱给出准分子离子峰[M-H]-609.065 2,2级质谱给出[M-H]-丢失2个葡萄糖的碎片离子峰[(M-2H)-162×2]-284.013 6,可能是山奈酚苷元的碎片离子峰。
根据阿布拉江·克依木[22]对黄酮醇O-双糖苷类化合物、黄酮醇二-O糖苷类化合物质谱行为的详细报道和郭娟丽[10]对油菜花粉中醇提组分的结构鉴定结果,结合本实验质谱图所对应的离子峰的质谱信息,推断HPLC分离出的4个主要峰所对应的化合物依次为:槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷、山奈酚-3,4'-双-O-β-D-吡喃葡萄糖苷、异鼠李素-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷。

图6 化合物1的质谱图及结构式Fig.6 The mass spectrum andstructural formula of compound 1
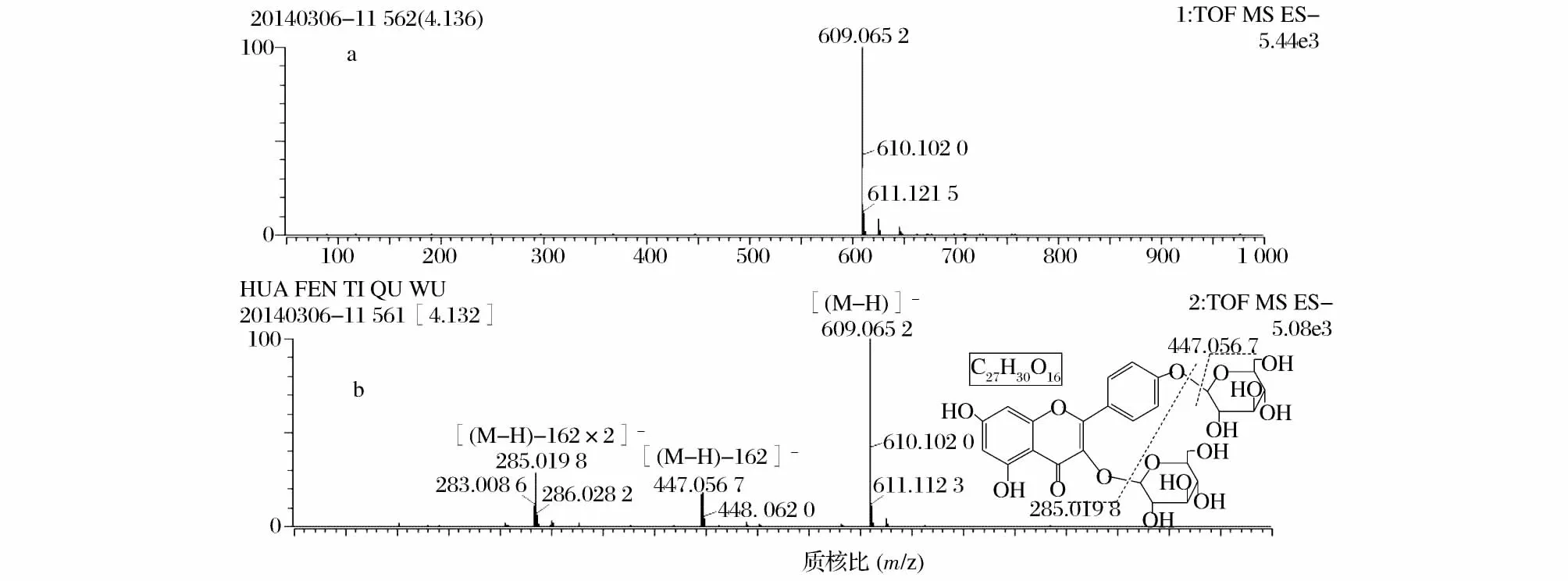
图7 化合物2的质谱图及结构式Fig.7 The mass spectrum and structural formula of compound 2
3 结论
通过单因素和正交实验确定超声-微波协同萃取油菜蜂花粉中总黄酮类物质最佳条件:乙醇体积分数90%,液料比(mL∶g)30∶1,微波功率 260 W,时间180 s。该条件下,油菜蜂花粉中总黄酮提取率为3.36%。
不同提取方式的对比实验结果表明,超声-微波协同萃取法提取效率较热回流法、超声法和微波法明显提高,并且降低了高温高压条件导致的萃取物生物活性被破坏的可能。因此,超声-微波协同萃取是一种较为理想的提取方法,具有高效、节能,安全的优点,对油菜蜂花粉黄酮类物质的提取具有一定的应用价值。
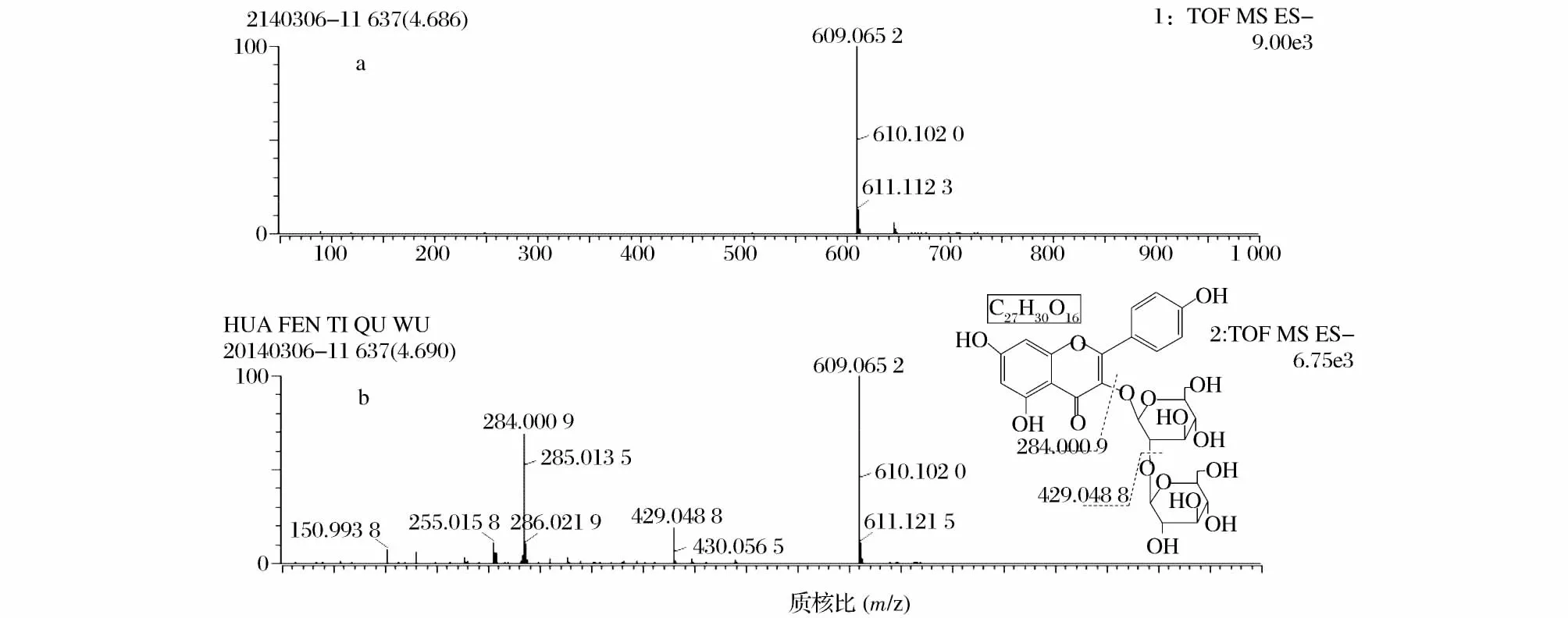
图9 化合物4的质谱图及结构式Fig.9 The mass spectrum andstructural formula of compound 4
超声-微波协同萃取得到的油菜蜂花粉黄酮类物质经LC-MS鉴定主要为4种。以液相色谱图和质谱图为依据,参考文献报道分析,推断出这4种化合物可能为槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷、山奈酚-3,4'-双-O-β-D-吡喃葡萄糖苷、异鼠李素-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷。准确结构信息,还需要进一步分析和鉴定。
[1]徐景辉,庄元忠.蜂蜜花粉研究与利用[M].北京:中国医药科技出社,1991:1-3.
[2]任乃艳,卢容,程妮,等.蜂花粉活性成分研究进展[J].中国蜂业,2011(62):76 -78.
[3]LIU Yu-jian,ZHAN Jian,LIU Xiao-li,et al.Dietary flavonoids intake and risk of type 2 diabetes:A meta-analysis of prospective cohort studies,Clinical Nutrition(2013),http://dx.doi.org/10.1016/j.clnu.2013.03.011.
[4]Mohan S,Nandhakumar L.Role of various flavonoids:Hypotheses on novel approach to treat diabetes,J Med Hypot-heses Ideas (2013),http://dx.doi.org/10.1016/j.jmhi.2013.06.001.
[5]CHEN Fu-feng,XIONG Hui,WANG Jian-xia,et al.Antidiabetic effect of total Flavonoids from Sanguis draxonis in type 2 diabetic rats.Journal of Ethnophar macology(2013),http://dx.doi.org/10.1016/j.jep,2013.07.035.
[6]沈威.柑橘黄酮对血糖的调节及其作用机制[D].上海.华东理工大学,2013.
[7]韩慧英.前列康及其原料油菜花粉(Brassica napusL.pollen)活性成分的研究[D].沈阳.沈阳药科大学,2012.
[8]董捷,张红城,李慧,等.八种蜂花粉醇提物的体外抗氧化能力研究[J].营养学报,2010,32(3):309-312.
[9]陈南迪,方妙玉,无锡鸿,等.不同品种蜂花粉总黄酮含量与抗氧化活性相关性的研究[J/OL].食品工业科技,http://www.cnki.net/kcms/detail/11.1759.TS.20121019.1103.004.html.
[10]郭娟丽,张培成,张智武.油菜花粉的化学成分研究[J]. 中国中药杂志,2009,34(10):1 235-1 237.
[11]陈莲君.油菜花粉活性陈分的提取分离及结构鉴定[D].无锡.江南大学,2012.
[12]鲁国庆,范思洋,杨义芳,等.油菜花粉化学残渣的化学成分[J].中国医药工业杂质,2013,44(7):669-672.
[13]李丽.基于高速剪切技术的油菜蜂花粉黄酮提取工艺研究[D].兰州.兰州大学,2012.
[14]姚秋萍.油菜花粉超微粉有效成分溶出、代谢特征及指纹图谱研究[D].福州.福建农林大学,2009.
[15]卢彦芳,张福成,安静,等.微波辅助萃取应用研究进展[J].分析科学学报,2011,27(2):246-252.
[16]李雪梅,陈辉,李书国,等.马尾松花粉中总黄酮类物质提取条件研究[J].食品工业科技,2011,(9):264-266.
[17]龚明贵,张巧明,尤晓颜.超声波辅助提取荷花粉黄酮[J]. 农业工程,2013,3(6):99 -101.
[18]张利燕,常虹,周家华,等.植物花中黄酮类化合物的提取技术及其生物活性研究现状[J].食品工业,2012,33(5):96 -99.
[19]中国药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[20]杨洁,陈纯,邢建军,等.油菜蜂花粉中黄酮类化合物的提取与鉴定[J].食品科学,2010,31(22):273-278.
[21]焦士蓉,王玲,赵燕,等.油菜花粉总黄酮的微波辅助提取及其抗氧化活性研究[J].生物加工过程,2009,7(6):51-54.
[22]阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].北京.中国协和医科大学大学,2003.

