雷公藤甲素对阿霉素肾病大鼠肾脏乙酰肝素酶表达及蛋白尿的影响
曹英杰,陈晓岚范亚平,杨红利
(南通大学附属医院肾脏内科,江苏 南通 226001)
HSPG是肾小球基底膜的重要组成成分,构成肾小球滤过的电荷屏障,其结构的破坏系导致蛋白尿的重要原因。Hpa是一种葡萄糖醛酸内切酶,能识别HSPG的侧链[1-2]。将侧链水解为多个小分子片段,导致肾小球基底膜电荷屏障的破坏。近年来研究表明其表达异常与蛋白尿的发生发展有密切关系[3-4]。雷公藤的主要有效成分雷公藤甲素(triptolide),具有多种药理作用,包括免疫抑制、抑制炎性反应、抗肿瘤、抗生育等。在各种肾小球疾病中,其可以通过多种有效机制保护及修复肾小球足细胞[5-6]。本实验中我们观察阿霉素肾病大鼠模型肾小球中Hpa和HSPG的表达,及雷公藤甲素治疗后表达的改变,探讨Hpa在此模型中的病理作用及其可能的致病机制,及雷公藤甲素对其的保护作用,为临床治疗肾脏病提供理论基础和作用靶点。
1 材料与方法
1.1 材料与试剂
健康清洁级雄性SD大鼠,每只体重200~230g,取自南通大学实验动物中心。兔抗鼠Hpa抗体购于Groundwork Biotechnology Diagnosticate公司,羊抗鼠HSPG抗体购于lifespan公司,生物素化羊抗兔和兔抗羊二抗购于北京中杉金桥生物技术有限公司。注射用阿霉素购于浙江海正药业股份有限公司(生产批号091002),雷公藤甲素购自南京泽朗医药科技有限公司。
1.2 动物分组及处理
适应性喂养SD大鼠1周后按随机分组法分为3组,①A组(对照组);②B组(阿霉素模型组):大鼠尾静脉一次性注射阿霉素5mg/kg;③C组(雷公藤甲素治疗组):大鼠尾静脉一次性注射阿霉素5mg/kg后,次日起给予雷公藤甲素(0.2mg/kg/d)灌胃,连续治疗4周。其中A组及B组均在次日给予同疗程等量生理盐水灌胃。
1.3 观察指标
1.3.1 大鼠24h尿蛋白定量 两组大鼠分别在注射阿霉素前(0d)及注射后第7、14、21、28d单独置代谢笼,收集24h尿液,24h尿蛋白定量测定应用双缩脲比浊法。
1.3.2 大鼠肾组织Hpa及HSPG的表达 4%多聚甲醛固定大鼠肾组织,制3μm石蜡切片,行HE、PAS染色。按试剂盒说明书操作免疫组化,脱蜡水化3μm石蜡切片,热诱导修复,3%过氧化氢20min后,20%羊血清室温孵育30min,分别滴加一抗兔抗鼠Hpa(1∶100)和羊抗鼠HSPG(1∶50)4℃过夜。滴加二抗50μl,湿盒37℃孵育30min,DAB显色,苏木素衬染色,树脂封片。每只大鼠肾组织切片选取随机5个肾小球高倍视野,阳性为呈棕黄色颗粒状物质沉积,全自动图像分析系统(Leica公司,Quantiment 570970)扫描分析,计算阳性吸光度值。
1.4 统计学分析
各组数据以均数±标准差表示,各个组间均数比较采用单因素方差分析,各时间点两两比较采用t检验,相关性分析采用Pearson分析。数据处理采用SPSS 17.0统计软件,P<0.05为差异有统计学意义。
2 结果
2.1 模型组及对照组肾脏病理改变
注射阿霉素2周后光镜下肾小球改变不明显,电镜下见上皮细胞足突广泛融合,提示造模成功,符合肾小球微小病变病理特征(图1B组)。A组为对照组。

图1 阿霉素肾病大鼠及对照组大鼠肾脏病理改变
2.2 各组大鼠24h尿蛋白定量的变化
见表1。
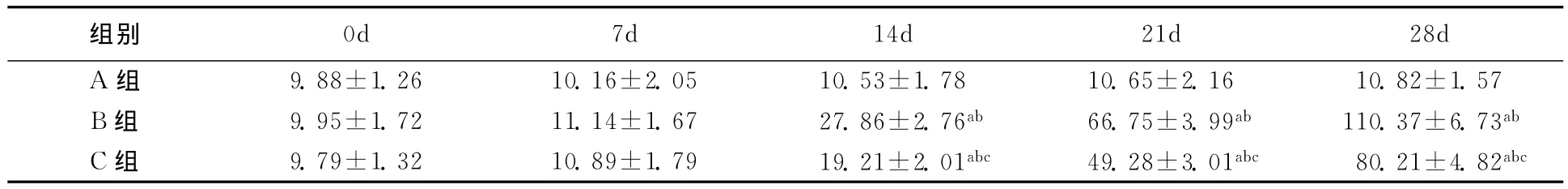
表1 各组不同时间点24h尿蛋白定量的变化 mg/24h
A组各时间点24h尿蛋白定量差异无统计学意义(P>0.05)。B组第7天24h尿蛋白定量有所增加,但与A、C组比较差异无统计学意义(P>0.05);第14、21及28天时,B组24h尿蛋白定量较同时间点A组及同组前一时间点明显升高,差异有统计学意义(P<0.05)(表1)。C组中第14、21及28天时尿蛋白定量较同时间点A组及同组前一时间点明显升高,差异有统计学意义(P<0.05);而与B组比明显下降,差异有统计学意义(P<0.05)。
2.3 肾组织中Hpa及HSPG的表达
A组各时间点Hpa的表达无明显差异(P>0.05)。第14、21及28天时,B组、C组Hpa的表达较同时间点A组及同组前一时间点明显升高,差异有统计学意义(P<0.05)(见表2,图2,图4)。而HSPG的表达则明显降低,差异有统计学意义(P<0.05)。C组中第14、21及28天时Hpa的表达较同时间点B组明显降低,差异有统计学意义(P<0.05);而HSPG的表达则明显升高,差异有统计学意义(P<0.05)(见表3,图3,图5)。

表2 各组Hpa免疫组化半定量结果(吸光度A值)
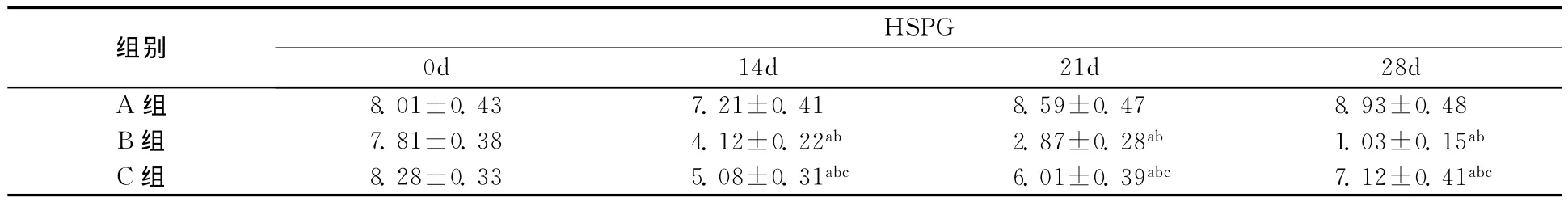
表3 各组HSPG免疫组化半定量结果(吸光度A值)
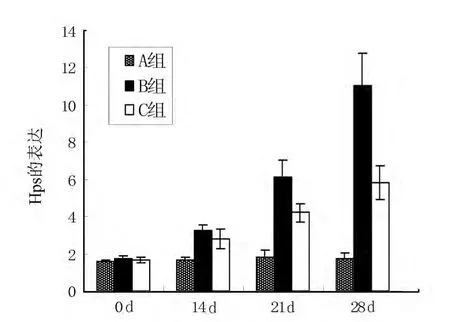
图2 各组Hpa的表达(吸光度A值)

图3 各组HSPG的表达(吸光度A值)
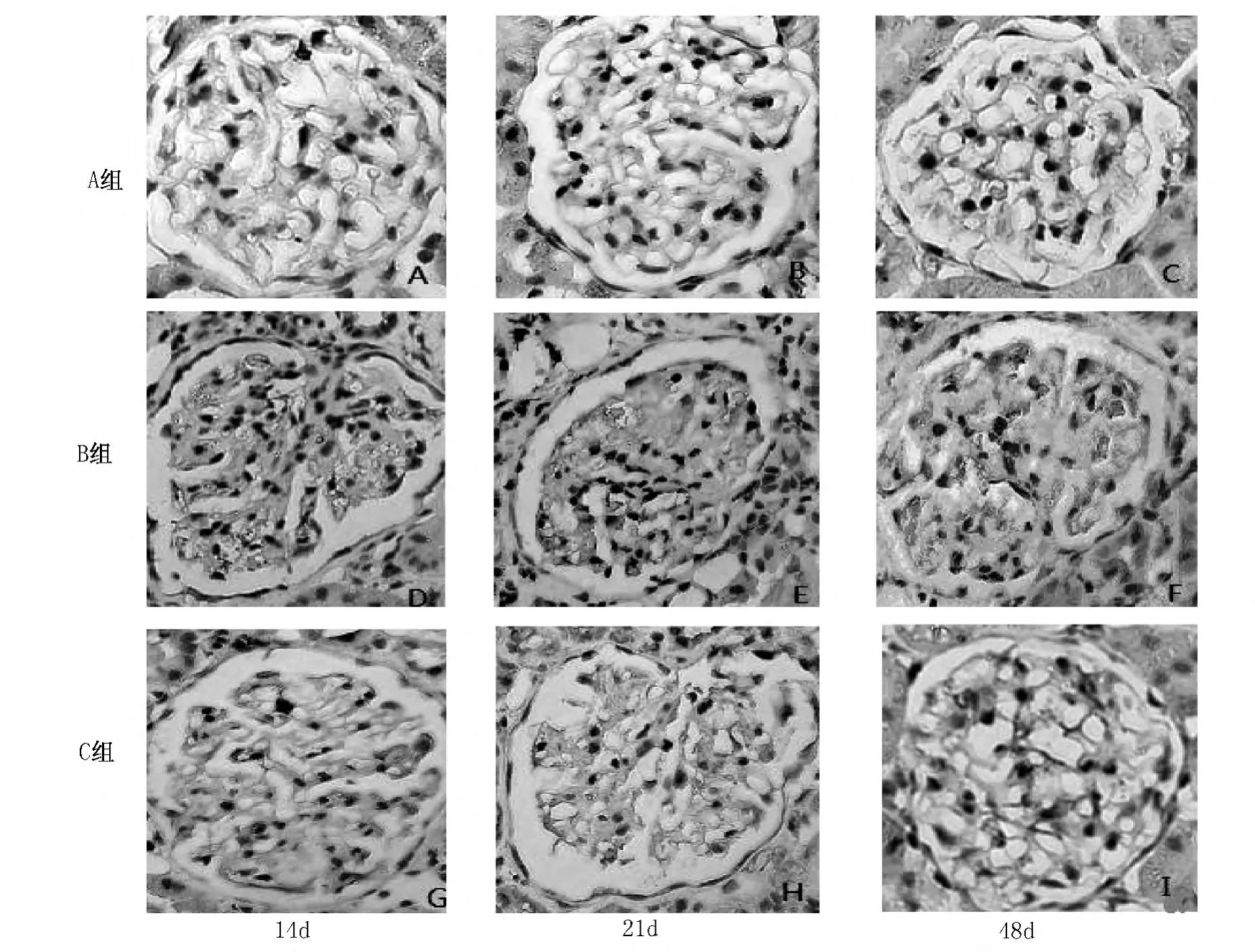
图4 各组不同时间点Hpa的表达(免疫组化,×400)
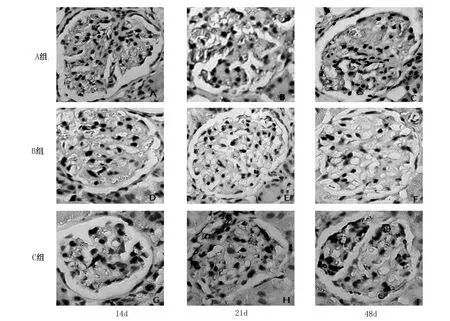
图5 各组不同时间点HSPG的表达(免疫组化,×400)
2.4 各组尿蛋白定量与Hpa的表达呈正相关
各组尿蛋白定量与Hpa的表达呈正相关(r=0.768,P<0.05),Hpa与HSPG的表达成负相关(r=-0.691,P<0.05)
见图6、图7。

图6 尿蛋白定量与Hpa的表达呈正相关
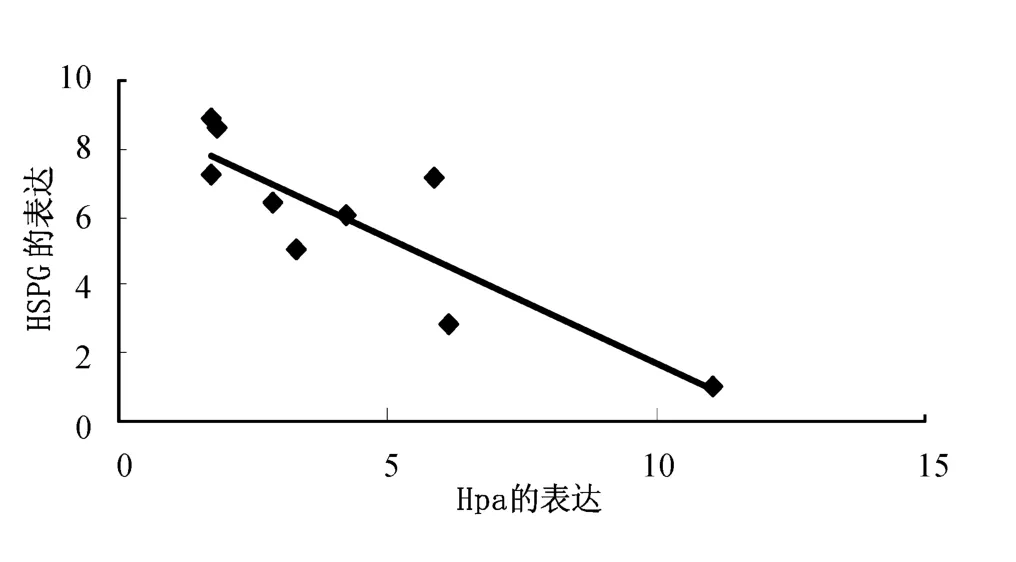
图7 Hpa与HSPG的表达成负相关
3 讨论
HSPG是一种位于细胞表面、细胞外基质及基底膜的大分子物质,主要由足细胞和壁层上皮细胞分泌,作为足细胞、内皮细胞和壁层上皮细胞的附着点,其主要作用是为肾小球滤过膜的电荷屏障提供负电荷[7-8]。Hpa于N-乙酰葡萄糖苷和D-葡萄糖醛酸结合部位切断HSPG的HS侧链,使其逐段分解,导致多种与HS结合的活性因子释放,如抗凝血酶Ⅲ、血小板源性生长因子、肝细胞生长因子等,参与多种生理与病理过程。
Triptolide主要用于各种自身免疫性疾病及肾炎的治疗,是雷公藤的主要有效成分之一[9-10],其具有保护足细胞、抗炎、免疫抑制、抗肿瘤等作用[11]。目前有关雷公藤对足细胞的保护作用研究较多,其可以通过多种机制对肾小球足细胞起保护作用。研究表明triptolide对被动型Heymann肾炎疗效显著,其对足细胞足突融合有抑制作用,促进nephrin和podocin等足细胞裂孔膜关键分子的表达,从而促进裂孔膜蛋白结构的修复和减轻足细胞病变[12],有效地减少蛋白尿。
阿霉素大鼠模型是经典的微小肾病动物模型,许多临床和动物实验研究发现Hpa表达异常可能与微小病变肾病蛋白尿的发生有关。KramerA等研究发现活性氧族(ROS)及肾素血管紧张素系统(RAS)调节阿霉素肾病(AN)大鼠肾小球Hpa的表达[13]。但鲜有对HSPG表达及雷公藤甲素对其的影响研究。本实验以5mg/kg阿霉素尾静脉注射造模,动态观察了各个时间点尿蛋白变化,并观察肾脏病理变化以及肾脏组织Hpa与HSPG表达的改变。注射7d后尿蛋白开始增多,24h尿蛋白定量在14d后进行性升高,并与Hpa表达呈正相关,与HSPG表达呈负相关。组织学检测光镜下肾小球系膜增生不明显,病变轻微。电镜下显示肾小球足细胞足突广泛融合,符合肾小球微小病变改变。而在雷公藤甲素治疗组中,24h尿蛋白定量及Hpa表达明显降低,而HSPG的表达升高。提示雷公藤甲素可能通过抑制Hpa而减少HSPG的降解,保护肾小球基底膜的电荷屏障,从而改善蛋白尿。
综上所述,Hpa表达增加及活性增强在肾小球疾病蛋白尿发生发展中具有重要病理作用。雷公藤可以通过抑制Hpa的表达而减少蛋白尿的发生,可能成为雷公藤治疗肾脏病新的靶点。
[1]Szymczak M,Kuzniar J,Klinger M.The role of heparanase in diseases of the glomeruli[J].Arch Immunol Ther Exp,2010,58(1):45-56.
[2]van den Hoven MJ,Rops AL,Vlodavsky I,et al.Heparanase in glomerular diseases[J].Kidney Int,2007,72(5):543-548.
[3]Nadir Y,Brenner B,Fux L,et a1.Heparanase enhances the generation of activated factor X in the presence of tissue factor and activated factor V II[J].Haematologica,2010,95(11):1927-1934.
[4]van den Hoven MJ,Waanders F,Rops AL,et a1.Regulation of glomerular heparanase expression by aldosterone,angiotensin II and reactive oxygen species[J].Nephrol Dial Transplant,2009,24(9):2637-2645.
[5]Nishida M,Hamaaoka K.Macriphage phenotype and renal fibrosis in obstructive nephropathy[J].Exphron Exp Nephrol,2008,110:31-36.
[6]仲崇辉,陈晓岚,苏宝凤,等.雷公藤甲素对TGF-β1刺激的系膜细胞增殖与凋亡的影响及机制探讨[J].中华肾脏病杂志,2012,28(11):894-899.
[7]Nasser NJ.Heparanase involvement in physiology and diseases[J].Cell Mol Life Sci,2008,65(11):1706-1715.
[8]Edovitsky E,Lerner I,Zcharia E,et al.Role of endothelial heparanase in delayed-type hypersensitivity[J].Blood,2006,107(9):3609-3616.
[9]陈潮红,洪亦眉,秦卫松,等.雷公藤甲素对血管紧张素Ⅱ诱导足细胞损伤的保护作用及其机制研究[J].肾脏病与透析肾移植杂志,2010,19(6):511-513.
[10]Zheng CX,Chen ZH,Zeng CH,et al.Typtolide protectes pedocytes from pummycin aminonucleeside induced injury in vivo and in viro[J].Kidney Int,2008,74(5):596-612.
[11]Chen BJ.triptolide,a novel immunusuppressive and antiinnammatory agent purified from a Chinese herb Tripterygium wilfordii Hook F[J].Leuk Lymphoma,2004,42:253-265.
[12]Chen ZH,Qin ws,Zeng CH,et al.triptolide redues proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro[J].Kidney Int,2010,11:974-988.
[13]Kramer A,van den Hoven M,Rops A,et al.Induction ofglomerular heparanase expression in rats with adriamycin nephropathy is regulated by reactive oxygen species and the renin-angiotensin system[J].J Am SocNephrol,2006,17(9):2513-2520.

