pORF5质粒蛋白拮抗LL37抗菌肽增强沙眼衣原体感染的初步研究
马康康 李忠玉 粟盛梅 曹文娟 戴文婷 杨晓玉 贺红梅 钟光明
pORF5质粒蛋白拮抗LL37抗菌肽增强沙眼衣原体感染的初步研究
马康康 李忠玉 粟盛梅 曹文娟 戴文婷 杨晓玉 贺红梅 钟光明
目的探讨pORF5质粒蛋白能否通过抑制LL37抗菌肽增强沙眼衣原体(Chlamydia trachomatis, Ct)感染,并初步探讨其分子机制。方法表达并纯化GST-pORF5融合蛋白,融合蛋白经蛋白酶酶切制备不含GST标签的pORF5蛋白;pORF5蛋白和LL37单独或共孵育衣原体后再感染HeLa细胞,间接免疫荧光技术计数衣原体包涵体形成数量;荧光定量PCR检测TNF-α、LL37基因表达水平。结果单独Ct感染组衣原体包涵体形成单位(IFU)为3.8×105/ml,LL37处理组IFU为2.0×105/ml,pORF5蛋白处理组IFU为3.0×105/ml, pORF5蛋白和LL37共处理组IFU为3.1×105/ml。pORF5蛋白处理组、LL37与pORF5蛋白共处理组和单独Ct感染组之间比较,差异无统计学意义(P>0.05),但明显高于LL37单独处理组(P<0.05)。pORF5蛋白和LL37共同处理组TNF-α表达水平明显高于LL37单独处理组(P<0.01);pORF5蛋白处理组较Ct处理组LL37基因转录水平下降了19%。结论pORF5质粒蛋白能拮抗LL37抗菌肽增强Ct感染,其机制可能与上调肿瘤坏死因子α、下调LL37表达相关。
沙眼衣原体;pORF5质粒蛋白;LL37;抗菌肽类
沙眼衣原体(Chlamydia trachomatis,Ct)是一种严格细胞内寄生的革兰阴性菌,共有19个血清型, A~C血清型可感染引起沙眼,L血清型可感染引起性病淋巴肉芽肿,D~K血清型可感染人体泌尿生殖系统,引起非淋菌性尿道炎、宫颈炎、不孕症等,对人类生殖健康造成极大危害[1]。Ct感染患者HIV阳性率[2]和宫颈癌[3]发生率也明显高于正常人群。由于Ct感染后症状不明显,极易被患者忽视而得不到及时有效的治疗导致严重的并发症。因此,阐明Ct的致病机制、研制有效疫苗对预防控制衣原体感染性疾病有重要意义[4]。Ct除含有约1 mb的基因外,各血清型中亦存在一个7.5 kb的隐蔽性质粒,有研究报道,衣原体质粒缺失菌株不能激活TLR2依赖的免疫反应,不引起上生殖道病变[5-6],提示质粒能编码毒力因子参与衣原体上行性感染和病理损伤过程。在质粒编码的8种质粒蛋白中, pORF5是唯一定位于包涵体外的分泌性蛋白[7]。LL37抗菌肽是目前发现的人类唯一的Cathelicidins家族成员,广泛分布于各种上皮细胞中,具有广谱的抗菌活性,能降低衣原体的感染率。本研究旨在探讨pORF5质粒蛋白能否通过拮抗LL17抗菌肽促进Ct感染,并初步分析其分子机制,为深入研究pORF5蛋白功能,阐明Ct致病机制提供依据。
材料与方法
一、材料
1.菌株与质粒:pGEX-6p/pORF5重组质粒、E.coliXL1-blue菌株、HeLa细胞均由本研究所保存。
2.主要试剂:预染蛋白 Marker为美国Fermentas公司产品,Glutathione Sepharose 4B购于美国Pharmacia公司,PreScission Protease、Cy2标记的羊抗兔IgG为美国GE Healthcare公司产品,血清及DMEM细胞培养基为美国Gibco公司产品, HiFi-MMLVcDNA第一链合成试剂为北京康为世纪生物科技有限公司产品,LL37由上海涛宇国际贸易有限公司合成。
二、方法
1.衣原体的感染:将HeLa细胞接种于24孔细胞培养板,18~24 h培养后长至单层,弃去细胞培养液,细胞经30 μg/ml DEAE-dextran处理10 min后加入衣原体感染液,37℃孵育2 h后弃去上清,加入含有2 μg/ml放线菌酮的完全培养基,37℃, 5%CO2继续培养40 h。
2.pORF5融合蛋白GST标签的切割与鉴定:将 pGEX-6p/pORF5原核表达重组质粒转化XL1-Blue大肠杆菌,IPTG诱导表达4 h,离心收集诱导后细菌,超声破菌后12 000×g离心收集上清。利用谷胱甘肽琼脂糖凝胶4B纯化GST-pORF5融合蛋白,融合蛋白加入蛋白酶,室温4 h或4℃过夜后离心,收集上清和磁珠洗脱液即为去除GST标签的pORF5蛋白。切割后的pORF5蛋白经SDS-PAGE凝胶电泳,以pORF5多抗为一抗,羊抗鼠IgG为二抗,进行Western印迹分析鉴定。同时将纯化后的pORF5蛋白与50 mg/ml的多粘菌素B 37℃孵育30 min以去除内毒素,BCA法测定pORF5蛋白浓度。
3.间接免疫荧光实验:Ct感染HeLa细胞40 h后,4%甲醛室温固定30 min,2%皂素透膜处理1 h, PBS洗涤细胞后加入1%BSA室温封闭1 h,然后再依次加入兔抗衣原体抗体,37℃孵育1 h;Cy2标记的羊抗兔抗体、Hoechst 33258,37℃1 h,最后PBS洗涤、封片,干燥,荧光显微镜观察结果并拍照保存。
4.pORF5和LL37对衣原体感染的影响:HeLa细胞接种于6孔细胞培养板,106个/孔,37℃,5% CO2的恒温培养箱中培养18~24 h。DEAE-dextran处理后将实验分为4组:第1组为20 μg/ml LL37和30 μg/ml pORF5蛋白37℃孵育30 min后,与衣原体继续孵育2 h后感染HeLa细胞;第2组为20 μg/ml LL37与衣原体孵育2 h后感染HeLa细胞;第3组为30 μg/ml pORF5与衣原体孵育2 h后感染HeLa细胞;第4组为单独Ct感染组。各处理组置于37℃,5%CO2的恒温培养箱中培养2 h,弃上清,加入含有2 μg/ml放线菌酮的完全培养基,继续培养40 h。细胞固定后进行间接免疫荧光染色,荧光显微镜计数各组包涵体形成数量。
5.实时荧光定量PCR:从基因库中查询LL37、肿瘤坏死因子(TNF)α基因DNA序列,设计特异性引物(表1)。引物由上海生工生物工程技术服务有限公司合成。采用Trizol法提取细胞总RNA,反转录采用HiFi-MMLVcDNA第一链合成试剂盒。实时荧光定量PCR扩增体系:cDNA 1 μl,qPCR混合物10 μl,正、反向引物各0.4 μl,灭菌蒸馏水补充至总体积20 μl。反应条件:94℃预变性10 min,94℃变性15 s, 60℃退火15 s,72℃延伸30 s,40个循环后,72℃继续延伸5 min。基因的表达量的计算采用△△Ct方法,即基因相对表达量=2-△△Ct,△△Ct=(Ct实验组目的基因-Ct实验组内参基因)-(Ct对照组目的基因-Ct对照组内参基因)

表1 荧光定量PCR引物序列
6.pORF5和LL37对衣原体感染HeLa细胞TNF-α表达的影响:按上述方法将实验分为4组, LL37与pORF5蛋白单独或共同孵育后处理衣原体,感染单层HeLa细胞,继续培养6 h后收集细胞,实时荧光定量PCR扩增TNF-α基因,采用2-△△Ct法进行数据的相对定量分析。ELISA测定各处理24 h后的细胞培养上清中TNF-α浓度,分析目的基因mRNA转录及表达水平的差异。
7.pORF5对衣原体感染HeLa细胞LL37表达的影响:HeLa细胞培养至单层后分成3组,加入经30 μg/ml pORF5蛋白室温预孵2 h的衣原体感染液;直接加入衣原体感染液;空白对照组。细胞经上述处理2 h后更换为含有放线菌酮的完全培养基, 6 h后消化收集细胞,实时荧光定量PCR检测LL37表达的变化,ELISA测定各处理24 h后的培养上清中LL37浓度。
三、统计学分析
结果
一、pORF5融合蛋白的纯化与GST标签的切割
重组质粒pGEX-6p/pORF5转化到XL1-Blue大肠杆菌,IPTG诱导表达可溶性pORF5融合蛋白,融合蛋白经谷胱甘肽琼脂糖凝胶4B纯化后,蛋白酶切割GST标签,收集上清和磁珠洗脱液即为酶切后pORF5蛋白。pORF5蛋白经SDS-PAGE分析,可见大小约28 000有清晰条带,与pORF5蛋白大小一致(图1a)。以酶切后pORF5蛋白为抗原,鼠抗pORF5多抗作为一抗,羊抗鼠IgG为二抗进行Western印迹分析,结果在28 000处出现清晰条带(图1b)。

图1 pORF5蛋白的纯化与鉴定 1a:酶切后pORF5蛋白的SDS-PAGE鉴定 1:标准参照物;2:未经酶切的GST-pORF5融合蛋白;3:酶切后上清;4:第1次洗脱液;5:第2次洗脱液;6:第3次洗脱液;7:酶切后GST-pORF5融合蛋白beads。1b:酶切后pORF5蛋白的Western印迹鉴定 1:XL1 Blue E.coli裂解产物;2:酶切后无GST标签的pORF5蛋白
二、pORF5蛋白拮抗LL37抗菌肽促进衣原体感染
用30 μg/ml pORF5蛋白和20 μg/ml LL37单独或共同与Ct孵育后感染HeLa细胞,间接免疫荧光法计数结果显示单独Ct感染组包涵体形成单位(IFU)为3.8×105/ml,LL37处理组IFU为2.0×105/ml, pORF5蛋白处理组IFU为3.0×105/ml,pORF5蛋白与LL37共同处理组IFU为3.1×105/ml(图2)。LL37处理组衣原体IFU明显减少,与单独Ct感染组相比较,IFU下降了47%,差异有统计学意义(P<0.05)。pORF5蛋白与LL37共同处理组IFU较LL37单独组IFU增加了55%,差异有统计学意义(P<0.05),但与pORF5蛋白单独处理组比,差异无统计学意义(P>0.05),见图3。
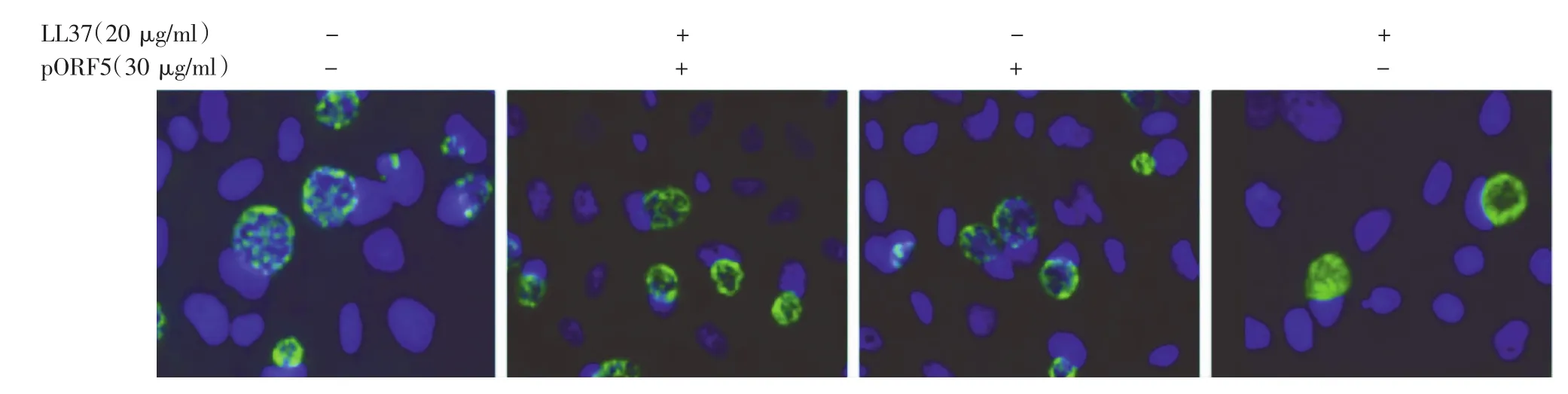
图2 间接免疫荧光法检测衣原体包涵体 HeLa细胞接种于6孔细胞培养板后培养18~24 h长至单层,分别用30 μg/ml pORF5蛋白和20 μg/ml LL37单独或共同与Ct孵育后感染HeLa细胞,40 h后细胞固定进行间接免疫荧光染色,显微镜下计数各处理组包涵体形成单位值,结果发现pORF5蛋白处理组、pORF5蛋白与LL37共处理组和空白对照组之间差异无统计学意义(P>0.05),但高于LL37单独处理组(P<0.05)。绿色为衣原体;蓝色为DNA
三、pORF5蛋白拮抗LL37增强TNF-α表达
分别提取不同处理组HeLa细胞总RNA,将逆转录后的cDNA作为模板进行实时荧光定量PCR扩增。以β肌动蛋白为内参照,对TNF-α基因的表达情况进行相对定量分析。结果发现,LL37处理组HeLa细胞TNF-α基因的表达水平显著低于单独Ct感染组与pORF5蛋白处理组(P<0.01),分别约减少了5.8倍和6.3倍,pORF5蛋白与LL37共处理组较LL37单独处理组TNF-α基因的表达水平增加了3.5倍。ELISA结果亦发现LL37处理组TNF-α表达水平明显低于pORF5单独或与LL37共处理组(P<0.01)。见表2。
表2 肿瘤坏死因子α mRNA和蛋白表达(±s)

表2 肿瘤坏死因子α mRNA和蛋白表达(±s)
注:n=3。a:与LL37处理组、pORF5蛋白与LL37共处理组比较,差异有统计学意义(P<0.05),与pORF5蛋白处理组比较,差异无统计学意义(P>0.05);b:与LL37处理组、pORF5蛋白与LL37共处理组比较,差异有统计学意义(P<0.05);c:与pORF5蛋白与LL37共处理组比较,差异有统计学意义(P<0.05)
组别 mRNA表达 蛋白表达(pg/ml)单独Ct感染组 1.51±0.14a 2 120.9±248.1a Ct+pORF5处理组 1.62±0.21b 1 999.8±208.9b Ct+LL37处理组 0.22±0.02c 678.4±75.2c Ct+pORF5+LL37处理组 1.00±0.09 1 388.6±156.1
四、pORF5蛋白下调Ct感染HeLa细胞LL37的表达

图3 不同处理组包涵体形成单位计数结果 a:与单独Ct感染组、pORF5蛋白单独处理组比较,差异无统计学意义(P>0.05),与LL37处理组差异有统计学意义(P<0.05);b:与单独Ct感染组比较,差异无统计学意义(P>0.05),与LL37处理组比较,差异有统计学意义(P<0.05);c:与单独Ct感染组、pORF5蛋白单独处理组、pORF5蛋白与LL37共处理组比较,差异有统计学意义(P<0.05)
以不同稀释度的对照样本建立标准曲线,结果标准曲线中Ct值和样本LL37浓度间呈现良好的线性关系,相关系数(R2)为0.99,基因扩增效率在85%以上。将实验组各样本10倍稀释后,分别用LL37和β肌动蛋白特异性引物扩增,计算出各样品LL37基因相对定量;同时收集24 h培养后上清, ELISA测定LL37表达水平,结果发现Ct处理组与pORF5蛋白处理组LL37基因的转录水平及蛋白表达水平较对空白照组均明显增加(P<0.01),pORF5蛋白处理组较Ct处理组LL37基因转录水平下降了19%。见表3。
表3 LL37基因mRNA和蛋白表达(±s)

表3 LL37基因mRNA和蛋白表达(±s)
注:n=3。a:与空白对照组、pORF5蛋白处理组比较,差异有统计学意义(P<0.05);b:与空白对照组比较,差异有统计学意义(P<0.05)
组别 mRNA表达 蛋白表达(pg/ml)空白对照组 0.06±0.01 4.5±1.5单独Ct感染组 1.12±0.15a 135.5±21.2a Ct+pORF5处理组 0.93±0.10b 95.3±15.8b
讨论
Ct进入生殖道后,首先是具有感染性的原体(EB)吸附于黏膜上皮细胞,在细胞内形成包涵体,进而转化为代谢活跃的网状体(RB),RB以二分裂形式繁殖,形成众多的子代RB,子代RB重新转化为EB并释放出细胞外再感染邻近细胞。为实现Ct在生殖道组织的上行性感染,EB必须存在某种机制拮抗生殖道黏膜局部固有免疫。作为生殖道黏膜固有免疫的重要组成部分,抗菌肽具有广谱抗微生物特性[8-9]。人类抗菌肽主要有防御素家族和Cathelicidin家族,LL37是Cathelicidin家族中唯一存在于人体的成员,广泛分布于各种上皮细胞中,是人体天然防御的重要组成部分,对G+和G-细菌均有很好的杀伤作用[10],能够降低衣原体的感染率[11]。Ct是如何抵抗生殖道LL37抗菌肽的抗菌作用至今仍不清楚。
Ct19个血清型中均存在7.5 kb的隐蔽性质粒,质粒不是衣原体生存的必须元件,但衣原体质粒缺失株毒力高度降低,不能上行引起生殖道病变[5-6],充分提示质粒能编码某种毒力因子并能拮抗抗菌肽的抗菌活性,促进Ct感染上行扩散。我们[12-13]前期研究已经证实pORF5蛋白体内外均能促进IL-1β、IL-8、TNF-α等多种炎症细胞因子的产生,提示pORF5蛋白可能参与了衣原体免疫病理损伤过程。本实验首先用抗菌肽LL37处理Ct后再感染HeLa细胞,发现Ct IFU明显降低,较单独Ct感染组降低了47%,证实LL37能够抑制Ct的感染。进一步将pORF5蛋白和LL37共同处理Ct后感染HeLa细胞,发现Ct IFU明显增多,较LL37单独处理组IFUs上升了55%,充分说明pORF5蛋白能拮抗LL37抗衣原体活性促进Ct感染。
实验过程中,我们发现Ct处理组、pORF5蛋白处理组的HeLa细胞TNF-α基因转录水平明显升高,但LL37处理组TNF-α基因转录水平明显降低,分别较Ct处理组与pORF5蛋白处理组约降低了5.8倍和6.3倍,当用pORF5蛋白预先与LL37孵育后再处理Ct,发现TNF-α基因转录水平恢复上升水平,较LL37单独处理组TNF-α基因表达水平增加了3.5倍。进一步测定TNF-α蛋白表达水平,结果亦显示,pORF5与LL37共处理组TNF-α表达水平明显高于LL37处理组,提示pORF5质粒蛋白能拮抗LL37增强TNF-α表达。作为一种重要的前炎症细胞因子,TNF-α能够激活炎症反应并能促进细胞凋亡,持续产生的TNF-α能够引发组织损伤[14],使宫颈部位出现充血、水肿等症状并伴有分泌增加等,有利于Ct感染的上行扩散,在衣原体持续性感染过程中具有重要作用。本研究结果显示,pORF5蛋白能拮抗LL37作用提高Ct感染HeLa细胞TNF-α的表达,TNF-α水平的升高一方面可诱导Ct感染细胞发生细胞凋亡,促进Ct在细胞的扩散;另一方面放大炎症反应,促进Ct持续性感染。
为初步探讨pORF5蛋白在Ct感染过程中的作用,本研究分别用Ct或pORF5蛋白预先与Ct孵育后再感染HeLa细胞,结果发现Ct能较高水平地诱导HeLa细胞中LL37基因转录,pORF5蛋白处理组HeLa细胞LL37基因转录水平高于对照组,但较Ct处理组LL37转录水平下降19%;同时pORF5蛋白处理组LL37蛋白表达水平明显降低Ct处理组。Bergman等[15]研究发现,淋球菌可通过降低LL37的表达抑制其抗淋球菌活性,从而为淋球菌提供有利的生殖道生存环境,提示pORF5蛋白亦可通过下调Ct感染细胞LL37表达水平,降低LL37对Ct感染的抑制作用,最终促进Ct在生殖道组织的生存与扩散。本研究初步证实pORF5蛋白可能通过上调TNF-α、下调LL37基因表达,降低LL37对Ct感染的抑制作用,为进一步阐明Ct持续性感染中免疫致病机制提供依据。然而pORF5蛋白拮抗LL37抗菌肽是直接通过与LL37结合封闭其活性区域,或者改变LL37表面电荷分布以达到抑制LL37的抗Ct作用等尚待进一步研究。
[1]Gallegos G,Ramos B,Santiso R,et al.Sperm DNA fragmentation in infertile men with genitourinary infection byChlamydia trachomatisand Mycoplasma[J].Fertil Steril,2008,90(2):328-334.
[2]Kilmarx PH,Mock PA,Levine WC.Effect ofChlamydia trachomatiscoinfection on HIV shedding in genital tract secretions[J].Sex Transm Dis,2001,28(6):347-348.
[3]da Silva Barros NK,Costa MC,Alves RR,et al.Association of HPV infection andChlamydia trachomatisseropositivity in cases of cervical neoplasia in Midwest Brazil[J].J Med Virol,2012,84(7):1143-1150.
[4]齐蔓莉,王敬,刘原君,等.白介素2基因佐剂对沙眼衣原体E型DNA疫苗的免疫增效作用[J].中华皮肤科杂志,2012,45 (5):322-324.
[5]Frazer LC,Darville T,Chandra-Kuntal K,et al.Plasmid-curedChlamydiacaviaeactivates TLR2-dependentsignaling and retains virulence in the guinea pig model of genital tract infection[J].PLoS One,2012,7(1):e30747.
[6]O′Connell CM,AbdelRahman YM,Green E,et al.Toll-like receptor 2 activation byChlamydia trachomatisis plasmid dependent,and plasmid-responsive chromosomal loci are coordinately regulated in response to glucose limitation by C. trachomatis but not byC.muridarum[J].Infect Immun,2011,79 (3):1044-1056.
[7]Li Z,Chen D,Zhong Y,et al.The chlamydial plasmid-encoded protein pgp3 is secreted into the cytosol ofChlamydia-infected cells[J].Infect Immun,2008,76(8):3415-3428.
[8]Hickey DK,Patel MV,Fahey JV,et al.Innate and adaptive immunity at mucosal surfaces of the female reproductive tract:stratification and integration of immune protection against the transmission of sexually transmitted infections[J].J Reprod Immunol,2011,88 (2):185-194.
[9]Sharma S,Sethi S,Prasad R,et al.Characterization of low molecular weight antimicrobial peptide from human female reproductive tract.Indian J Med Res,2011,134(5):679-687.
[10]Donati M,Di Leo K,Benincasa M,et al.Activity of cathelicidin peptides againstChlamydia spp[J].Antimicrob Agents Chemother,2005,49(3):1201-1202.
[11]Donati M,Di Francesco A,Gennaro R,et al.Sensitivity ofChlamydia suisto cathelicidin peptides[J].Vet Microbiol,2007,123(1-3): 269-273.
[12]邓红玉,李忠玉,吴移谋,等.沙眼衣原体pORF5质粒蛋白诱发小鼠生殖道免疫损伤初步研究[J].中华微生物学和免疫学杂志,2013,33(2):107-111.
[13]Zhou H,Huang Q,Li Z,et al.pORF5 plasmid protein ofChlamydia trachomatisinduces MAPK-mediated proinflammatory cytokines via TLR2 activation in THP-1 cells[J].Sci China Life Sci,2013,56(5):460-466.
[14]Murthy AK,Li W,Chaganty BK,et al.Tumor necrosis factor alpha production from CD8+T cells mediates oviduct pathological sequelae following primary genitalChlamydiamuridaruminfection[J].Infect Immun,2011,79(7):2928-2935.
[15]Bergman P,Johansson L,Asp V,et al.Neisseria gonorrhoeaedown regulates expression of the human antimicrobial peptide LL-37[J].Cell Microbiol,2005,7(7):1009-1017.
2014-01-07)
(本文编辑:吴晓初)
pORF5 plasmid protein promotesChlamydia trachomatisinfection through inhibition of the antibacterial peptide LL37:a preliminary study
Ma Kangkang,Li Zhongyu*,Su Shengmei,Cao Wenjuan,Dai Wenting,Yang Xiaoyu,He Hongmei,Zhong Guangming.*Institute of Pathogenic Biology,Medical College,University of South China,Hengyang 421001,Hunan,China
Li Zhongyu,Email:nhlzhy1023@126.com
ObjectiveTo investigate whether pORF5 plasmid protein promotesChlamydia trachomatis(Ct) infection through inhibition of the antibacterial peptide LL37,and to explore its potential molecular mechanism.MethodsAfter expression and purification,the glutathione S-transferase(GST)-pORF5 fusion protein was digested with proteases to obtain pORF5 protein without GST tag.Some Hela cells were classified into four groups:Ct group infected with unpretreated Ct,pORF5 group infected with Ct that had been pretreated with pORF5 of 30 μg/ml for 2 hours,LL37 group infected with Ct that had been pretreated with LL37 of 20 μg/ml for 2 hours,combination group infected with Ct that had been pretreated with pORF5 of 30 μg/ml and LL37 of 20 μg/ml for 2 hours.After additional culture,indirect immunofluorescence assay was performed to count the number of Ct inclusion-forming units(IFUs),and real-time,fluorescence-based quantitative PCR and enzyme-linked immunosorbent assay(ELISA) to detect the protein and mRNA expressions of tumor necrosis factor-α(TNF-α)respectively.Some Hela cells were divided into three groups:blank control group remaining untreated,Ct group infected with unpretreated Ct,pORF5 group infected with Ct that had been pretreated with pORF5 of 30 μg/ml for 2 hours.After 6 hours of additional culture,real-time,fluorescence-based quantitative PCR and ELISA were conducted to measure the mRNA and protein expressions of LL37,respectively.ResultsThe concentration of IFUs was significantly higher in the Ct group,pORF5 group and combination group than in the LL37 group(3.8×105/ml,3.0×105/ml and 3.1×105/ml vs.2.0×105/ml,allP<0.05),with no significant differences between the Ct group,pORF5 group and combination group(P>0.05).The expressions of TNF-α mRNA and protein were significantly increased in the combination group compared with the LL37 group.The mRNA expression of LL37 was reduced by 19%in the pORF5 group compared with the Ct group.ConclusionspORF5 plasmid protein could promote Ct infection by counteracting the antibacterial peptide LL37,which may be associated with the up-regulation of TNF-α expression and downregulation of LL37 expression in Ct-infected cells.
Chlamydia trachomatis;pORF5 plasmid protein;LL37;Antimicrobial peptides
10.3760/cma.j.issn.0412-4030.2014.10.005
国家自然科学基金(81102230、31470277);湖南省高校创新平台开放基金(13K081);湖南省普通高等学校重点实验室资助项目(湘教通[2012]312号);湖南省高层次卫生人才“225”工程培养项目(2013-13)
421001湖南衡阳,南华大学医学院病原生物学研究所[马康康(现在吉首大学医学院病原生物学教研室, 416000湖南吉首)、李忠玉、粟盛梅、曹文娟、戴文婷、杨晓玉、贺红梅];美国德州大学圣安东尼奥健康科学中心(钟光明)
李忠玉,Email:nhlzhy1023@126.com

