苯烯莫德对变应性接触性皮炎BALB/c小鼠模型的影响
钱佳丽 徐宏俊 赵琰 孙青苗 马晓蕾 黄海艳 张建中
苯烯莫德对变应性接触性皮炎BALB/c小鼠模型的影响
钱佳丽 徐宏俊 赵琰 孙青苗 马晓蕾 黄海艳 张建中
目的探讨苯烯莫德对小鼠变应性接触性皮炎模型的疗效。方法用2,4-二硝基氟苯对BALB/c小鼠进行皮肤致敏和激发,分别建立急性和慢性小鼠接触性皮炎模型。将实验小鼠分为7组,分别为正常对照组、无水乙醇组、苯烯莫德0.5%、1.0%、2.0%3个不同剂量组、0.1%地塞米松组和0.1%他克莫司组(n=6)。观察外用苯烯莫德的疗效,包括对小鼠耳廓肿胀程度(包括双耳质量差与厚度差的变化)、病理学改变及皮损组织炎症细胞计数的影响;用药结束时评价苯烯莫德的用药安全性。结果在急性接触性皮炎模型中,苯烯莫德在24 h内的治疗作用不明显;0.5%、1.0%、2.0%3个不同剂量组双耳质量差与基质对照组相比,差异均无统计学意义(均P>0.05);双耳厚度差与基质对照组相比,差异亦无统计学意义(P>0.05)。在慢性接触性皮炎模型中,苯烯莫德可明显缓解耳部肿胀程度,0.5%、1.0%、2.0%3个不同剂量组苯烯莫德外用3周后,双耳质量差[(2.33± 0.45)mg,(2.30± 0.57)mg,(2.38± 0.27)mg]与基质对照组[(3.73± 0.33)mg]相比显著降低,差异均有统计学意义(均P<0.01);双耳厚度差[(71.50±3.15)×10-3mm,(75.50±3.02)×10-3mm,(69.50±2.59)×10-3mm]与基质对照组[(91.83±2.04)×10-3mm]相比显著降低,差异均有统计学意义(均P<0.01)。无论是急性接触性皮炎模型还是慢性接触性皮炎模型,3个不同剂量苯烯莫德均能显著降低耳部皮损组织炎症细胞浸润(均P<0.01)。结论外用苯烯莫德对2,4-DNFB所致的小鼠慢性变应性接触性皮炎具有抑制作用,对急性模型效果不明显;未监测到局部药物不良反应。
苯烯莫德;皮炎,变应性接触性;模型,动物
苯烯莫德(benvitimod)为一种小分子化合物,化学名为5-(2-苯乙烯基)-2-异丙基-1,3-苯二酚。最早从一种土壤线虫(Heterorhabditis sp.)的共生细菌Photorhabdus iuminescence的代谢产物中分离出来,现已人工合成[1]。有临床前研究(资料未发表)发现,外用苯烯莫德对银屑病有一定的治疗作用,而对其他皮肤病有无治疗作用尚不清楚。本实验通过观察苯烯莫德对2,4-二硝基氟苯 (2,4-dinitrofluorobenzene,2,4-DNFB) 诱导的小鼠变应性接触性皮炎(allergic contact dermatitis,ACD)模型的影响,探讨苯烯莫德对变应性接触性皮炎的可能治疗作用及用药安全性,从而探讨苯烯莫德在湿疹皮炎类皮肤病中应用的可能性,并为临床应用提供实验依据。
材料与方法
一、实验动物及材料设备
SPF级BALB/c小鼠84只,雌性,6~8周龄,由北京维通利华有限公司生产(合格证号0236325)。苯烯莫德原料粉末产自天济药业(深圳)有限公司,地塞米松产自美国Sigma公司,他克莫司产自美国Sigma公司;2,4-二硝基氟苯(2,4-DNFB)由阿法埃莎(中国)化学有限公司生产,并由东京化成工业株式会社分装;电子数显卡尺(精度0.01 mm)由北京北量量具机电有限公司生产。
二、实验药物及细胞悬液的制备
1.致敏剂及激发溶液的制备:0.5%DNFB致敏液:250 mg DNFB加入丙酮与橄榄油混合液(4∶1)50 ml;0.2%DNFB激发液:250 mg DNFB加入丙酮与橄榄油混合液(4 ∶1)125 ml。
2.外用药物的配制:地塞米松以无水乙醇为基质配制成浓度为0.1%的工作液;他克莫司以无水乙醇为基质配制成浓度为0.1%的工作液;苯烯莫德以无水乙醇为基质配制成浓度为0.5%、1.0%、2.0%的工作液。
三、实验方法
1.实验动物分组:实验小鼠随机分为7组(n=6)。其中第1组小鼠不做任何处理(正常对照组),第2~7组小鼠分别为0.1%地塞米松治疗组、0.1%他克莫司治疗组、0.5%苯烯莫德治疗组、1.0%苯烯莫德治疗组、2.0%苯烯莫德治疗组、无水乙醇组。
2.变应性接触性皮炎模型的建立及给药方法:参考文献[2-5]的方法,将BALB/c小鼠于实验前1天(D0)在背部备皮,范围3.0 cm×3.0 cm;分别于第1天、第2天(D1、D2)在背部去毛部位均匀涂布0.5%DNFB溶液100 μl致敏;第6天(D6)在小鼠的左侧耳腹、耳背皮肤涂0.2%DNFB溶液25 μl激发皮炎。①建立经典(急性)ACD模型[3]:激发后24、36 h各给药1次,于D8(激发后48 h)处死小鼠,观察药物的短期疗效;②建立慢性ACD模型[4-5]:于第1次激发后,每隔3天再次激发左侧耳部,共激发6次。第7天(D7)开始每日用药2次,于首次用药后的第21天(D28)处死小鼠,观察药物的长期疗效。
四、观察指标
1.小鼠耳厚度及重量测定:①急性ACD模型:用药24 h后处死小鼠,用电子数显卡尺测量小鼠左、右耳固定部位的厚度,计算左、右两耳厚度差值;用直径为3.5 mm的皮肤圆形打孔器在小鼠的左、右耳中部相同位置打孔,用电子天平测量左、右耳重量,并计算双耳质量差值;②慢性ACD模型:分别于每1次激发后48 h用电子数显卡尺测定小鼠左、右耳固定部位的厚度,计算给药后第1、9、13、21天时左、右两耳厚度之差;于最后1次给药后24 h(D28)处死小鼠,立即用皮肤圆形打孔器分别在每组小鼠左、右耳中部打孔,用电子天平测量左、右耳重量差值。
2.组织病理学及皮损炎症细胞计数:对左耳皮肤分别进行HE染色,观察皮损组织病理改变,计算高倍镜(×400)下皮损炎症细胞数,每张切片连续选择10个无重叠高倍镜视野进行计数,相加得到10个高倍视野的炎症细胞总数。
五、统计学处理
结 果
一、苯烯莫德对ACD模型的临床观察
急性ACD组:药物治疗24 h后,苯烯莫德治疗组小鼠左耳的皮肤改变(如红斑、糜烂、渗出)与无水乙醇对照组相当,效果不及0.1%地塞米松组和0.1%他克莫司组;慢性ACD组:与无水乙醇对照组相比,外用0.5%、1.0%、2.0%苯烯莫德治疗3周可以抑制变应性接触性皮炎小鼠耳部皮肤的红斑、肿胀及毛细血管扩张充血,与0.1%地塞米松组和0.1%他克莫司组相比,临床改善情况基本相当。在上述3种药物治疗过程中,均未观察到皮损加重、皮肤萎缩、色素沉着、水疱、毛囊炎等不良反应。
二、苯烯莫德对小鼠ACD模型双耳质量差影响
急性ACD组:结果如表1所示,0.5%、1.0%、2.0%苯烯莫德3个不同剂量组,双耳的质量差与无水乙醇组相比,差异无统计学意义(均P>0.05);0.1%地塞米松组与无水乙醇组相比显著降低,差异有统计学意义(P<0.01);0.1%他克莫司组与无水乙醇组相比显著降低,差异有统计学意义(P<0.05)。慢性ACD组:结果如表1所示,0.5%、1.0%、2.0%3个不同剂量苯烯莫德外用3周后,双耳的质量差与无水乙醇组相比显著降低,差异有统计学意义(P<0.01)。而3个不同浓度苯烯莫德组双耳质量差显著高于0.1%地塞米松组,差异均有统计学意义(P<0.05),提示疗效逊于0.1%地塞米松;但与0.1%他克莫司组相比,差异无统计学意义(P>0.05)。
三、苯烯莫德对小鼠ACD模型双耳厚度差影响
表1 不同治疗药物对小鼠变应性接触性皮炎(ACD)模型双耳质量差的影响(mg,±s)
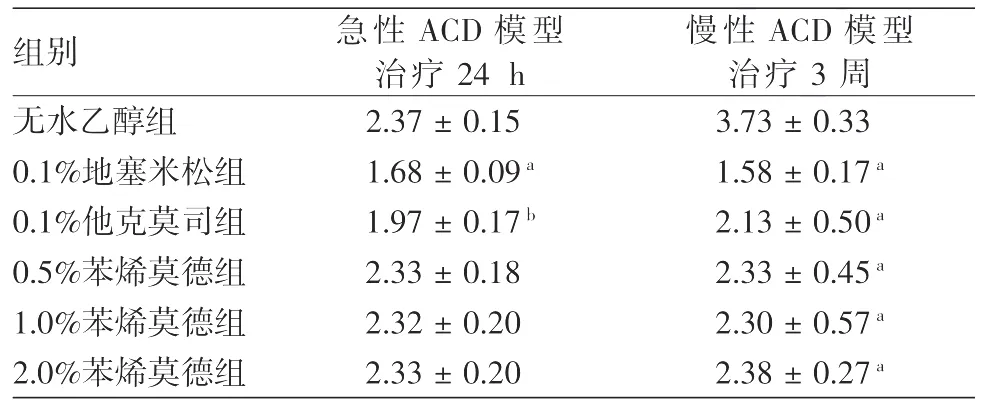
表1 不同治疗药物对小鼠变应性接触性皮炎(ACD)模型双耳质量差的影响(mg,±s)
注:n=6。与无水乙醇组相比,a:P<0.01,b:P<0.05
组别 急性ACD模型治疗24 h慢性ACD模型治疗3周无水乙醇组 2.37±0.15 3.73±0.33 0.1%地塞米松组 1.68±0.09a 1.58±0.17a 0.1%他克莫司组 1.97±0.17b 2.13±0.50a 0.5%苯烯莫德组 2.33±0.18 2.33±0.45a 1.0%苯烯莫德组 2.32±0.20 2.30±0.57a 2.0%苯烯莫德组 2.33±0.20 2.38±0.27a
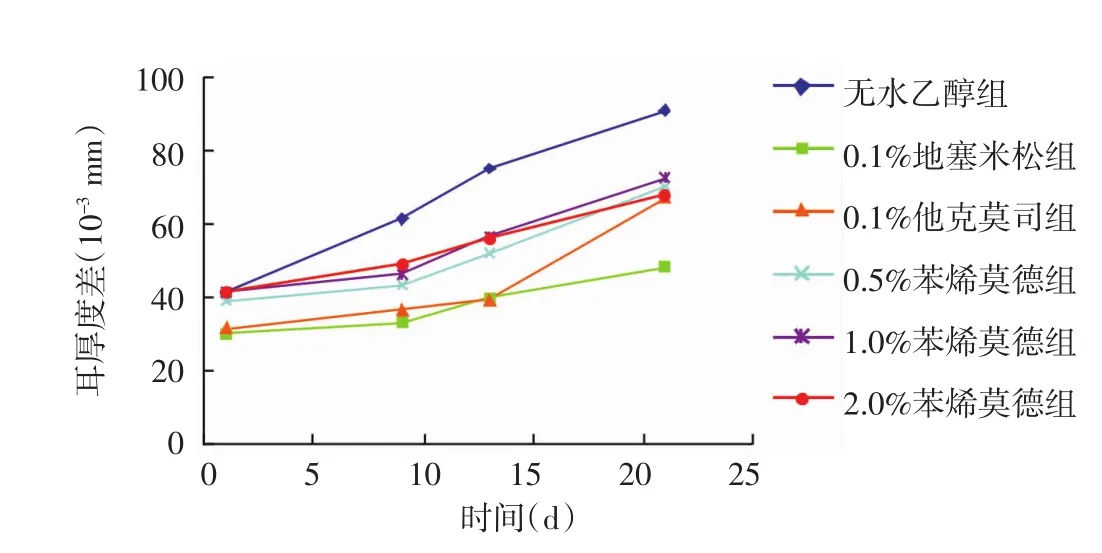
图1 不同药物治疗后小鼠双耳厚度差的变化
结果如图1所示,0.5%、1.0%、2.0%3个不同剂量组苯烯莫德外用治疗小鼠ACD,苯烯莫德的起效速度具有一定的时间依赖性特点。
用药24 h后:0.5%、1.0%、2.0%3个不同剂量苯烯莫德治疗组双耳厚度差分别为(38.17±1.72)×10-3mm、(40.17 ± 1.47)× 10-3mm、(40.67 ± 1.86)×10-3mm,与无水乙醇组(41.00±2.19)×10-3mm相比,差异无统计学意义(均P>0.05);0.1%地塞米松组(30.67±2.80)×10-3mm和0.1%他克莫司组(32.33±1.63)×10-3mm与无水乙醇组相比,差异有统计学意义(均P<0.01);用药9 d后:0.5%、1.0%、2.0%3个不同剂量苯烯莫德治疗组双耳厚度差分别为(45.67±1.86)×10-3mm、(48.00±2.45)×10-3mm、(52.33±3.39)×10-3mm,与无水乙醇组(61.67±1.63)×10-3mm相比,差异有统计学意义(均P<0.01)。用药3周结束时:0.5%、1.0%、2.0%3个不同剂量苯烯莫德治疗组双耳厚度差分别为(71.50±3.15)× 10-3mm、(75.50 ± 3.02) × 10-3mm、(69.50 ±2.59)×10-3mm,与无水乙醇组(91.83±2.04)×10-3mm相比显著降低,差异有统计学意义(均P<0.01)。
四、小鼠左耳皮肤组织病理学改变
HE染色(图2)显示,ACD模型组(DNFB+无水乙醇):表皮可见部分缺失,表皮细胞间、细胞内水肿;真皮明显水肿,真皮内大量炎症细胞浸润;胶原纤维间隙增宽;血管扩张,内皮细胞肿胀。不同浓度苯烯莫德治疗组:皮肤全层结构基本完整,表皮可见细胞内和细胞间水肿,与ACD模型组相比明显减轻,真皮内炎症细胞浸润明显减少,各层损害均较ACD模型组明显减轻。0.1%地塞米松组、0.1%他克莫司治疗组:表皮细胞内和细胞间水肿与ACD模型组相比明显减轻,真皮内炎症细胞浸润数目与苯烯莫德各浓度组相比降低,其他改变与苯烯莫德治疗组大致相同。
五、小鼠左耳皮肤组织病理炎症细胞计数
见表2。药物治疗24 h后,苯烯莫德0.5%、1.0%、2.0%3个不同浓度组小鼠左耳炎症细胞计数与无水乙醇组相比,差异有统计学意义(均P<0.01);药物治疗3周结束时:苯烯莫德0.5%、1.0%、2.0%3个不同浓度组的小鼠左耳炎症细胞计数与无水乙醇组相比,差异有统计学意义(均P<0.01),但与0.1%地塞米松和0.1%他克莫司相比,炎症细胞浸润更明显,差异有统计学意义(均P<0.01)。

图2 小鼠左耳皮肤组织病理学改变(HE×100) 2a:基质对照组:表皮部分缺失,表皮细胞间、细胞内水肿;真皮明显水肿,真皮内大量炎症细胞浸润;胶原纤维间隙增宽;血管扩张,内皮细胞肿胀;2b:2.0%苯烯莫德治疗组:表皮轻度细胞内和细胞间水肿,真皮轻度水肿伴炎性细胞浸润,与变应性接触性皮炎(ACD)模型组相比明显减轻;2c:0.1%地塞米松治疗组:表皮未见明显增厚,表皮内轻度海绵水肿,与ACD模型组相比明显减轻,真皮未见水肿,少量炎症细胞浸润;2d:0.1%他克莫司治疗组:表皮无明显增厚,表皮内轻度海绵水肿,与ACD模型组相比明显减轻,真皮未见水肿,有少量炎症细胞浸润
表2 不同治疗药物对小鼠变应性接触性皮炎(ACD)模型皮损组织病理炎症细胞计数的影响(±s)
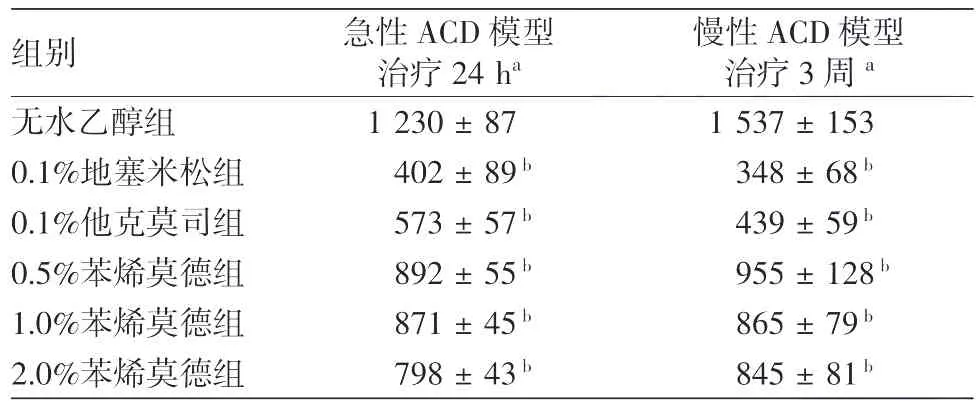
表2 不同治疗药物对小鼠变应性接触性皮炎(ACD)模型皮损组织病理炎症细胞计数的影响(±s)
注:n=6。a:10个(×400)视野下的细胞总数;b:与无水乙醇组相比,P<0.01
组别 急性ACD模型治疗24 ha慢性ACD模型治疗3周a无水乙醇组 1 230±87 1 537±153 0.1%地塞米松组 402±89b 348±68b 0.1%他克莫司组 573±57b 439±59b 0.5%苯烯莫德组 892±55b 955±128b 1.0%苯烯莫德组 871±45b 865±79b 2.0%苯烯莫德组 798±43b 845±81b
讨 论
ACD是皮肤或黏膜单次或多次接触外源性物质后,经12~48 h在接触部位甚至接触以外的部位发生的炎症性疾病。发病机制属于接触性超敏反应(contact hypersensitivity,CHS)。 CHS是针对半抗原发生的T细胞介导的皮肤免疫反应,一般认为CHS属于迟发型超敏反应(delayed type hypersensitivity,DTH)的一种[6]。DNFB 诱导下的小鼠ACD模型是研究变应性接触性皮炎的经典模型[7],已有数十年的历史。该皮炎模型以耳廓作为研究的靶位,研究者根据炎症后耳廓的厚度及单位面积的炎症细胞数来判断抗皮炎药物的疗效。
我们在预实验中发现,外用苯烯莫德对经典ACD小鼠模型(24 h)的治疗作用不明显,至少提示苯烯莫德起效不快。因此我们在急性模型的基础上,尝试延长接触性皮炎的持续时间,模仿慢性ACD,从而观察药物长期外用的疗效。结果显示,在用药后的第1天,即药物治疗24 h后,苯烯莫德各剂量组小鼠双耳厚度差与无水乙醇组相比,差异均无统计学意义;而0.1%地塞米松组、0.1%他克莫司组的双耳厚度差分别与无水乙醇组相比显著降低,说明0.1%地塞米松和0.1%他克莫司短期(24 h)外用即可明显抑制小鼠耳部的炎症反应。用药1周时,苯烯莫德各剂量组耳肿胀程度与无水乙醇组相比显著降低,药物作用开始出现,一直持续至3周治疗结束时。治疗结束时,苯烯莫德各剂量组小鼠双耳重量差、厚度差及皮损组织病理炎症细胞计数与无水乙醇组相比均显著降低。可见苯烯莫德的起效时间与0.1%地塞米松和0.1%他克莫司相比较晚,短期(24 h)疗效不佳;0.1%地塞米松起效最迅速,用药24 h后(每天2次)即可明显改善小鼠耳肿胀程度;0.1%他克莫司在改善耳部皮肤肿胀程度和炎症细胞浸润方面,与0.1%地塞米松疗效相当。苯烯莫德在大约1周左右才开始起效,且疗效一直持续至3周后治疗结束时。由此,我们推测苯烯莫德可能是通过与上述两种药物不同的药理学机制而起作用。在为期3周的用药过程中,3种不同浓度的苯烯莫德治疗组均未发现皮损加重、皮肤萎缩、色素沉着、水疱、毛囊炎等药物不良反应发生,证明苯烯莫德局部应用具有一定的安全性。
[1]Gao JG,Zhang Y,Zheng HT,et al.Synthesis of novel drug Benvitimod[J].Adv Mat Res,2011(236-238):2378-2382.
[2]Bhol KC,Schechter PJ.Topical nanocrystalline silver cream suppressesinflammatorycytokinesand inducesapoptosisof inflammatory cells in a murine model of allergic contact dermatitis[J].Br J Dermatol,2005,152(6):1235-1242.
[3]周倩,寇庚,钱卫珠,等.CTLA4-Ig对变应性接触性皮炎小鼠模型的治疗作用[J].中华皮肤科杂志,2002,35(4):256-259.
[4]van Triel JJ,Arts JH,Muijser H,et al.Allergic inflammation in the upper respiratory tract of the rat upon repeated inhalation exposure to the contact allergen dinitrochlorobenzene(DNCB)[J].Toxicol,2010,269(1):73-80.
[5]Kim TH,Jung JA,Kim GD,et al.The histone deacetylase inhibitor,trichostatin A,inhibits the developmentof2,4-dinitrofluoro-benzene induced dermatitis in NC/Nga mice[J].Int Immunopharmacol,2010,10(10):1310-1315.
[6]RossR,Reske-KunzAB.TheroleofNO in contact hypersensitivity[J].Int Immunopharmacol,2001,1(8):1469-1478.
[7]Honda T,Egawa G,Grabbe S,Kabashima K.Update of immune events in the murine contact hypersensitivity model:toward the understanding of allergic contact dermatitis[J].J Inves Dermatol,2013,133(2):303-315.
2013-12-04)
(本文编辑:尚淑贤)
Effect of benvitimod on allergic contact dermatitis in BALB/c mice
Qian Jiali,Xu Hongjun,Zhao Yan,Sun Qingmiao,Ma Xiaolei,Huang Haiyan,Zhang Jianzhong*.*Department of Dermatology,Peking University People's Hospital,Beijing 100044,China
Zhang Jianzhong,Email:rmzjz@126.com
ObjectiveTo evaluate the efficacy of benvitimod on allergic contact dermatitis(ACD)in a mouse model of allergic contact dermatitis.MethodsAcute and chronic ACD models were established respectively in 42 BALB/c mice through 2,4-dinitrofluorobenzene(DNFB)sensitization and challenge.Then,the BALB/c mice were equally divided into 7 groups with 6 mice in every group:normal control group receiving no treatment,five treatment groups topically treated with 0.1%dexamethasone solution,0.1%tacrolimus(FK506)solution,0.5%benvitimod solution,1.0%benvitimod solution and 2.0%benvitimod solution respectively,and dehydrated alcohol group treated with dehydrated alcohol only.All the drug solutions were topically applied at 24 and 36 hours after the last challenge in the murine models of acute ACD which were sacrificed at 48 hours,and twice daily from day 7 to 21 after the initial sensitization in the murine models of chronic ACD which were sacrificed on day 21 after the first topical treatment.Ear tissues were obtained from these mice and subjected to measurement of ear thickness and weight,as well as pathological examination and evaluation of inflammatory infiltrate by hematoxylin-eosin(HE)staining.The safety of these drugs was also estimated at the end of treatment.ResultsIn the murine models of acute ACD,benvitimod showed no obvious therapeutic effect at 24 hours,with no significant differences in bilateral difference in ear thickness or weight between the three benvitimod groups and dehydrated alcohol group(allP>0.05).Meanwhile,in the murine models of chronic ACD,benvitimod markedly decreased the swelling degree of ears,with significant differences between the three benvitimod groups(0.5%,1.0%and 2.0%)and dehydrated alcohol group in bilateral difference in ear thickness((71.50±3.15)×10-3mm,(75.50±3.02)×10-3mm and(69.50±2.59)×10-3mm vs.(91.83±2.04)×10-3mm,allP<0.01)and weight((2.33±0.45)mg,(2.30±0.57)mg and(2.38±0.27)mg vs.(3.73±0.33)mg,allP<0.01)after 3 weeks of treatment.The inflammatory infiltration in ear tissue was significantly attenuated in murine models of both acute and chronic ACD by the three concentrations of benvitimod compared with dehydrated alcohol(allP<0.01).Conclusions Topical benvitimod can inhibit chronic ACD in mice induced by 2,4-DNFB,but exhibits no obvious effect on acute ACD.No apparent local adverse effects were observed during the treatment with benvitimod in these mice.
Benvitimod;Dermatitis,allergic contact;Disease models,animal
10.3760/cma.j.issn.0412-4030.2014.09.012
100044北京大学人民医院皮肤科[钱佳丽(现在北京中医医院顺义医院皮肤科,101300)、赵琰、孙青苗、马晓蕾、黄海艳、张建中];民航总医院皮肤科(徐宏俊)
张建中,Email:rmzjz@126.com

