夫西地酸乳膏对小鼠急性皮肤屏障损伤引起炎症反应的抑制作用
仲少敏 郭建美 陶荣 孙楠 吴艳
夫西地酸乳膏对小鼠急性皮肤屏障损伤引起炎症反应的抑制作用
仲少敏 郭建美 陶荣 孙楠 吴艳
目的探讨夫西地酸乳膏外用对屏障受损的皮肤炎症反应的作用。方法雄性SKH-1无毛小鼠8只,在每只小鼠背部标记6个1 cm×2 cm的实验区,分为6组:分别为空白对照组、屏障破坏组、屏障破坏+夫西地酸组、屏障破坏+基质组、屏障完整+夫西地酸组、屏障完整+基质组。采用胶带撕脱法去除角质层表皮脂质,建立急性屏障功能损伤的动物模型。局部外用夫西地酸乳膏或基质,12 h后对受试部位进行菌落采集鉴定,并取皮肤标本采用实时荧光定量PCR检测皮肤中髓样分化因子88(MyD88)和白细胞介素(IL)-1α、IL-6以及表皮抗菌肽S100a8和S100a9的表达。结果屏障破坏组MyD88 mRNA表达(8.3±3.0)为空白对照组(0.8±0.4)的8倍,其IL-1α、IL-6及S100a8和S100a9 mRNA表达均高于空白对照组。屏障破坏+夫西地酸组与屏障破坏组比较,IL-1α mRNA水平显著下降(2.8±0.3比20.1±10.0,F=47.11,P<0.01),IL-6水平显著下调(1.6±2.3比9.4±4.0,F=16.18,P<0.01),S100a8 mRNA水平显著下降(1.5±1.4比5.0±1.6,F=59.71,P<0.05),S100a9 mRNA亦显著下降(1.2±0.7比3.4±1.6,F=21.94,P<0.05)。结论夫西地酸乳膏外用对于屏障损伤后的炎症反应有明显的抑制作用,可能为其治疗炎症性皮肤病的作用机制之一。
梭链孢酸;皮肤屏障;髓样分化因子88;白细胞介素类
夫西地酸是皮肤科最常用的外用抗生素之一,广泛用于革兰阳性球菌的皮肤感染,并在痤疮治疗中占有重要的地位[1]。夫西地酸治疗痤疮切实有效,但是否与其抗菌作用有关仍然不确定[2-3]。夫西地酸具有抑菌杀菌和抗炎免疫调节的双重作用,系统用药可通过增强免疫功能消除细菌所致的组织水肿、渗出、变性、坏死等炎症反应[4-5]。髓样分化因子(MyD88)是泛在的胞内配体蛋白,为白细胞介素(IL)-1受体/Toll样受体(TLR)所介导的前炎症信号通路中的关键衔接分子,在微生物入侵、有害刺激时,激活核因子κB(NF-κB)和其他通路,诱导很多快速反应基因的转录活化,产生多种效应分子,如前炎症细胞因子、趋化因子、抗菌肽等,在天然免疫和炎症性皮肤病的发生发展中具有重要作用[6-7]。本研究在屏障破坏的皮肤模型上诱导急性皮肤炎症反应[8-9],在此基础上外用夫西地酸,观察其是否具有抗炎活性。
材料和方法
一、实验动物及药物
雄性SKH-1无毛小鼠8只,生产自上海市公共卫生临床中心实验动物部(动物检疫合格证号:3100054868),6~8周龄,质量30 g左右。饲养于清洁级动物饲养室内。饲养环境温度(24±2)℃,相对湿度(50±10)%,人工照明制造昼夜(昼/夜:12 h/12 h)。以Purina Chow为饲料,自由喂养。购入后适应环境10~15 d后开始试验。测试环境温度(24±2)℃,相对湿度45%~55%。2%夫西地酸乳膏及乳膏基质由香港澳美制药厂提供。基质配方为凡士林、液体石蜡、西土马哥及甘油等。
二、屏障损伤模型建立
在每只小鼠背部标记6个1 cm×2 cm的实验区,分为6组:分别为空白对照组、屏障完整+夫西地酸组、屏障完整+基质组、屏障破坏组、屏障破坏+夫西地酸组、屏障破坏+基质组。使用经皮水分丢失测试仪Vapometer(Delfin Technologies Ltd,芬兰)测量小鼠皮肤的基础经表皮失水(TEWL)值,屏障破坏区域应用 scotch®胶带(3M,美国)以相同压力和速度反复粘脱约20次,测量处理局部的TEWL值,使其与基线相比上升超过5倍[9]视为屏障破坏;肉眼可见局部轻微潮红,少许渗出。随后局部外用药物或基质1次,12 h后局部菌落鉴定计数并处死小鼠,剪取各实验区全层皮肤组织进行实验。
三、菌落鉴定和计数
用拭子均匀擦拭皮肤表面,用5 ml灭菌注射用水定量。取25 μl接种至血培养皿,使用接种环均匀涂抹于血平板上,37℃恒温培养箱培养24 h,进行菌落鉴定计数。
四、实时荧光定量PCR
所采集的皮肤标本使用液氮研磨,Omega试剂盒法提取RNA,进行cDNA合成,SYBR GREEN MIX(北京全式金生物技术有限公司)进行实时荧光定量PCR,采用PRIMER3软件进行引物设计。引物序列见表1所示。mRNA表达水平用管家基因GAPDH进行校正计算相对表达量,即处理组的目的基因相对于空白对照组的表达倍数(2-ΔΔCt),所有实验至少重复3次。
五、统计学分析
应用SPSS16.0统计分析软件进行分析。采用重复测量方差分析对6个处理组MyD88和IL-1α、IL-6以及表皮抗菌肽S100a8和S100a9的表达进行统计分析,组间比较采用Post Hoc检验中最小显著差数法(LSD法)。P<0.05认为差异有统计学意义。
结 果
一、急性屏障破坏12 h的小鼠模型菌落鉴定

表1 实时荧光定量PCR所用引物序列
表2 不同处理组无毛小鼠皮肤中各炎症因子mRNA的表达情况(2-ΔΔCt,±s)
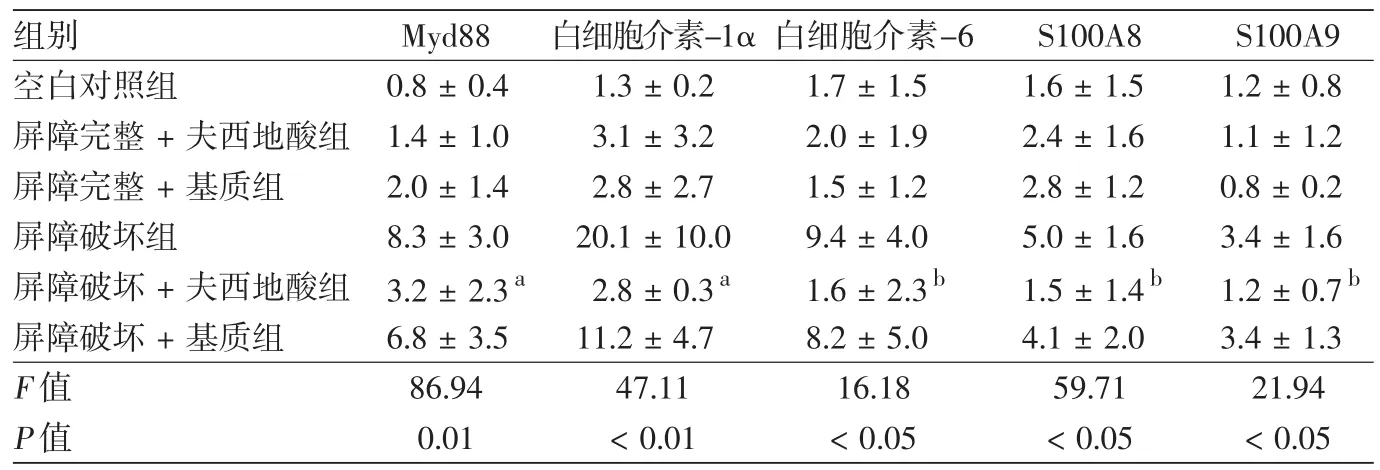
表2 不同处理组无毛小鼠皮肤中各炎症因子mRNA的表达情况(2-ΔΔCt,±s)
注:Myd88:髓样分化因子88;S100a8:表皮抗菌肽S100a8;S100a9:表皮抗菌肽S100a9。n=8。与屏障破坏组相比较,a:P<0.01;b:P<0.05
组别 Myd88 白细胞介素-1α白细胞介素-6 S100A8 S100A9空白对照组 0.8±0.4 1.3±0.2 1.7±1.5 1.6±1.5 1.2±0.8屏障完整+夫西地酸组 1.4±1.0 3.1±3.2 2.0±1.9 2.4±1.6 1.1±1.2屏障完整+基质组 2.0±1.4 2.8±2.7 1.5±1.2 2.8±1.2 0.8±0.2屏障破坏组 8.3±3.0 20.1±10.0 9.4±4.0 5.0±1.6 3.4±1.6屏障破坏+夫西地酸组 3.2±2.3a 2.8±0.3a 1.6±2.3b 1.5±1.4b 1.2±0.7b屏障破坏+基质组 6.8±3.5 11.2±4.7 8.2±5.0 4.1±2.0 3.4±1.3 F值 86.94 47.11 16.18 59.71 21.94 P值 0.01 <0.01 <0.05 <0.05 <0.05
在皮肤屏障功能破坏12 h后,在局部进行菌落采集,培养鉴定发现没有明显的菌落,仅有极少量杂菌生长,为金黄色葡萄球菌和表皮葡萄球菌,各组间无差别,无临床感染的证据。
二、夫西地酸抑制皮肤屏障破坏引起的MyD88表达上调
皮肤屏障破坏组MyD88 mRNA表达显著升高,为空白对照组的8倍(P<0.01),屏障破坏+夫西地酸组明显低于屏障破坏组(P<0.01),屏障破坏+基质组与屏障破坏组比较未见明显下降(表2)。屏障完整+夫西地酸组与屏障完整+基质组无明显变化。
三、夫西地酸抑制屏障破坏引起的炎症因子IL-1α、IL-6的合成
屏障破坏组IL-1α、IL-6 mRNA表达显著升高,相对表达量分别为空白对照组的20倍(P<0.01)及9倍(P<0.01),屏障破坏 +夫西地酸组明显低于屏障破坏组(P<0.001),屏障破坏+基质组与屏障破坏组比较未见明显下降(表2)。屏障完整+夫西地酸组与屏障完整+基质组无明显变化。
四、夫西地酸减少屏障破坏引起的表皮抗菌肽S100a8、S100a9的合成
皮肤屏障破坏组表皮抗菌肽S100a8、S100a9 mRNA表达较空白对照组明显升高,屏障破坏+夫西地酸组明显低于屏障破坏组(P<0.05)(表2)。屏障完整+夫西地酸组与屏障完整+基质组无明显变化。
讨 论
在皮肤科夫西地酸外用非常广泛,因为其温和没有刺激,渗透性好,非常适合痤疮等屏障功能受损不能耐受刺激性药物的炎症性皮肤病[10]。关于夫西地酸对皮肤在抗菌作用之外是否具有直接的抗炎作用,目前还没有直接的证据,因此我们在皮肤屏障损伤模型上观察其外用对炎症因子的影响。
IL-1是最强效的前炎症因子之一,在角质形成细胞中构成性表达,在皮肤损伤、紫外线照射、过敏反应和感染时快速释放,并与IL-1受体I(IL-1RI)结合,通过募集衔接蛋白MyD88,启动下游的级联放大反应,激活NF-κB和其他信号通路(包括JNK和MAPK),导致更多的IL-1和其他炎症介质产生,在皮肤的炎症反应和免疫反应中起非常重要的作用[11]。如果炎症反应过度或者不能达到平衡就会造成组织破坏,这也是包括痤疮在内的多种感染性、炎症性和自身免疫性皮肤病的发病机制之一[12-13]。本研究发现,急性屏障功能破坏可以引起MyD通路激活,其下游的炎症因子IL-1α、IL-6合成增加,这一反应曾在紫外线损伤和其他的皮肤炎症状态中被反复观察到,为急性屏障功能破坏的特征性表现[14],说明胶带撕脱法成功破坏屏障,并导致炎症通路的激活,推测MyD88通路可能是其作用的靶点。外用夫西地酸乳膏对炎症因子IL-1α、IL-6的释放有显著的抑制作用,说明夫西地酸有直接的抗炎症作用,在炎症损伤过度时可以为组织提供保护。
本研究还发现,夫西地酸乳膏可以降低表皮抗菌肽S100A8和S100A9的表达。在特应性皮炎、银屑病等炎症性皮肤病中都有S100A8高表达,与疾病严重程度相关。另一方面,细胞外S100A8蛋白还可与Toll样受体4(TLR4)结合,通过MyD88通路激活刺激炎症细胞释放炎症蛋白和炎症介质,直接参与炎症疾病过程并介导细胞内炎症信号通路和生物学过程[15]。夫西地酸对S100A8和S100A9的抑制作用可能为其抗炎机制之一。
我们另设基质对照,除外了基质效应,并对屏障破坏的皮肤表面进行菌落采集鉴定,各组都没有明显细菌感染的证据,说明炎症反应并非细菌感染所致,对炎症因子的抑制作用也并非夫西地酸的抗菌作用。夫西地酸对屏障破坏的皮肤具有直接的抗炎作用,这为临床指导治疗和进一步明确其作用机制提供了直接证据。
声明本课题获2013年中西医结合学会“CAIM-澳美中国痤疮研究基金”资助
[1]Schöfer H,Simonsen L.Fusidic acid in dermatology:an updated review[J].Eur J Dermatol,2010,20(1):6-15.
[2]Khorvash F,Abdi F,Kashani HH.Staphylococcus aureusin acne pathogenesis:a case-control study[J].N Am J Med Sci,2012,4(11):573-576.
[3]Sommer S,Bojar R,Cunliffe WJ.Investigation of the mechanism of action of 2%fusidic acid lotion in the treatment of acne vulgaris[J].Clin Exp Dermatol,1997,22(5):211-215.
[4]BendtzenK,DiamantM,FaberV.Fusidicacid,animmunosuppressive drug with functions similar to cyclosporin A[J].Cytokine,1990,2(6):423-429.
[5]Burkart V,Bellmann K,Hartmann B.Fusidic acid suppresses nitric oxide toxicity in pancreatic islet cells[J].Biochem Pharmacol,1994,48(7):1379-1385.
[6]Chen H,Jiang Z.The essential adaptors of innate immune signaling[J].Protein Cell,2013,4(1):27-39.
[7]Lai Y,Gallo RL.Toll-like receptors in skin infections and inflammatory diseases[J].Infect Disord Drug Targets,2008,8(3):144-155.
[8]Elias PM,Feingold KR.Skin barrier[M].New York:Taylor&Francis,2006:305-313.
[9]Gao Y,Wang X,Chen S,et al.Acute skin barrier disruption with repeated tape stripping:anin vivomodel for damage skin barrier[J].Skin Res Technol,2013,19(2):162-168.
[10]Zhao M,Gödecke T,Gunn J,et al.Protostane and fusidane triterpenes:a mini-review[J].Molecules,2013,18(4):4054-4080.
[11]Contassot E,Beer HD,French LE.Interleukin-1,inflammasomes,autoinflammation and the skin[J/OL].Swiss Med Wkly,2012,142:w13590[2012-12-28].http://www.smw.ch/index.php?id=smw-2012-13590.
[12]Henderson C,Goldbach-Mansky R.Monogenic IL-1 mediated autoinflammatory and immunodeficiency syndromes:finding the right balance in response to danger signals[J].Clin Immunol,2010,135(2):210-222.
[13]Selway JL,Kurczab T,Kealey T,et al.Toll-like receptor 2 activation and comedogenesis:implications for the pathogenesis of acne[J].BMC Dermatol,2013,13:10.
[14]Lee Y,Kim H,Kim S,et al.Myeloid differentiation factor 88 regulates basal and UV-induced expressions of IL-6 and MMP-1 in human epidermal keratinocytes[J].J Invest Dermatol,2009,129(2):460-467.
[15]Kerkhoff C,Voss A,Scholzen TE,et al.Novel insights into the role of S100A8/A9 in skin biology[J].Exp Dermatol,2012,21(11):822-826.
2014-03-09)
(本文编辑:尚淑贤)
Inhibitory effect of fusidic acid cream on inflammatory reaction caused by acute skin barrier damage in mice
Zhong Shaomin,Guo Jianmei,Tao Rong,Sun Nan,Wu Yan.Department of Dermatology,Peking University First Hospital,Beijing 100034,China
Wu Yan,Email:adelewu@medmail.com.cn
ObjectiveTo investigate the effect of fusidic acid cream on inflammatory reaction caused by skin barrier damage.MethodsEight male SKH-1 hairless mice were included in this study.The back of each of these mice were equally divided into six regions measuring 1 cm × 2 cm in size,which were then assigned into six groups:blank control group remaining untreated,barrier-impaired group,barrier-impaired and fusidic acid-treated group,barrier-impaired and vehicle-treated group,barrier-unimpaired and fusidic acid-treated group,barrierunimpaired and vehicle-treated group.Stratum corneum was removed by adhesive tape stripping to establish an animal model of acute skin barrier damage in the corresponding skin regions of these mice,and fusidic acid cream or vehicle was topically applied to the corresponding regions once.Twelve hours later,skin surface swab samples were collected from the back of these mice followed by bacterial culture and colony counting.Mice were then sacrificed,and skin tissue specimens were resected from these mice,and subjected to real-time fluorescence-based quantitative PCR for the measurement of the mRNA expressions of myeloid differentiation factor 88(MyD88),interleukin-1α (IL-1α),IL-6,epidermal antibacterial peptides S100a8 and S100a9.Statistical analysis was carried out by repeated-measures analysis of variance(ANOVA)and least significant difference(LSD)test.ResultsThe mRNA expressions of MyD88,IL-1α,IL-6,S100a8 and S100a9 were all significantly higher in the barrier-impaired group than in the blank control group(allP< 0.05).Specifically,the mRNA expression level of MyD88 in the barrier-impaired group was 8 times that in the blank control group(8.3±3.0 vs.0.8±0.4).Compared with the barrier-impaired group,the barrier-impaired and fusidic acid-treated group showed a significant decrease in the mRNA expressions of IL-1α (2.8±0.3 vs.20.1±10.0,F=47.11,P<0.01),IL-6(1.6±2.3 vs.9.4±4.0,F=16.18,P< 0.01),S100a8(1.5± 1.4 vs.5.0± 1.6,F=59.71,P< 0.05)and S100a9(1.2± 0.7 vs.3.4 ± 1.6,F=21.94,P< 0.05).ConlusionsFusidic acid cream could attenuate the inflammatory reaction caused by acute skin barrier damage,which might partly explain its action mechanism in the treatment of inflammatory skin diseases.
Fusidic acid;Skin barrier;Myeloid differentiation factor 88;Interleukins
10.3760/cma.j.issn.0412-4030.2014.12.009
100034北京大学第一医院皮肤科
吴艳,Email:adelewu@medmail.com.cn

