nm23 和E-cadherin 在食管鳞癌中的表达及临床意义
江 海 李 斌 魏远福 王 波
食管癌的浸润转移是影响术后患者预后的关键因素。nm23 是一种抑制肿瘤转移基因,其主要通过促进细胞的分化、参与免疫防御,从而抑制肿瘤细胞增殖、分化和侵袭转移[1]。E-cadherin 是一种细胞黏附分子,有研究表明E-cadherin 低表达与肿瘤细胞的分化程度、淋巴结转移等密切相关[2]。
本研究采用免疫组织化学S-P 法检测nm23 和E-cadherin蛋白的表达,探讨其与食管鳞癌的发生、分化程度、浸润深度及淋巴结转移的关系,从而进一步探讨E-cadherin 蛋白与nm23 蛋白之间的相关性,为预测食管鳞癌的转移提供理论依据。
1.材料与方法
1.1 材料 选取2010 年1 月~20012 年7 月期间在郧阳医学院附属人民医院经手术切除且术前均未接受过放疗、化疗及免疫治疗的食管癌标本68 例,其中女性30 例,男性38例,年龄35~78 岁,中位年龄56.5 岁。低分化鳞癌14 例,中分化鳞癌29 例,高分化鳞癌25 例;无淋巴结转移的鳞癌30例,有淋巴结转移的鳞癌38 例;有纤维膜浸润的鳞癌56 例,无纤维膜浸润的鳞癌12 例。同时取距肿瘤5cm 的正常食管黏膜组织23 例作对照。
1.2 方法 选取的食管鳞癌组织和正常食管黏膜组织行常规石蜡包埋,连续切片,厚4μm,分别作HE 染色﹑免疫组化和阴性对照用。采用免疫组化技术(S-P 法)对各组标本中的E-cadherin 和nm23 进行检测,鼠抗人nm23 单克隆抗体、鼠抗人E-cadherin 单克隆抗体及链霉素抗生物素蛋白-过氧化物酶试剂盒购自北京中杉金桥生物技术有限公司,鼠抗人nm23 单克隆抗体和鼠抗人E-cadherin 单克隆抗体均采用微波修复抗原,操作步骤按说明书进行,用PBS 代替一抗作阴性对照,已知阳性片作阳性对照。
1.3 结果判定标准
1.3.1 nm23 结果判定:根据参考文献[3]nm23 蛋白阳性表现为肿瘤细胞胞浆内和/或细胞膜上棕黄色颗粒或团块,结果以阳性细胞数所占百分比来表示,按照美国Sabina signiretti判断标准,每张切片由两名有经验的病理科医生观察10 个具有代表性的高倍视野,每个高倍视野记数200 个肿瘤细胞,按照镜下阳性细胞占肿瘤细胞总数的百分率综合判断,以肿瘤细胞中着色细胞的百分率来表示<10%记为阴性(-),>25%记为阳性(+)。
1.3.2 E-cadherin 结果判定:根据参考文献[4]的方法,以细胞膜呈现棕黄色颗粒为阳性细胞。对每张切片随机选取5个高倍视野,每个视野计数200 个细胞,共计1000 个,计数阳性细胞并计算其所占比例:阳性细胞<25%,判定为阴性表达,阳性细胞>25%,判定为阳性表达。
1.4 统计学方法 采用χ2检验及配对χ2相关分析,t检验、方差分析(F 检验),以a=0.05 为检验水准,当P <0.05 时表明在统计学上有显著性意义,P >0.05 为差别无显著性意义。统计工具应用SAS6.12 统计软件包。
2.结果
2.1 nm23 免疫组化检测结果 免疫组化检测结果显示(表1):nm23 正常食管组织中和在食管鳞癌阳性表达率分别是93.3%(28/30)及75%(35/68),两组间具有显著性差异(P <0.05)。nm23 在高、中及低分化食管鳞癌组织中阳性率分别为52%(13/25),51.7%(15/29)和50%(7/14),三组之间差异无显著性意义(P >0.05)。nm23 在有、无淋巴结转移的食管鳞癌组织中阳性表达率分别是52.7% (20/38)及36.7%(11/30),两组间具有显著性差异(P <0.05)。nm23在食管鳞癌组织中有、无浸润至纤维膜中的阳性表达率分别是75%(42/56)及41.7%(5/12),两组间具有显著性差异(P <0.05)。

表1 nm23 在食管鳞状细胞癌和正常食管黏膜组织中的表达
2.2 E-cadherin 免疫组化检测结果 免疫组化检测结果显示(见表2):E-cadherin 蛋白在正常的食管鳞状上皮组织中以基底层细胞和棘层细胞表达最强。E-cadherin 蛋白在食管鳞癌和正常食管组织中阳性表达率分别是69.1%(47/68)及100%(30/30),两组间具有显著性差异(P <0.05)。E-cadherin 蛋白在高、中、低分化的癌组织的阳性表达率分别为84%(21/25),72.4%(21/29)和51.1%(8/14),结果显示Ecadherin 蛋白在食管鳞癌组织的不同分化程度中的表达有明显差异(P <0.05)。E-cadherin 蛋白在有、无淋巴转移的癌组织中阳性表达率分别为57.9%(22/38)和80%(24/30),二者的阳性表达率差别有显著意义(P <0.05)。E-cadherin 蛋白在有、无纤维膜浸润的食管鳞癌组织中的阳性表达率分别为71.4%(40/56)和66.7%(8/12),二者的阳性表达率差别无显著意义(P >0.05)。
2.3 nm23 与E-cadherin 的关系 食管癌组织中nm-23的表达与E-cadherin 的表达呈正相关(P <0.05,表3),提示nm-23 与E-cadherin 在促进食管癌的分化,抑制食管癌的发生、转移中,可能有正向调节的协同作用。
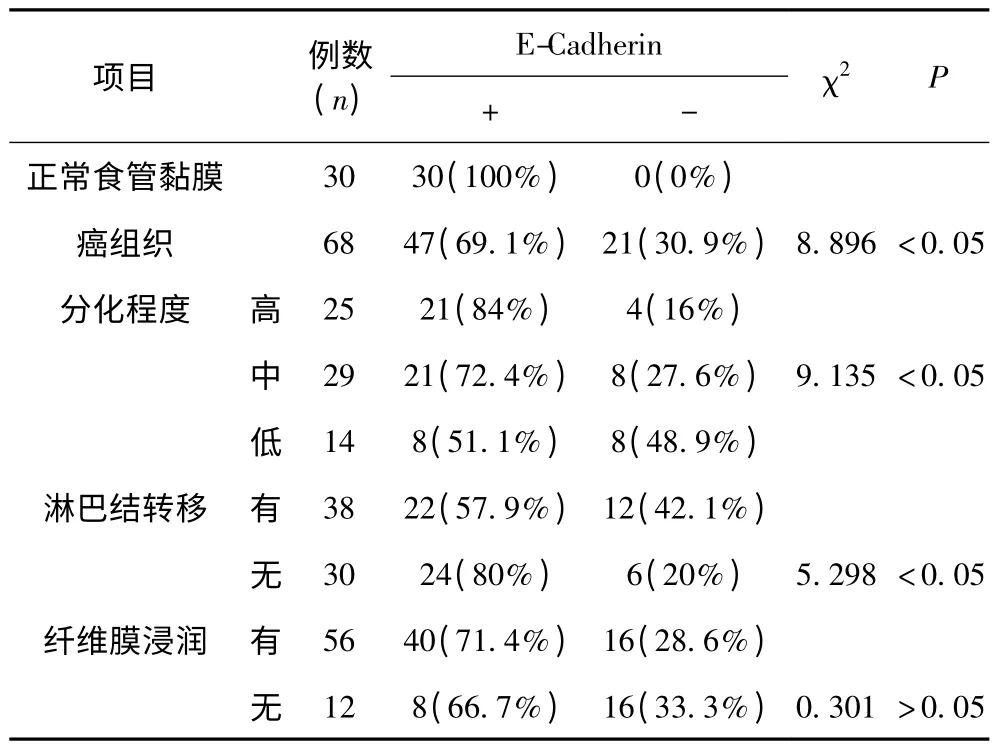
表2 E-Cadherin 在食管鳞状细胞癌和正常食管黏膜组织中的表达

表3 nm23 和E-Cadherin 在食管鳞状细胞癌中表达的相互关系
3.讨论
1988 年美国国立癌症研究所的steeg 等,应用差异杂交(differential hybridization)等技术从小鼠黑色素瘤k-1735 细胞株中分离出肿瘤转移抑制基因nm23[5]。目前多研究表明,在乳腺癌、肝癌、肺癌、胃癌、卵巢癌等肿瘤中nm23 的表达水平与肿瘤的发生发展和转移相关密切[6,7]。Nm23 可能通过对肿瘤细胞转移相关蛋白或基因的调控而抑制细胞的转移[8]。同时也通过改变肿瘤细胞骨成分结构,使细胞形态发生变化,从而抑制肿瘤细胞转移[9]。
本研究研究发现,nm23 在食管鳞癌组织中的表达低于正常组织,具有显著的统计学差异,提示nm23 的低表达可能与食管癌的发生有关。nm23 在无淋巴结转移组的食管癌组织中的阳性表达率高于有淋巴结转移组,提示nm23 的低表达可能与食管鳞状细胞癌的转移有关。nm23 在无纤维膜浸润的食管癌组织中的阳性表达率高于有纤维膜浸润组,提示nm23 的低表达可能与食管鳞状细胞癌的浸润有关。其表明nm23 表达降低,机体对肿瘤细胞的抑制力减低,使其更易向周围组织浸润及转移。
E-cadherin 是维持细胞形态和结构的完整性和极性的Ca2+依赖性跨膜糖蛋白。有研究表明,当肿瘤细胞的E-钙黏附素发生基因突变、转录受抑、启动子区域GpG 高度甲基化或翻译紊乱时,其功能发生障碍,而使肿瘤细胞发生侵袭性生长,同时是肿瘤细胞分化程度降低及易脱离原发灶而发生局部或远处转移[10]。本研究表明食管癌中存在明显的E-cadherin 表达缺失或表达水平的降低(P <0.05),从蛋白水平上证明了E-cadherin 基因的失活与食管癌的发生有关。本研究还发现伴无淋巴结转移的癌组织E-cadherin 蛋白的阳性表达率明显高于有淋巴结转移组(P <0.05),低分化的癌组织Ecadherin 蛋白的阳性表达率明显低于高分化的癌组织(P <0.05),这说明E-cadherin 表达的减少与食管鳞癌分化和淋巴结转移有关。
本研究结果显示食管鳞状细胞癌组织中nm-23 的表达与E-cadherin 的表达呈正相关(P <0.05),提示E-cadherin 与nm-23 在抑制食管癌的发生、转移中,以及促进食管癌的分化中,可能有正向调节的协同作用,共同抑制食管鳞癌的发生和转移,两者表达水平的增高可能共同抑制淋巴结的转移,但这并不能说明nm23 能够促进E-cadherin 的表达,其具体作用机制目前尚不太清楚,nm-23 与E-cadherin 的关系还有待于进一步研究。
1 Steeg PS.Perspectives on classic article:metastasis suppressor genes[J].J Natl Cancer Inst,2004,96(6):E4.
2 Shiozaki H,Doki Y,Yamana H,et al.A multi-institutional study of immunohistochemical investigation for the roles of cyclin D1 and E-cadherin in superficial squamous cell carcinoma of the esophagus[J].Journal of Surgical Oncology,2002,79:166 -173.
3 Steeg PS.Perspectives on classic article:metastasis suppressor genes[J].J Natl Cancer Inst,2004,96(6):E4.
4 Kawasaki H,Altieri DC,Lu CD,et al.Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer[J].Cancer Research,1998,58(22):5071 -5074.
5 Steeg PS,Bevilacqua G,Kopper L,et al.Evidence for a novel gene associated with low tumor-metastatic potential[J].J Natl Cancer Inst,1988,80:200 -203.
6 Dursun A,Akyorek N,Gonel N,et al.GPrognostic implication of nm23-H1 expression in colorectal carcinomas[J].The Journal of Pathology,2002,34(5):427 -432.
7 Lee JH,Marshall JC,Steeg PS,et al.Altered gene and protein expression by Nm23-H1 in metastasis suppression[J].Molecular and Cellular Biochemistry,2009,329(1 -2):141 -148.
8 聂强,周清华,朱文.nm23-H1 通过下调PKC 信号通路抑制肺癌细胞侵袭[J].中华肿瘤杂志,2006,28(5),334 -336.
9 Murakami M Meneses PI,Knight JS,et al,Nm23-H1 modu-lates the activity of the guanine exchange factor Dbl-1[J].International Journal of Cancer,2008,123(3):500 -510.
10 Berx G,Staes K,van Hengel J,Molemans F,Bussemakers MJ,van Bokhoven A,van Roy F.Cloning and Characterization of human invasion suppressor gene E-cad(CDH 1)[J].Genomiccs,1995,26:281.

