铁矿区内重金属对土壤氨氧化微生物群落组成的影响
洪 晨,邢 奕,2*,司艳晓,2,李 洋 (.北京科技大学土木与环境工程学院,北京 00083;2.北京科技大学金属矿山高效开采与安全教育部重点实验室,北京 00083)
铁矿区内重金属对土壤氨氧化微生物群落组成的影响
洪 晨1,邢 奕1,2*,司艳晓1,2,李 洋1(1.北京科技大学土木与环境工程学院,北京 100083;2.北京科技大学金属矿山高效开采与安全教育部重点实验室,北京 100083)
以密云水库上游某铁矿区为研究对象,采用荧光定量PCR和变性梯度凝胶电泳(DGGE)分析了矿区内不同采样点的土壤中氨氧化微生物的数量和群落结构的变化,结果表明,土样中氨氧化细菌(AOB)和氨氧化古菌(AOA)的数量变化范围分别为 3.01×107~1.08×109copies/g干土和 8.65×107~2.69×109copies/g干土.重金属含量与氨氧化微生物数量的相关性分析以及氨氧化微生物群落结构的冗余分析结果表明,该矿区内重金属污染改变了土壤中的氨氧化微生物的数量和结构.Cu污染对AOA的数量起到了显著抑制作用(r= -0.653*, P<0.05),但是对AOB则没有明显作用;Zn污染对尾矿库区域土壤的AOA/AOB比值影响显著(r= -0.606*, P<0.05);Cd污染改变了AOB的种群分布,降低了AOB的多样性水平.土壤中Cr长期干扰并没有改变氨氧化微生物的数量和结构,但是明显得抑制了氨氧化速率,表明重金属污染在一定程度上也影响了土壤生态系统的氮循环.
铁矿区;氨氧化古菌(AOA);氨氧化细菌(AOB);DGGE;real-time PCR
金属矿山开采和选冶活动会造成矿区及其周边土壤环境中重金属的累积,累积在土壤中的重金属元素在地表径流和生物地球化学作用下还会发生迁移,进入到周围的大气、水和土壤环境中,通过直接呼吸及食物链长期危害人体健康[1-2].土壤微生物对重金属的胁迫要比同一环境中的动物和植物敏感得多,多种终点指标可以被用来指示重金属对土壤微生物群落的效应,如土壤生物量、土壤呼吸、酶活性、硝化作用和固氮等.其中,硝化作用是对重金属胁迫最敏感的土壤微生物过程之一[3].另外,硝化作用是土壤氮素转化的重要过程,不仅关系到铵态氮在土壤中的转化,而且与过量氮肥投入导致的土壤酸化、硝酸盐淋失及其引起的水体污染和温室气体(N2O)[4]释放等一系列生态环境问题直接相关.
一直以来,氨氧化细菌(AOB)被认为是自养氨氧化过程的最重要贡献者.然而,泉古菌门中的化能自养氨氧化古菌(AOA)的发现,将氨氧化微生物由细菌域推进到古菌域[5].有研究表明在高氮投入的中性和碱性的环境中,AOB是硝化作用的主要驱动者,而AOA主要在较苛刻的环境包括低氮、强酸性和高温的环境中发挥功能活性[6-8].然而也有学者认为,一般农田土壤和草地土壤中主导氨氧化过程的是 AOB而不是 AOA[9-10].因此,AOA和AOB对自养硝化过程的相对贡献仍是争论的热点.各种研究显示,复杂自然环境下不同的理化性质驱使AOA和AOB产生不同的反应,从而在氮循环中占据各自的生态位[8].
在氨氧化过程中,氨氧化细菌和古菌都有由amoA基因编码的氨单加氧酶(AMO),其α亚基能催化NH3到NH2OH[11].因此,amoA基因是目前用来研究陆地和水体生态系统中氨氧化微生物的主要途径.然而,采用分子生物学手段研究土壤硝化微生物功能种群的演变还处于起步阶段,大部分研究围绕着土壤理化性质如pH值、温度、水分、底物浓度及不同土壤类型、土地利用类型[12-18]对氨氧化微生物的影响,对自然土壤中重金属长期干扰下土壤氨氧化功能基因的变化规律[19]则研究较少.
本研究以密云水库上游铁矿区为例,采集了矿区内重金属污染下的土壤样品,分别测定其氨氧化势(PAO),通过荧光定量 PCR和变性梯度凝胶电泳(DGGE)研究amoA基因的丰度和多样性,得到该区域内群落组成变化与硝化作用的关联,并在环境因子与氨氧化群落之间的复杂关系中找到重金属对氨氧化微生物起到的作用,为进一步了解重金属在氮循环中起到的作用提供基础信息.
1 试验材料与方法
1.1 样品采集及处理
研究区为北京市密云县北部山区某铁矿区,位于密云水库上游 10km以内,矿区紧挨潮河,该地区富含铁矿资源,采矿历史有 30年之久,采矿活动频繁.以尾矿库为中心,矿区内尾矿库周围5km的范围内,根据村落的分布,在每一个村落周围采集不同土地利用类型(人工林、庄稼地)的表层土壤共10个点,在尾矿库区域采集荒漠地表层土壤共4个点,如图1所示.在每个采样点的不同位置按Z字型分别采样4次,然后混合均匀作为一个样品,并详细记录采样点环境状况,所有样品保存在密封的塑料封口袋中.一部分土样立刻放入-20℃冰冻箱中保存用作分子学实验.另一部分经风干、研磨、过筛后,供土壤理化性质、重金属含量测定,所有土壤置于4 ℃保存备用.
1.2 土壤理化性质及重金属含量测定
土壤基本理化性质采用常规方法测定.pH值测定(水土比为 2.5:1)采用 pH 计(Starter-3C,OHAUS,USA).采用 CHNS/O (Perkin-Elmer,USA)元素分析仪测定土壤有机碳、全氮含量.有效磷采用钼锑抗比色法测定.土壤中重金属总量根据国家地质实验测试中心标准(Q/GD001-2002)土壤中微量元素的密闭溶样-电感耦合等离子质谱法测定.铵态氮采用2mol/L KCl浸提后靛酚蓝比色法测定其含量.硝态氮含量采用双波长法测定
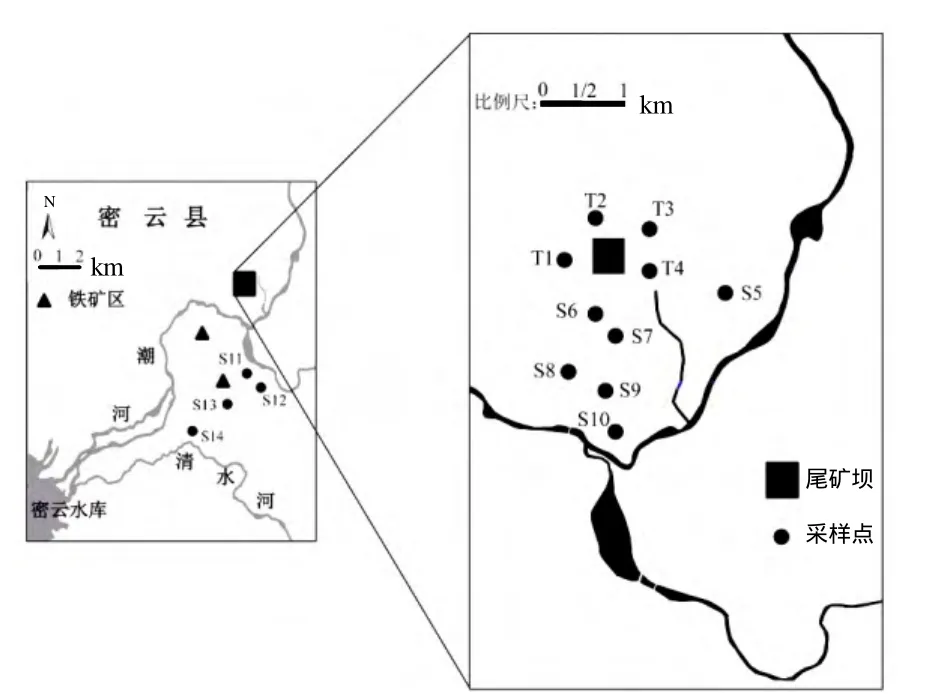
图1 研究区域及采样点分布Fig.1 The study area and sampling sites location
1.3 土壤潜在氨氧化势(PAO)测定
根据Kurola等[20]的方法,取5g鲜土于50mL离心管中,PBS缓冲液(g/L:NaCl,8.0;KCl,0.2;Na2HP04,0.2;NaH2P04,0.2;pH7.4)和 5mol/L(NH4)2SO4溶液各50mL(此时溶液中氨氮浓度为70mg/L),加入 1mL 1g/L的亚硝氮氧化抑制剂KClO3(终浓度为 10mg/L),培养后加入 5mL 2mol/LKCI提取-N,离心后用重氮化偶合分光光度法测定提取液中-N 浓度,以mg-N/(kg干土·h)表示土壤硝化势.
1.4 荧光定量PCR
土壤总DNA采用美国MoBio公司的土壤微生物强力提取试剂盒提取.提取的 DNA纯化后置于-20℃储存.氨氧化细菌和古菌的荧光定量PCR扩增采用特异引物(表 1).于 ABI Prism 7500Real-time PCR system扩增仪上进行绝对定量PCR分析.每个样品 3次重复,荧光定量 PCR反应体系 20μL,每个体系包括:10μL AB qPCR Master Mix (AB gene),正向和反向引物(10mmol/L)各 1.0μL,牛 血 清 白 蛋 白 1μL(10mmol/L),超纯水7μL,DNA模板1μL.反应体系为:94℃ 15min;94℃ 15s,变性温度(表 1)1min,72℃ 34s,共40个循环.根据He等[21]报道记载方法建立标准曲线,以提取的混合 DNA为模板进行氨氧化细菌和氨氧化古菌的amoA基因的 PCR扩增,将PCR产物切胶纯化后,ρMD l8-T载体连接PCR产物,以大肠杆菌DH5α制备的感受态细胞转化连接产物,在氨苄青霉素平板上进行蓝白斑试验筛选阳性克隆.取部分阳性转化菌液进行测序.重组质粒测序结果经 GenBank的 Blast比对,分别与细菌和泉古菌 amoA基因同源性达99%.表明重组质粒可以作为氨氧化微生物进行绝对荧光定量 PCR分析的标准 DNA.提取重组质粒 DNA,用 Nanodrop(美国)测定重组质粒DNA的质量浓度,分别计算 amoA基因拷贝数,其中氨氧化细菌为 8.58×1010copies/μL,氨氧化古菌为4.8×1010copies/μL.以10倍梯度分别稀释重组质粒,使得 DNA浓度范围在 100~10-4ng.通过荧光定量PCR扩增分别获得细菌、古菌的基因amoA标准曲线.其中Ct与基因拷贝数之间存在明显的线性关系(r2>0.99,扩增效率在90%~105%之间).由标准曲线可以得出未知样品细菌和古菌的amoA基因拷贝数.每g干土的基因拷贝数分别代表了AOB和AOA的丰度.AOA/AOB为氨氧化古菌和氨氧化细菌的丰度的比值,是研究自养硝化微生物相对贡献率的一个重要指标.

表1 PCR扩增引物及反应条件Table 1 PCR amplification primers and reaction conditions
1.5 变性梯度凝胶电泳( PCR-DGGE)
应用表 1中所示引物对提取的矿区土壤总DNA样品进行扩增,引物及PCR反应条件如表1所示.GC夹(CGCCCGGGGCGCGCCCCGGGC GGGGCGGGGGCACGGGGG G)分别加到正向引物前面,以保证DGGE实验的稳定和片断的分离.25μL PCR反应体系组成如下:2×PCR预混液12.5μL,去离子水 9μL,DNA 模板 0.5μL,正向引物和反向引物(10mmol/L,上海生工)各 0.5μL.氨氧化细菌PCR反应条件:94℃预变性5min;94℃变性 30s,55℃退火 30s,72℃延伸 40s,共 35个循环,72℃最终延伸 10min,4℃保温.氨氧化古菌PCR反应条件:94℃预变性 5min;94℃变性30s,53℃退火 30s,72℃延伸 50s,共 35个循环,72℃最终延伸10min,4℃保温.获得PCR产物后,取部分反应混合物用 1%琼脂糖凝胶电泳检测.变性梯度凝胶的制备使用北京君意公司变性梯度凝胶电泳系统.变性梯度范围如表1所示,聚丙烯酰胺凝胶浓度是8%.在 1×TAE电泳缓冲液中,100V 的电压下,60℃电泳 10h.电泳结束后,采用 1:10000SYBR 染色 30min后,用 Red™Personal Imaging System(ProteinSimple, Santa Clara, CA, USA)成像和拍照.DGGE图谱中DNA条带由凝胶成像系统分析软件 Quantity One(version 4.6.7)识别和统计,确定各个样品电泳条带的多少,亮度峰值.
1.6 数据分析
以细菌种群在每一泳道中亮度峰面积的百分含量为重要值构造细菌矩阵,为降低稀有种群对排序的影响,用于排序的种群要同时满足该种群在各样点出现的频度≥2和该种群在至少一个样点的相对丰度≥1%的要求.为消除量纲不同对数据分析的干扰,对环境因子进行标准化和中心化处理,对种群信息进行中心化处理.使用 Canoco(version 4.5,Biometrics-Plant Research International,The Netherlands)软件对土壤理化性质、重金属以及数据化后的种群信息进行冗余分析(RDA),得到微生物种群变化的主要解释因子.采用 Monte Carlo permutation检验2种RDA排序轴特征值的显著性,置换次数均为 499次.土壤理化性质(含水率、pH值、有效磷、有机碳、全氮、、)、重金属含量和细菌、真菌、放线菌的数量变化的相关性采用SPSS(SPSSlnc., Chicago, 1L)分析.
2 结果与分析
2.1 土壤基本理化性质和重金属含量分析
如表 2所示,土壤 pH值的变化范围在7.2~7.8之间,这和以往北京郊区土壤的pH值测定范围(7.0~8.2)一致.研究区域土壤的含水率在7.59%~25.59%内,以荒草地的含水率值最低,而且有机碳(1.26~5.81g/kg)、全氮量(0.29~0.70g/kg)和有效磷(1.26~5.81mg/kg)也是在荒草地取得最低值.其它来自农田和林地的采样点有机碳、全氮及有效磷含量均比荒草地要高,这可能与农田长期施用N-P-K复合肥有关,可能是因为长期施用化学肥料能提高难氧化有机质含量,增加土壤有机碳的氧化稳定性,从而增加土壤中碳氮含量[24],另外人工林地表覆盖了大量植被残落物,经过微生物的分解及缓慢的腐解过程,转化为腐殖质,增加土壤中的碳氮储量.

表2 土壤基本理化性质Table 2 Physico–chemical characteristics of soil samples
表3中可以看到,矿区内Cr、Cd平均含量超出北京市土壤背景值4~5倍[25],Cu、Zn超过土壤背景值约2倍,其他重金属(Pb、Ni、Co等)并未超出该地区土壤背景值(未在表 3中显示).就全国土壤背景值(国家土壤环境质量一级标准)而言[26],Cr、Cu、Cd平均含量均超过一级标准,其中 Cd的平均含量超过土壤一级标准 2~3倍,而Zn平均含量则未超过一级标准.以我国土壤环境质量一级标准作为重金属污染评价的质量标准[26],计算了 14个采样点的内梅罗综合污染指数,结果表明,尾矿库周围(T1、T2、T3、T4)的 Cd含量均值达 0.68mg/kg,超过一级标准(0.2mg/kg)3倍以上,是造成该区域中度污染的主要元素.矿区内其它采样点(S5~S14)均属于轻度污染区域.该矿区内由于长期进行露天采矿及在选矿过程中筛分、破碎矿石,产生了大量含有重金属元素的工业粉尘,在风力作用下扩散、沉降;另外开采过程中产生的剥离矿以及选矿后产生的尾矿,有效利用率低,长期在地表堆积,在地表径流、风力、雨水淋溶的作用下,重金属组分不断地扩散迁移.这些因素均导致重金属大量进入到周围土壤环境中,使该矿区内土壤环境受到一定程度的污染.
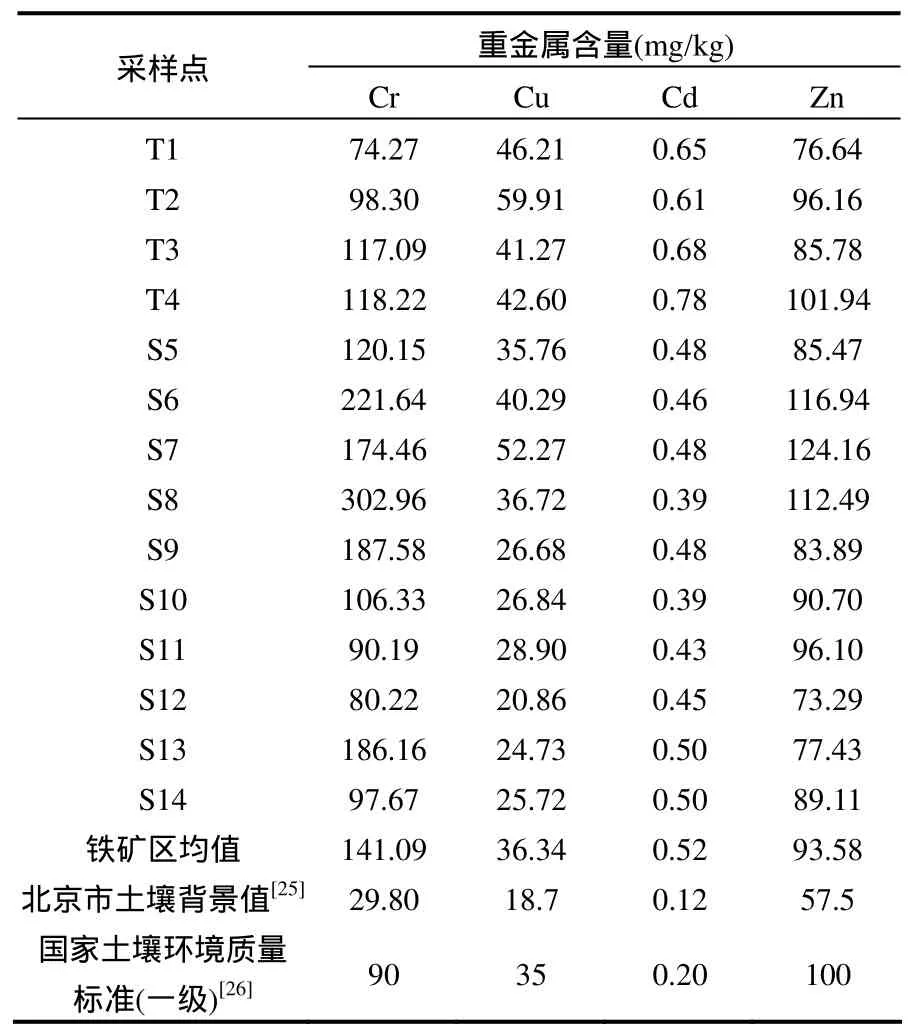
表3 土壤重金属含量Table 3 The metal content of soil samples
2.2 氨氧化势及amoA基因丰度变化
对不同采样点的氨氧化势和 amoA基因拷贝数进行测定,结果如图2、3显示.氨氧化势即为将氧化成的能力,可以代表土壤中的硝化作用.由图2可以看到,以尾矿库周围的采样点 T1、T2氨氧化速率最低,分别为 0.005,0.001mg/(kg·h),并且可以明显看到,尾矿库周围土壤的氨氧化速率普遍较低,均值为 0.020mg/(kg·h).氨氧化速率较高的采样点为 S10、S8,分别为 0.213, 0.171mg/(kg·h).
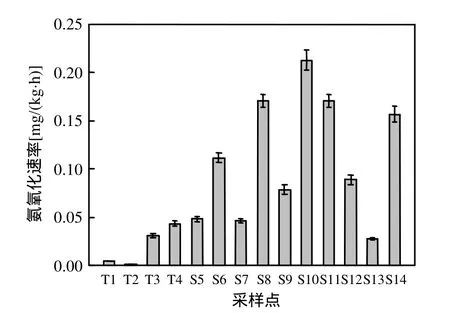
图2 不同采样点氨氧化势变化Fig.2 Changes in potential for ammonia oxidation of different sampling sites

图3 不同采样点amoA基因丰度变化Fig.3 Changes in amoA gene copies of different sampling sites
由图 3得出,AOA基因拷贝数为每克干土8.65×107~2.69×109copies,最大值出现在 S9 采样点.AOB基因拷贝数为每克干土3.01×107~1.08×109copies,最大值在点 S10取得,两者均是在采样点 T2处达到最低值.所有采样点土壤中,AOA丰度都比AOB高,AOA/AOB比率在1.21~8.69之间.
2.3 土壤理化性质、重金属对 amoA、PAO的影响
由表 4可以看到,有效磷、有机碳、全氮、硝酸盐都与氨氧化势有显著的相关性(P<0.05).由此可知,土壤理化性质是影响氨氧化作用的重要因素,这在很多研究中都已得到证实[12,15].C、N、P等为硝化微生物的机体构建提供必需元素,而且氮作为硝化作用的基质,因此土壤 C、N等的有效性均对硝化作用具有重要影响.土壤硝态氮含量高低是表征土壤硝化作用强弱的重要参数,土壤中硝态氮含量越高,说明其具有越强的硝化潜力[12,15].AOA和AOB的数量与氨氧化势都有显著的相关性(r=0.642,P<0.01;r=0.541,P<0.05),其中以AOA的相关性更强.说明AOA在该区域的氨氧化微生物群落生态功能中占据更重要的地位.
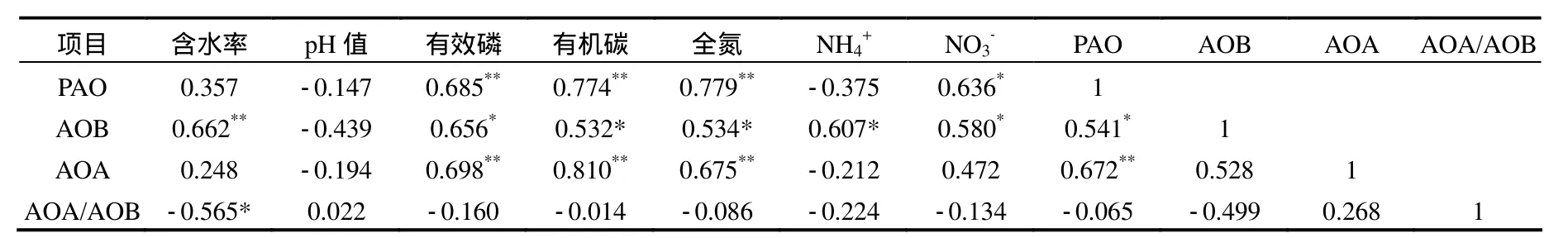
表4 土壤理化性质与amoA、氨氧化势的相关性Table 4 The correlation between soil physico–chemical characteristics and amoA abundance and potential for ammonia oxidation
有机碳、有效磷、全氮都在不同程度上影响了氨氧化细菌和古菌的丰度(P<0.05),并进而影响了氨氧化作用.因此,在区域范围内,理化性质的区别是影响AOA、AOB丰度的重要原因.这与Yao等[12]和Kelly等[27]通过对土壤采样点中影响氨氧化微生物群落的多个环境因子进行分析,得到pH值、氮的基质浓度和磷含量是最主要的影响因子的结果相一致.贺纪正等[8]对我国典型土壤中这 2类氨氧化微生物的分布特征的研究中也发现,在区域尺度上,AOA和AOB的数量与土壤有机质含量呈显著正相关关系,这可能是因为有机质含量影响了土壤有机氮的矿化程度,从而影响了氨氧化微生物利用NH4+的效率.
在控制土壤理化性质的线性影响的条件下,对重金属、氨氧化势、氨氧化微生物进行偏相关分析,如表5所示.
由表5可以看到,Cu与AOA的数量有着显著的负相关性(r= -0.653*, P<0.05),AOA/AOB的比值与Zn存在显著的负相关(r= -0.606*, P<0.05),说明Zn长期污染对AOA和AOB产生了不同的影响.Cd与氨氧化微生物的数量并没有显著相关性.Cr对氨氧化过程起着显著的抑制作用,但是Cr与AOB、AOA均并未发现显著相关性,说明了 Cr可能是通过其他途径来改变氨氧化作用.
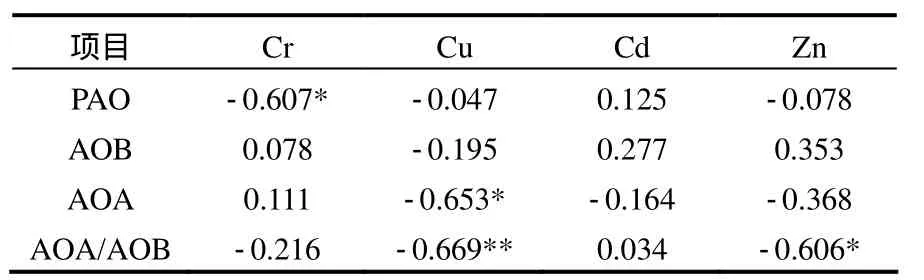
表5 重金属与amoA、氨氧化势的相关性Table 5 The correlation between metal content and amoA abundance and potential for ammonia oxidation
2.4 氨氧化微生物群落DGGE图谱分析
AOA、AOB的DGGE图谱如图4所示,AOB的多样性除去在T1、T2、T3取得较低值外,其他采样点的多样性均在1.81~2.23,条带数在7~12之间;而AOA的多样性的最低值在S6处,多样性在0.65~1.75之间,条带数在2~8条.可以看到,在该矿区内AOB的种群多样性明显比AOA丰富.
通过SPSS分析氨氧化势和氨氧化微生物多样性指数的相关性表明,氨氧化势与AOA、AOB种类都没有显著相关.
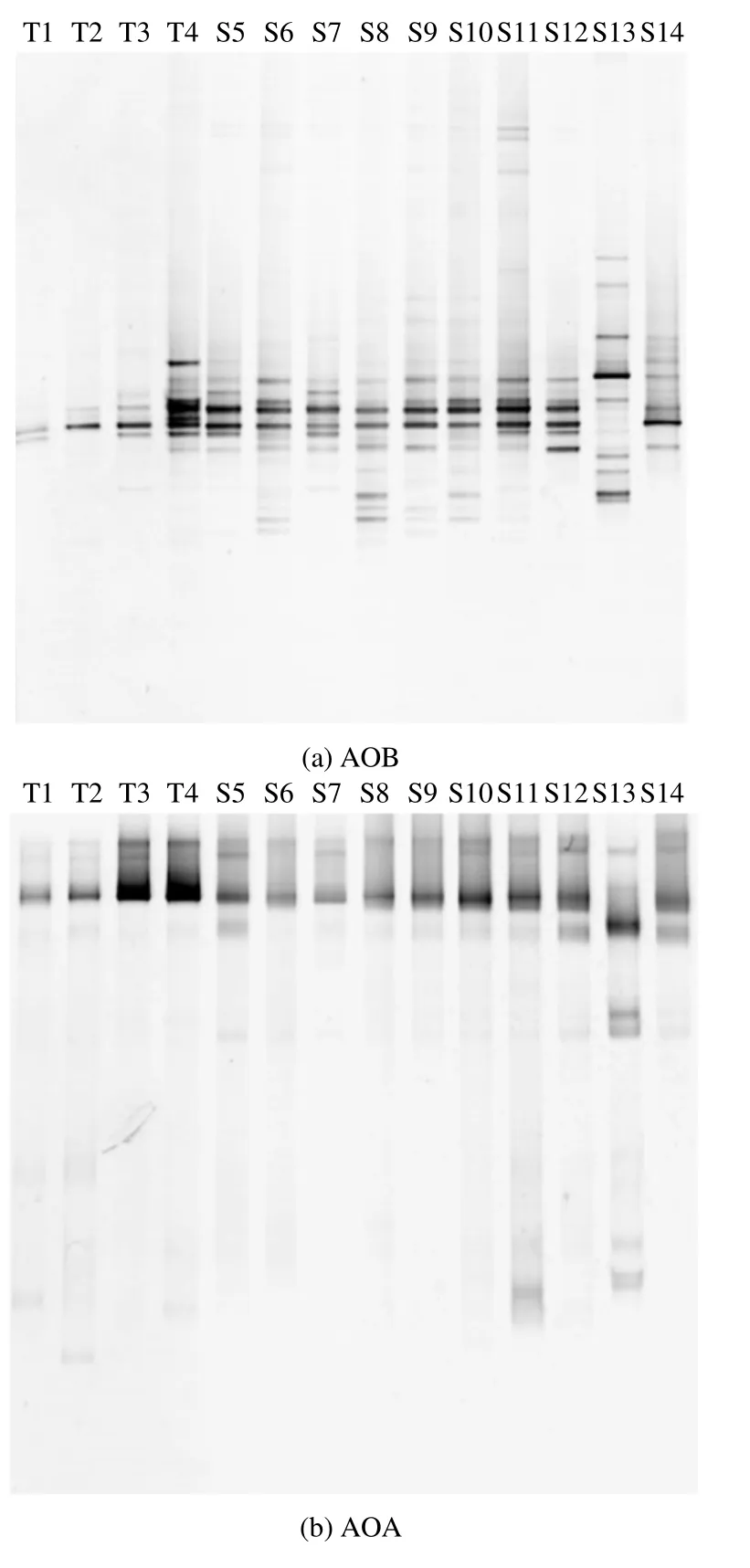
图4 矿区内不同采样点的氨氧化细菌DGGE图谱Fig.4 AOB (a)and AOA (b)DGGE fingerprint from different samples in iron area
2.5 环境因子对氨氧化微生物种群结构变化的影响
采用冗余分析(RDA)对影响氨氧化群落种群分布的环境因子进行了分析,结果表明,通过Monte Carlo permutation检验,所有排序轴均显著(P<0.01),说明排序效果理想.AOB的RDA的前两轴分别代表了种群 31.7%、16.0%的变异,对应了34.3%、17.3%的氨氧化细菌种群与环境因子之间关系.第 1排序轴仅与有着显著相关性(P<0.01),说明第1轴主要反映了的变化,即从左到右含量逐渐升高.从图5a中可以明显看到,种群富集在含量高的地方,仅有少数种群分布在含量低的地方.第2排序轴与Cd、有机碳、全氮、有效磷、含水率呈显著相关性(P<0.05),说明第2轴主要反映了Cd、有机碳等指标的变化,沿着第2轴从下到上,Cd含量逐渐下降,而其他指标逐渐升高.根据大部分种群的多分布在第2轴上方可以得出Cd对种群分布存在着抑制作用.
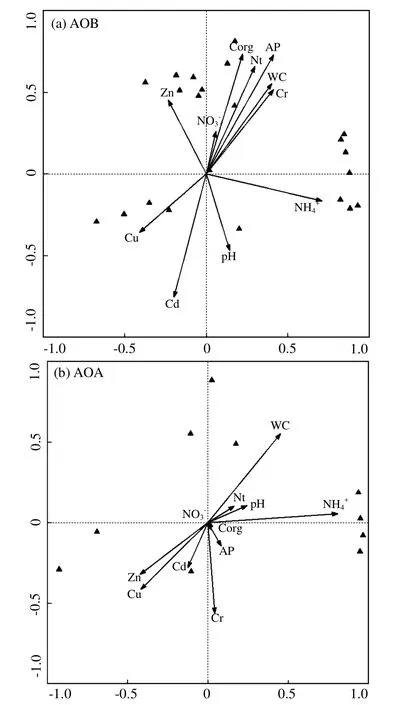
图5 冗余度(RDA)分析环境因素对土壤中氨氧化细菌(a)及古菌(b)群落结构变化的影响Fig.5 Redunancy discrimination analysis relating environmental variables to the community structure of AOB (a)and AOA (b)in iron area
对AOA种群信息的RDA分析表明,AOA的前2轴分别代表种群56.5%、13.7%的变异,对应60.0%、14.6%的氨氧化古菌种群与环境因子之间关系.第1排序轴同样仅与NH4+呈显著相关性(P<0.01),第2排序轴与含水率呈较显著相关性(P<0.05).说明AOA的种群分布仅受土壤理化性质的影响,长期污染重金属并未对 AOA的分布起到明显的抑制作用.
3 讨论
3.1 AOA、AOB的丰度和多样性水平
该区域内AOA和AOB的丰度变化范围较大,但是均在肥力水平较低、污染最重的尾矿库周围区域达到最低值,其 AOB基因丰度为3.01×107~2.19×108copies/g干土,AOA 基因丰度为 8.65×107~9.23×108copies/g 干土,分别比相同pH 及肥力水平的土壤[28]AOA 丰度(1.54×107~4.25×107copies/g干土)提高了2~20倍,比AOB的丰度(1.24×105~2.79×106copies/g 干土)提高了近200倍,AOA/AOB比值明显降低.而采自矿区内其他土壤如农田、林地的AOA和AOB与相同肥力水平的农田土壤[29]相比,均提高了 10倍左右,AOA/AOB比值范围在 1.21~7.35之间,与Wessen[29]的研究相差不多.因此,重金属污染可能影响了尾矿库区域土壤的 AOA/AOB比值,表5结果表明,Zn与AOA/AOB的负相关性显著(r=-0.606*,P<0.05),这种现象与其他研究者[19,30-31]的研究一致,Mertens等观察了AOA和AOB在长期Zn污染下的数量、mRNA转录水平变化,显示AOB和AOA在面对土壤Zn污染时,AOB表现出更强的抗性.
从图 4可以看出,AOB的群落结构变化比AOA明显得多,说明AOB更容易受到外界环境的影响,比如土壤理化性质、外来重金属污染等.Shen等[28]的研究也表明,碱性土壤中长期施肥处理对AOB的数量及组成有明显影响,而对AOA的影响较小.
3.2 重金属对氨氧化微生物群落丰度和多样性的影响
将氨氧化微生物群落丰度、多样性水平的变化进行分析,结果表明,该矿区内重金属污染对AOA、AOB的丰度以及AOB的种群结构产生了一定影响(表 5、图 5).比如 Cu对氨氧化古菌的数量起到了显著抑制作用(r= -0.653*,P<0.05),但是对氨氧化细菌则没有明显作用.Cd污染降低了AOB的多样性水平却没有改变AOB的数量,并没有发现Cd污染对AOA有显著影响.产生这些结果的可能原因是氨氧化古菌和氨氧化细菌在生理学上存在着根本区别,许多研究表明,在系统发育与进化方面,AOA形成了一类完全独立于AOB的进化分支,而且AOA的生理代谢机制与AOB不完全相同,AOA既可进行自养代谢,也可以通过混合营养方式生活[32].有研究认为氨氧化古菌的能量代谢依赖于含有Cu而非Fe的电子传递系统[33],这可能会影响氨氧化菌对重金属Cu的敏感性.Cd显著影响了AOB的种群多样性,但是并没有改变AOB的数量.可能因为AOB中某些种群对 Cd污染产生了抗性机制,其他种群受到抑制数量减少以致消失,而这些具有抗性的种群由于适应了污染环境,数量反而增多.
土壤中Cr长期干扰并没有改变氨氧化微生物的数量和结构,但是明显得抑制了氨氧化速率(r= -0.607*, P<0.05).Cr抑制氨氧化速率的可能途径为Cr进入细胞后,对编码氨单加氧酶的核糖核酸(amoA mRNA)的合成、转录过程起到抑制作用,从而导致功能酶的浓度下降逐步影响到硝化反应的速率[34].
3.3 AOA和AOB对土壤自养硝化过程的相对贡献率
AOA和 AOB对土壤自养硝化过程的相对贡献率是目前氮循环研究关键的微生物生态学问题之一[17].氨氧化微生物与氨氧化势的相关性(表 4)表明,AOA 在该区域氨氧化过程中占据了主要地位.有效磷、有机碳、全氮与AOA和AOB的相关性都比较显著(P<0.05),但是含水率和铵态氮与AOB有着显著相关性(P<0.05),而与AOA则没有相关,说明AOB相比AOA更容易受到含水率和铵态氮的影响,这也从另一方面证明了AOA比AOB更适应干旱、低氮的环境,许多研究也得出了这个结论[12,15],这就解释了荒草地中AOA为何在氨氧化过程中占据主要生态位.本研究还发现,在矿区内的农田和林地土壤中也是AOA主导氨氧化过程,这与一些研究结果 AOB在农田、草地土壤的氨氧化过程中起主要作用相反[9],但是有些学者则认为[27],AOA具有广泛的新陈代谢能力,能利用有机碳进行兼养和异养,因此可以在含碳量丰富的土壤中广泛分布.该研究中 AOA与有机碳的相关性比 AOB更显著(r=0.810**, P<0.01; r=0.532*, P<0.05),也给出了AOA在农田、林地土壤中不仅数量丰富也占据着更重要的生态位的原因.本研究还发现,虽然Cu、Zn对 AOA产生了一定的抑制作用(表 4),但是并没有改变AOA在硝化过程中的主导地位,说明低浓度的重金属并不足以改变 AOA和AOB生态位.
该区域内长期重金属Cu、Zn、Cd的轻度污染改变了AOA、AOB的丰度和种群结构,但是并没有改变AOA和AOB在硝化过程中的生态位.尽管土壤的氨氧化作用在很大程度上取决于土壤的理化性质,但是Cr与氨氧化势的显著相关性表明,重金属在一定程度上也影响了土壤生态系统的氮循环.因此,该地区的重金属污染应该引起有关部门重视,加强生态环境保护.
4 结论
4.1 AOA在该区域内氨氧化微生物的氮循环生态功能中占据更重要地位,重金属污染对AOA的抑制作用也没有改变AOA的主导地位.
4.2 重金属污染对氨氧化微生物的影响表现为,Cu对 AOA的数量起到了显著抑制作用(r=-0.653*, P<0.05),但是对 AOB则没有明显作用.Cd污染降低了AOB的多样性水平却没有改变AOB的数量.Cd污染对AOA没有显著影响.
4.3 重金属污染对氨氧化作用的影响表现为,Cr并没有改变氨氧化微生物的数量和结构,但是明显的抑制了氨氧化速率(r= -0.607*,P<0.05).
[1]Lee S. Geochemistry and partitioning of trace metals in paddy soils affected by metal mine tailings in Korea [J]. Geoderma,2006,135(0):26-37.
[2]Rodríguez L, Ruiz E, Alonso-Azcárate J, et al. Heavy metal distribution and chemical speciation in tailings and soils around a Pb-Zn mine in Spain [J]. Journal of Environmental Management,2009,90(2):1106-1116.
[3]Broos K, Mertens J, Smolders E. Toxicity of heavy metals in soil assessed with various soil microbial and plant growth assays: a comparative study [J]. Environmental Toxicology and Chemistry,2005,24(3):634-640.
[4]Braker G, Conrad R. 2Diversity, Structure, and Size of N2O-Producing Microbial Communities in Soils—What Matters for Their Functioning? [J]. Advances in Applied Microbiology,2011,75:33.
[5]Könneke M, Bernhard A E, José R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon [J]. Nature,2005,437(7058):543-546.
[6]Erguder T H, Boon N, Wittebolle L, et al. Environmental factors shaping the ecological niches of ammonia-oxidizing archaea [J].FEMS Microbiology Reviews, 2009,33(5):855-869.
[7]Schleper C. Ammonia oxidation: different niches for bacteria and archaea? [J]. The ISME Journal, 2010,4(9):1092-1094.
[8]贺纪正,张丽梅.土壤氮素转化的关键微生物过程及机制 [J].微生物学通报, 2013,40(1):98-108.
[9]Jia Z, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil [J]. Environmental Microbiology, 2009,11(7):1658-1671.
[10]Di H J, Cameron K C, Shen J P, et al. Nitrification driven by bacteria and not archaea in nitrogen-rich grassland soils [J].Nature Geoscience, 2009,2(9):621-624.
[11]Mendum T A, Hirsch P R. Changes in the population structure of β-group autotrophic ammonia oxidising bacteria in arable soils in response to agricultural practice [J]. Soil Biology and Biochemistry, 2002,34(10):1479-1485.
[12]Yao H, Campbell C D, Chapman S J, et al. Multi-factorial drivers of ammonia oxidizer communities: evidence from a national soil survey [J]. Environmental Microbiology, 2013,15(9):2545-2556.
[13]Hartmann A A, Barnard R L, Marhan S, et al. Effects of drought and N-fertilization on N cycling in two grassland soils [J].Oecologia, 2013,171:705-717.
[14]Verhamme D T, Prosser J I, Nicol G W. Ammonia concentration determines differential growth of ammonia-oxidising archaea and bacteria in soil microcosms [J]. The ISME Journal, 2011,5(6):1067-1071.
[15]O'Sullivan C, Wakelin S, Fillery I, et al. Factors affecting ammonia oxidising micro-organisms and potential nitrification rates in southern Australian agricultural soils [J]. Soil Research,2013,51(3):240-252.
[16]孟德龙,杨 扬,伍延正,等.多年蔬菜连作对土壤氨氧化微生物群落组成的影响 [J]. 环境科学, 2012,33(4):1331-1338.
[17]黄 蓉,张金波,钟文辉,等.土地利用方式对万木林土壤氨氧化微生物丰度的影响 [J]. 土壤, 2012,44(4):581-587.
[18]白 洁,董 晓,赵阳国.辽河口芦苇湿地土壤氨氧化菌的时空变化 [J]. 中国环境科学, 2011,31(11):1870-1874.
[19]Ruyters S, Nicol G W, Prosser J I, et al. Activity of the ammonia oxidising bacteria is responsible for zinc tolerance development of the ammonia oxidising community in soil: a stable isotope probing study [J]. Soil Biology and Biochemistry, 2012,58:244-247.
[20]Kurola J, Salkinoja Salonen M, Aarnio T, et al. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil [J]. FEMS Microbiology Letters, 2005,250(1):33-38.
[21]He J Z, Shen J P, Zhang L M, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices [J]. Environmental Microbiology,2007,9(9):2364-2374.
[22]Rotthauwe J, Witzel K, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker:molecular fine-scale analysis of natural ammonia-oxidizing populations. [J]. Applied and Environmental Microbiology, 1997,63(12):4704-4712.
[23]Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing archaea in water columns and sediments of the ocean [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005,102(41):14683-14688.
[24]沈 宏,曹志洪,胡正义.土壤活性有机碳的表征及其生态效应[J]. 生态学杂志, 1999,18(3):32-38.
[25]陈同斌,郑袁明,陈 煌,等.北京市土壤重金属含量背景值的系统研究 [J]. 环境科学, 2004,25(1):117-122.
[26]GB. 15618-1995 土壤环境质量标准 [S].
[27]Kelly J J, Policht K, Grancharova T, et al. Distinct responses in ammonia-oxidizing archaea and bacteria after addition of biosolids to an agricultural soil [J]. Applied and Environmental Microbiology, 2011,77(18):6551-6558.
[28]Shen J P, Zhang L M, Zhu Y G, et al. Abundance and composition of ammonia-oxidizing bacteria and ammoniaoxidizing archaea communities of an alkaline sandy loam [J].Environmental Microbiology, 2008,10(6):1601-1611.
[29]Wessén E, Nyberg K, Jansson J K, et al. Responses of bacterial and archaeal ammonia oxidizers to soil organic and fertilizer amendments under long-term management [J]. Applied Soil Ecology, 2010,45(3):193-200.
[30]Mertens J, Broos K, Wakelin S A, et al. Bacteria, not archaea,restore nitrification in a zinc-contaminated soil [J]. The ISME Journal, 2009,3(8):916-923.
[31]Ruyters S, Mertens J, Springael D, et al. Stimulated activity of the soil nitrifying community accelerates community adaptation to Zn stress [J]. Soil Biology and Biochemistry, 2010,42(5):766-772.
[32]刘晶静,吴伟祥,丁 颖,等.氨氧化古菌及其在氮循环中的重要作用 [J]. 应用生态学报, 2010,21(8):2154-2160.
[33]Walker C B, De La Torre J R, Klotz M G, et al. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea [J].Proceedings of the National Academy of Sciences, 2010,107(19):8818-8823.
[34]王 峰,刘 易,杨海真.重金属抑制硝化过程的 amoA mRNA作用途径 [J]. 中国环境科学, 2010,30(9):1226-1229.
Impact of long-term heavy metals pollution on ammonia oxidizing microbial community in an iron mine soil.
HONG Chen1, XING Yi1,2*, SI Yan-xiao1,2, LI Yang1(1.Civil and Environmental Engineering School, University of Science and Technology Beijing, Beijing 100083, China;2.Key Laboratory of High Efficiency Mining and Safety for Metal Mine, Ministry of Education, University of Science and Technology Beijing, Beijing 100083, China). China Environmental Science, 2014,34(5):1212~1221
To examine the changes of ammonia-oxidizing microorganisms community in an iron mine of the upstream area of Miyun Reservoir, soil samples were collected from fourteen sites. Quantification of ammonia-oxidizing bacteria(AOB)and archaea (AOA)were performed by real-time PCR, and the microbial community structures were studied by denaturing gradient gel electrophoresis (DGGE). The results showed that the copy numbers per gram of dry soil of AOB changed from 3.01×107to 1.08×109and the copy numbers per gram of dry soil of AOA varied from 8.65×107to 2.69×109.Pearson correlation and the redundancy analysis results showed that heavy metal pollution had changed the abundance and community structure of soil ammonia-oxidizing microorganisms in this iron area. The Cu pollution had a significant inhibitory effect on abundance of AOA (r = -0.653*, P < 0.05), but had no effect on AOB; The Zn pollution had a remarkable effect on AOA/AOB ratio of tailing area (r= -0.606*, P<0.05); Cd pollution changed the AOB community structure and reduced its diversity; The long-term interference of Cr did not change the abundance and community structure of soil ammonia oxidizing microorganisms, but inhibited the ammonia oxidation rate obviously. The results showed that heavy metal pollution affect the circulation of nitrogen in soil ecosystem to a certain extent.
iron metal;archaea (AOA);ammonia-oxidizing bacteria (AOB);DGGE;real-time PCR
X53
A
1000-6923(2014)05-1212-10
2013-08-27
国家自然科学基金(41273091);北京市科技新星计划(Z111106054511043)
* 责任作者, 副教授, xingyi@ustb.edu.cn
洪 晨(1984-),男,河北三河人,北京科技大学博士研究生,研究方向为污泥脱水干化、矿区土壤修复研究.发表论文17篇.

