柚寄生多糖的提取与含量的测定
廖彭莹,邱志彬,卓生华
(广西中医药大学,广西南宁530001)
柚寄生,别名柚树寄生、缘柚寄生等,为桑寄生科槲寄生属植物瘤果槲寄生(Viscum ovalifolium DC.)的带叶茎枝[1]。它可寄生于柚树、黄皮、柿树等多种植物上,主要分布于华南及云南等地[1]。柚寄生是黎族和苗族常用药材,以带短段寄主的全株入药,鲜用或晒干使用[2],味苦、辛,性凉,功能主治为祛风除湿、活血止痛、化痰止咳、解毒[1]。对柚寄生的研究表明,其化学成分类型主要有三萜类、甾醇类、皂苷类、黄酮类,前人已从中分离到羽扇豆醇乙酸酯、羽扇豆醇硬脂酸酯、羽扇豆醇棕榈酸酯、β-香树脂醇、齐墩果酸、常春藤皂苷元、丝石竹酸等小极性成分,还分离到一些极性较大的皂苷类成分,包括常春藤皂苷元-3-O-α-L-吡喃阿拉伯糖苷、常春藤皂苷元-3-O-α-L-吡喃阿拉伯糖基-(2→1)-β-D-吡喃葡萄糖苷、3-O-α-L-吡喃阿拉伯糖基-常春藤皂苷元-28-O-β-D-吡喃葡萄糖基-(1→6)-β-D-吡喃葡萄糖苷[3-4]。有学者测定了柚寄生的总皂苷含量[5]、总蛋白质含量[6]及总黄酮含量[7],结果表明其总皂苷、总蛋白质及总黄酮的含量均较高。本文作者也对柚寄生的总黄酮组分进行了提取工艺和体外活性的初步研究,优选出了总黄酮的较优提取工艺,证明柚寄生的总黄酮组分对人肝癌细胞Hep3B有一定的体外抑制作用[8]。柚寄生的多糖组分鲜有相关报道,多糖是自然界一类重要的生物大分子,是维持生命机体正常运转的基本物质之一,具有多种药理特性,包括免疫调节、抗肿瘤、降血糖、抗氧化、抗疲劳、清除自由基、抗衰老、降血脂、抗菌、抗病毒功能[9]。柚寄生含有多糖组分[10],为进一步深入开发柚寄生药材的利用价值,本研究采用水提醇沉法对柚寄生多糖进行了提取,并对其进行了脱蛋白、脱色等处理,采用红外光谱法对柚寄生多糖的结构进行了初步分析,以葡萄糖为对照品,采用蒽酮-硫酸法测定了柚寄生的多糖含量,为减小误差,采用精制柚寄生多糖测定了柚寄生多糖对葡萄糖的换算因子[11]。
1 材料与仪器
1.1 材料
柚寄生2009年购于广西玉林药材市场,由广西中医药大学韦松基教授鉴定为寄生于柚树的桑寄生科槲寄生属植物瘤果槲寄生(Viscum ovalifolium DC.)的干燥带叶茎枝。药材于60℃烘干至恒重后粉碎,过60目筛。葡萄糖、95%乙醇、浓硫酸、蒽酮、氯仿、正丁醇、石油醚、丙酮、乙醚、无水乙醇均为国产分析纯。
1.2 仪器
电子天平:北京赛多利斯仪器系统有限公司;Agilent 8453型可见-紫外分光光度计:美国安捷伦科技有限公司;NEXUS 470型(FT-IR)傅立叶红外分光光度计:美国尼高力仪器公司。
2 实验方法
2.1 多糖的提取精制
提取精制工艺参照文献[11-14]设计,称取药材粉末约50 g,加入石油醚500 mL回流提取3次,每次2 h,过滤。药渣挥干,再加入80%乙醇500 mL回流提取3次,每次2 h,过滤。药渣挥干,加入 1000 mL蒸馏水煎煮3次,每次1 h。过滤得到水提取液,合并浓缩至约50 mL,得粗多糖溶液。将粗多糖溶液转入分液漏斗中,采用Sevag法除蛋白,加入相当于其1/4体积的氯仿-正丁醇混合溶液(预先配制,体积比为4∶1混合液),充分振摇,取水层,重复以上操作,直至下层无明显乳白色沉淀出现为止。所得水层即为脱去蛋白的多糖溶液,向其中加入活性炭,置于水浴锅中搅拌10 min,抽滤,再向滤液中加入乙醇至其浓度为80%,静置过夜,抽滤,将所得沉淀用丙酮、乙醚、无水乙醇分别进行洗涤,沉淀自然挥干,得到灰色精制多糖0.699 g,置于干燥器中备用。
2.2 多糖的化学检识
用斐林试剂反应和Molish反应对精制多糖进行化学检识,观察反应的颜色变化。
2.3 多糖的红外光谱分析
将所得精制多糖约1 mg与KBr固体粉末在玛瑙研钵中研磨均匀,制成薄片,用红外分光光度计在400 cm-1~ 4000 cm-1波数范围进行扫描,观察出现的红外吸收峰。
2.4 溶液的配制
葡萄糖标准溶液的配制:精密称取葡萄糖对照品0. 0408 g,加蒸馏水溶解,定容于200 mL容量瓶中,配成0.204 mg/mL的葡萄糖标准溶液。
蒽酮-硫酸溶液的配制:精密称取0. 2002 g蒽酮,加入100 mL浓硫酸,混合摇匀,定容于100 mL棕色容量瓶中,置暗处保存。(现配现用)
样品溶液的制备:精密称取药材粉末1 g,加入80%乙醇20 mL回流提取3次,每次1 h,过滤。药渣挥干,加入60 mL蒸馏水于90℃保温提取2次,每次1 h,过滤,用热蒸馏水反复洗药渣并与过滤所得水提取液合并至200 mL容量瓶中,定容,得样品溶液。
2.5 标准曲线的绘制
精密吸取 5、10、15、20、25、30 mL 葡萄糖标准溶液分别置于50 mL容量瓶中,以蒸馏水定容,摇匀,得系列对照品溶液。精密吸取系列对照品溶液各1 mL,置于10 mL具塞试管中,均加入蒽酮-硫酸溶液4 mL,摇匀,冷却,于沸水浴中加热10 min,再于冰水浴中冷却至室温,放置20 min,在626 nm下测定吸光度,另精密吸取1 mL蒸馏水,同法操作,作为空白参比。以吸光度(A)为纵坐标,以系列对照品溶液浓度(C)为横坐标,绘制标准曲线。
2.6 换算因子的测定
精密称取精制多糖100 mg,置于100 mL容量瓶中,加蒸馏水溶解,定容,摇匀,得精制多糖水溶液,从中精密吸取10 mL,置于50 mL容量瓶中,用蒸馏水定容,摇匀,备用(平行制备3份)。精密吸取此液1 mL置于10 mL具塞试管中,按照2.5项下方法测定吸光度,由标准曲线计算溶液中葡萄糖浓度,按下式求出换算因子:f=W/CD,式中:W为称取多糖的重量,mg;C为葡萄糖浓度,(mg/mL);D为稀释倍数。
2.7 多糖含量的测定
按照2.4项下方法制备样品溶液,平行制备3份,各精密吸取1 mL置于10 mL具塞试管中,按照2.5项下方法测定吸光度,由标准曲线折算样品溶液中葡萄糖浓度,按下式计算多糖含量,多糖含量(%)=CDf/W×100,式中:C 为样品溶液中葡萄糖浓度,(mg/mL),D 为稀释倍数;f为换算因子;W为样品重量,mg。
2.8 精密度实验
精密吸取1 mL样品溶液置于10 mL具塞试管中,按照2.5项下方法测定吸光度,重复取样测定5次。
2.9 稳定性实验
精密吸取样品溶液1 mL置于10 mL具塞试管中,按照2.5项下方法测定吸光度,之后每隔20 min测定一次吸光度,考察样品溶液在2 h内的稳定性。
2.10 重现性实验
精密称取5份药材粉末各1 g,按照2.4项下方法制备样品溶液,精密量取样品溶液1 mL置于10 mL具塞试管中,按照2.5项下方法测定吸光度,计算多糖含量。
2.11 加样回收率实验
精密吸取5份已知多糖含量的样品溶液30 mL置于50 mL容量瓶中,分别加入葡萄糖对照品溶液10 mL,用蒸馏水定容,摇匀,再从中精密吸取1 mL置于10 mL具塞试管中,按照2.5项下方法测定吸光度,计算回收率及RSD值。
3 结果与讨论
3.1 多糖的化学检识
精制多糖与斐林试剂反应,现象为生成棕红色沉淀;与Molish试剂反应,现象为放热、生成紫红色环。以上现象说明待测样品含有糖类组分。
3.2 多糖的红外光谱分析
多糖的红外光谱分析见图1。

图1 柚寄生多糖的红外光谱图Fig.1 The IR spectrum of the polysaccharides from Viscum ovalifolium DC.
从红外光谱图中可观察到如下峰: 3413 cm-1出现宽峰,应为多糖-OH的伸缩振动峰,2937 cm-1应为-CH伸缩振动吸收峰,1658 cm-1可能为糖的烯醇式异构引起的吸收峰,1607 cm-1可能为碳碳双键伸缩振动吸收峰,1022 cm-1为C-O伸缩振动吸收峰。由红外谱图可观察到多糖的部分官能团吸收峰,但也有部分非多糖物质引起的红外吸收峰。
3.3 标准曲线的绘制
以吸光度(A)为纵坐标,以系列对照品溶液浓度(C)为横坐标,绘制标准曲线,得线性回归方程A=5. 7545C+0. 0105,相关系数r=0. 9995,线性范围0. 0204 mg/mL~0. 1224 mg/mL。
葡萄糖的标准曲线见图2。
3.4 换算因子的测定
精制多糖的换算因子计算见表1。
由此可得换算因子f=2.276。
3.5 多糖含量的测定
样品溶液的多糖含量计算见表2。
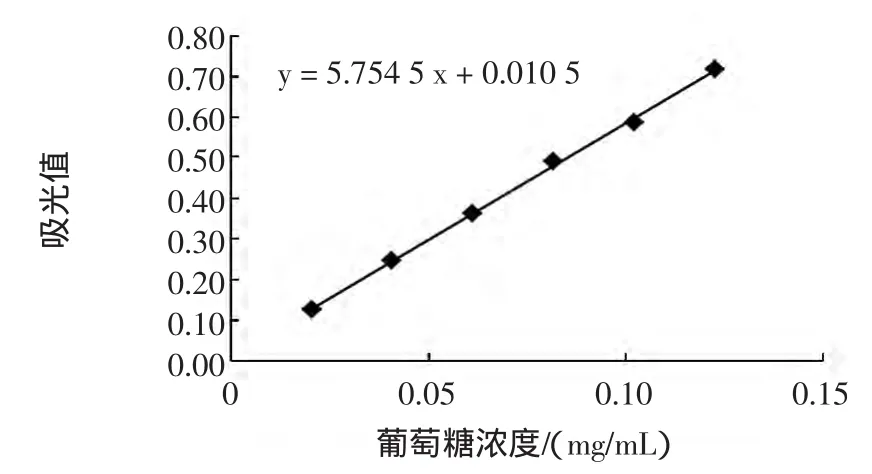
图2 葡萄糖的标准曲线Fig.2 The standard curve of the glucose solution

表1 换算因子的计算结果Table 1 The result of the correct factor

表2 样品溶液的多糖含量Table 2 Determination of the polysaccharides from the sample
测得柚寄生多糖平均含量为3.55%,RSD为2.55%。
3.6 方法学考察结果
样品溶液的精密度、稳定性、重现性、加样回收率考察分见表 3、4、5、6。

表3 样品溶液的精密度测定结果Table 3 Result of precision experiment

表4 样品溶液的稳定性测定结果Table 4 Result of stability experiment

表5 样品溶液的重现性测定结果Table 5 Result of repeatability experiment

表6 加样回收率测定结果Table 6 Result of recovery experiment
表3~表6列出了该含量测定方法的方法学考察结果,从中可以看出,该方法的精密度良好,在2 h内稳定,测定结果重现性良好,加样回收率结果良好。
4 结论
通过水提醇沉法提取了柚寄生多糖,以葡萄糖为对照品,采用蒽酮-硫酸法测定了柚寄生多糖含量,测得其平均含量为3.55%,该含量测定方法的精密度、稳定性、重现性、加样回收率的考察结果均良好,说明该测定方法可靠,可用于柚寄生多糖的含量测定。多糖组成复杂,用葡萄糖标准曲线来折算多糖含量会引起误差,本实验利用精制柚寄生多糖计算柚寄生多糖与葡萄糖的换算因子,以避免这种误差。蒽酮-硫酸加入到样品溶液中会放出热量,在操作时每份样品的冷却时间、加热时间要严格一致,这样才能保证所得结果的准确性。
柚寄生含有类型丰富的化学成分,多糖是其中重要一类,多糖的生物活性多样,有着重要的开发价值。相信通过进一步对柚寄生多糖的生理活性展开研究,能够深入挖掘柚寄生药材的利用价值。
[1] 国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:619
[2] 罗集鹏,张电光.瘤果槲寄生的形态组织和紫外光谱鉴别[J].中药材,2001,24(11):797-800
[3] 杨燕军,林洁红,郭可锦.瘤果槲寄生化学成分的研究[J].广州中医药大学学报,2005,22(2):144-146
[4] 杨燕军,沙聪威,陈梅果.瘤果槲寄生化学成分的研究(II)[J].中国药学杂志,2011,46(1):11-13
[5] 杨燕军,曾瑞琳,沙聪威.瘤果槲寄生中总皂苷的提取和含量测定[J].华西药学杂志,2008,23(5):536-538
[6] 杨燕军,沙聪威,马少丹.改良劳里法测定槲寄生属植物的蛋白质含量[J].药物研究,2008,17(15):13-14
[7] 庞瑞媛,黎建玲.广寄生、瘤果槲寄生总黄酮含量的测定及比较[J].玉林师范学院学报,2008,29(5):67-70
[8] 廖彭莹,卓生华,邱志彬,等.柚寄生总黄酮的提取工艺优化及其体外抑制人肝癌细胞Hep3B作用的初步评价[J].中国实验方剂学杂志,2012,18(23):37-39
[9] 刘春兰.少数民族地区药用植物多糖的化学与药理[M].北京:中央民族大学出版社,2008:11
[10]邵敏敏.柚寄生化学成分与抗炎作用的研究[D].南宁:广西中医药大学,2012:8
[11]张霞,聂少平,李景恩,等.夏枯草中多糖的提取与含量的测定[J].食品研究与开发,2012,33(12):81-85
[12]王霞英,王旭鹏,马月琴,等.宁夏栽培秦艽与野生秦艽有效成分的比较[J].中国实验方剂学杂志,2013,13(9):100-103
[13]赵龙,阮美娟,秦学会,等.蒽酮-硫酸法测定慈姑中多糖的含量[J].食品研究与开发,2009,30(12):118-121
[14]候宝林,王茜,海力茜·陶尔大洪.维药恰麻古儿多糖提取工艺研究及含量测定[J].时珍国医国药,2009,20(11):2759-2761

