花生四烯酸发酵生产技术的发展现状和趋势
陆姝欢,余超,李翔宇,周强,陈祥松 ,张玉良,肖应国 ,汪志明,*
(1.嘉必优生物工程(武汉)有限公司,湖北武汉430073,2.湖北省营养化学品生物合成工程技术研究中心,湖北武汉430223,3.中科院合肥物质科学研究院等离子体物理研究所,安徽合肥230000)
1 花生四烯酸发酵产业发展历史
花生四烯酸(arachidonicacid,ARA),属于 omega-6系列多不饱和脂肪酸,其结构为全顺式-5,8,11,14-二十碳四烯酸,是前列腺素生物合成的起始物之一[1]。花生四烯酸作为人类成长的必需脂肪酸之一,对于人体健康具有重要作用,尤其是对婴幼儿的生长发育具有特殊意义。因此,世界卫生组织(WHO)和联合国粮农组织(FAO)在1995年《脂肪、油脂与人类营养》的联合专家报告中,对花生四烯酸的摄入做出正式推荐。我国卫生部、美国FDA均批准了微生物来源的ARA在功能食品以及婴幼儿配方食品中的应用。目前,全世界已有70多个国家和地区批准在婴幼儿配方食品中添加ARA和DHA。ARA作为食品营养强化剂,推动了国内婴幼儿配方食品的升级换代,提升了国内奶粉行业产品的品质和市场竞争力。
早期的ARA一般从动物肝脏或蛋黄中获得,但其含量非常低(约0.2%,质量分数),无法满足市场需求。有学者发现一些低等真菌能够生产多饱和脂肪酸[2],尤其是毛霉目的真菌,最先尝试利用真菌生产γ-亚麻酸的是在日本[3],上世纪九十年代,美国马泰克公司及日本三得利公司开始研究高山被孢霉发酵生产花生四烯酸。这种经诱变选育后的真菌能代谢并积聚超过40%(w/w)的花生四烯酸于菌丝体中。1995年美国马泰克公司通过发酵法生产得到ARA的产品,使得工业化生产的ARA得以应用[4]。同期,日本三得利公司也获得了被孢霉属微生物油的制备方法[5]。而此时中国的发酵法生产ARA的研究以及生产仍处于空白。1999年,我国卫生部将ARA列为允许使用的营养强化剂的新增品种,正式批准了ARA在婴儿配方食品中的添加。同年,武汉烯王生物工程有限公司率先从中科院引进发酵法生产ARA技术,并在中国实现了ARA项目产业化,填补了我国在这一领域的空白。中国在ARA的产业从无到有,所建湖北工厂目前仍是亚洲最大的ARA单品生产基地。
2 ARA发酵技术现状
近十年来,大量研究工作在高产稳定菌株的获得及发酵工艺优化等领域展开,涉及菌种诱变、培养基优化、发酵工艺改进、发酵前体添加、合成代谢路径等方面。2002年,Yuan等利用离子束注入生物技术对M.alpina进行诱变,筛选到高产菌株I49-N18,并进行了50 t罐发酵试验,ARA产量达到5.11 g/L[6]。余增亮等利用离子束诱变的方法获得高产诱变菌株,并将其发酵生产放大200 t的规模,产量能达到8.97 g/L[7]。Lan等报道了通过添加谷氨酸钠,提高生物量和ARA的产量,并在研究中发现谷氨酸钠增加了G6PDH的活性,提高了戊糖磷酸途径的通量,从而增加NADPH含量,为脂质等的合成提供更多的还原力[8]。Jang等研究发现淀粉、硝酸钾、酵母提取物是最佳的碳氮源,而最佳C/N比为2:1,同时发现添加亚麻籽油可大幅度提高ARA产量[9]。Koizumi等考察了氨基酸的添加对菌丝形态的影响,结果发现添加丙氨酸和缬氨酸可促进M.alpina菌丝增长,而谷氨酸钠则促进菌丝簇核心的形成[10]。Wynn等通过代谢途径研究发现苹果酸脱氢酶催化的反应提供NADPH用来合成脂类;ARA合成的限速步骤是从(18:3 n-6)到(20:3 n-6)的合成[11]。可见通过菌株诱变、改变碳氮源种类、碳氮比或者发酵过程添加离子、氨基酸、不饱和脂肪酸等手段均可在一定程度上提高产率产量。Higashiyama等利用M.alpina 1S-4菌株在10 t的发酵罐上进行发酵生产,生产周期为8d,得到ARA产率为10.9g/L,生产速率为1.36g/L/d[12]。在国内,嘉必优生物工程公司在利用M.alpina I49-N 18发酵生产ARA过程中,通过向发酵培养基中补充添加800 mg/kg~ 1000 mg/kg磷酸盐,600 mg/kg~ 1000 mg/kg谷氨酸钠盐、0.04%~0.12%植物油获得较高产量的ARA,将此工艺放大后,生产周期为7d,得到ARA得率为10g/L[13],这是迄今为止在超大规模工业生产上所报道的最高产量。表1给出了目前有报道的高山被孢霉发酵生产ARA的发酵情况。

表1 高山被孢霉生产ARA发酵产量表Table 1 ARA productivity of M.alpina
尽管在实验室研究出大量的ARA发酵新工艺和新方法,提高了ARA的产量,但在大规模生产上应用仍有较多的限制,如不能获得稳定的产量水平、投入产出比不合理、大规模工艺过程控制难以实现、产品品质下降等,使得这些新工艺新方法难以真正实现工业应用,因此工业化生产ARA的产量并没有取得突破性的提高。要解决这些问题就必须突破传统思维,开发新型生物技术。其中代谢流监控是一个强有力的手段。它是研究生物体在不同环境下代谢物整体动态变化的系统科学,这能为我们打开一个生物体代谢的“总瞰图”。这是一种反向工程手段,能够反向解析被研究对象的生理生化状态与预设环境变化之间的关系[29]。代谢物是细胞调控如生长,分化和防御反应等生理过程的最终产物,它们的水平代表了生物体系对遗传因子或环境因子的最终响应。因此,研究某一过程中代谢水平的动态变化对阐明其生理功能,了解其内部反应机制是非常重要的。通过研究各种外援刺激或外界条件变化等对生物体系的影响,从而从本质上了解生物体对外部培养条件改变所作出的生理性反应,这样就无需照搬实验室所得到的优化条件,而是根据这些高效体系的代谢响应找到关键的代谢节点和调控点,就有可能在生产上实现精细调控,从而ARA产量获得一定程度的提高。近年来已有一部分科学家开始将代谢流监控手段应用于发酵过程的调控中来。Meadows等将代谢流分析手段应用于 1000 L的治疗性重组蛋白发酵体系中,建立了一个大肠杆菌的生长代谢模型,这个模型可用来预测通气或补料等工艺参数改变对代谢及生产的影响[30]。而将GC-MS和PCA等技术应用于高山被孢霉高产菌株的代谢研究也有所报道[31]。然而,目前还未有文献报道将代谢流监控手段应用于生物发酵领域的工业大生产。
此外,ARA发酵过程是一个溶氧需求高、能耗较高的过程,通过模拟计算与反应器内部结构的设计与改造,优化反应器的溶氧供给与能量消耗,可以从全局上提高ARA发酵过程效率,降低单位产量能耗,也是未来工业发展的趋势。
3 ARA提炼工艺发展现状和趋势
提炼工艺也是ARA大工业生产的必要环节,研究者们尝试了多种方法进行了ARA提炼工艺的创新和优化。Tough等研究了实验室用共沸蒸馏法直接提取湿菌体,发现这种工艺相比传统的两步法(菌体冷冻干燥后再提取)更有优势[32]。朱敏等研究了菌体湿度对传统的Bligh&Dyer工艺的提取得率的影响,并报导高山被孢霉湿菌体及干菌体的提取得率分别为27.6%及41.1%[33]。2010年,Catchpole等使用近临界二甲醚萃取经冷冻干燥的菌体,能得到30%的提取得率(相对于超临界二氧化碳的23%)且用量比超临界二氧化碳要少[34]。以上研究均为实验室规模,但是其高山被孢霉提取研究所得到的结果并不理想,且不经济,难以应用于工业生产。2011年南京工业大学尤江英等,研究多种酶组合水解高山被孢霉菌丝体,在实验室中获得了超过100%的提取得率,远高于此前的报导[35],该成果尚待应用于生产。
然而,关于从菌丝体中提取及精炼油脂的研究并不深入,而且在油脂工业发展的初期,各工序都分开操作,一种工序只寻求达到自身最佳性能而极少考虑它对后续工序造成的影响。如油料干燥工序,如果只考虑自身处理能力达到最大,使用极高的温度烘干油料,会对后续加工中油脂的质量带来极坏的影响。近年来加强了把各自孤立的工序转变为全过程工艺关联协调的措施,从原料到餐桌产生更加完善的增值产品。在此转变中,各操作工序相互关联,各单一工序必须考虑它对整个加工的影响,同时每一个工序的作用都延伸到其他工序。传统的植物油工业由此步入更加科学、更加协作的时代。微生物油脂诞生以来,以其高科技、不可替代性迅速占领高端特种油脂市场,也掀起了一股发酵研究热潮,以追求最高发酵得率为终极目标。但也因此可能犯了早期油脂工业的一个错误——忽视了发酵工序对后续工序的影响。我们最终要得到的是发酵菌体细胞内包含的油脂,而非菌体本身。关于酶解油料植物(或微生物)获得细胞内含物(油脂或其他代谢物)有许多报导,间接证明了细胞形态、细胞壁结构对提取效率的巨大影响。因此,发酵调控、菌丝生长环境变化可能会显著改变菌体的宏观形态(如聚集状态)及微观结构(如细胞壁组成及结构),从而在相同的提取工艺下,得到较高的提取得率。嘉必优公司在这方面的研究有实际的体会:在早期小规模发酵中,虽发酵得率不算高,但非常容易提取油脂,常规的提取工艺就能达到90%或更高的得率;而当发酵规模扩大数倍,且经过调控达到更高的发酵得率后,所得干菌体非常难以浸出,提取工艺不断改进,仍与原来水平相差至少5个百分点。因此有必要将发酵工艺与提取工艺结合起来,通过代谢流监控来寻找关键控制点,从而稳定菌体发酵形态和细胞壁结构,为提取工艺提供最适浸出菌体。
此外,还应考虑其他先进技术在提炼工艺中的综合应用。目前提炼ARA油脂的方法主要有传统的菌体冷冻干燥后再提取的两步法、共沸蒸馏法直接提取湿菌体、Bligh&Dyer法、超临界二氧化碳萃取和近临界二甲醚萃取等。但是以上实验室规模的高山被孢霉提取研究所得到的结果并不理想,且不经济,难以应用于工业生产。在工业生产规模上,由于微生物细胞壁的特性,几乎无法使用机械榨取方法获得ARA油脂,一般采用的是传统的溶剂浸出法。工艺上可分为单批浸出、罐组逆流浸出及连续逆流浸出等,效率逐步提高。但考虑到大部分ARA生产厂商产量并不大,效率最高的连续逆流浸出工艺由于设备过于庞大而并不适用。
浸泡过滤后得到混合油,需从中脱去溶剂才能得到ARA毛油。此脱溶操作占据了浸出成本的大部分,因为需要给大量溶剂升温使其蒸发。在国内,一部分厂商使用丁烷代替己烷,因为丁烷有更低的沸点更容易从毛油中脱除,但也因为丁烷常温下为气态,有更大的压力,该工艺需要投入耐压等级更高的容器、管路及设备。
4 ARA发酵废弃物处理和利用
ARA发酵生产中产生的大量固液废弃物,如菌体残渣(菌粕)和皂角等,仍具有较大的开发价值。但是,目前的处理手段主要是填埋处理,不仅增加了环境压力,提高了运营成本,也浪费了大量的资源。
目前国际上对发酵工业中菌粕的再利用研究取得了一系列成果。Lee等对赖氨酸的发酵废物进行电渗析处理获得去矿物的饲料和硫酸铵,分别可以用作肥料和动物饲料[36]。Vijayaraghavan等验证了谷氨酸棒杆菌发酵废弃物作为生物吸附剂的可能性[37]。发酵废弃物还能用作燃料、溶剂、塑料和食品等的生产[38]。将发酵菌粕以氮源形式重复进入营养供应环节的实验也取得了一定成果,Ghosh等以新鲜的青霉素湿菌渣为唯一氮源进行青霉素的再发酵,发现发酵144 h,青霉素的效价比对照高出21%;此外青霉素湿菌渣作为氮源发酵后产生的二次菌渣仍能够再次利用,如此反复利用5次,对青霉素效价影响不大[39]。除了能够开发为饲料或肥料,ARA的工业菌粕的开发,还可以考虑内部循环利用的可能性。由于菌粕是提油后的生物质,理论上富含蛋白质、碳水化合物及其他营养物质,而且其营养组成与菌体接近,可以作为酵母粉的替代物为发酵提供足够的氮源和其他营养的补充。此外,菌粕中的残油与其他副产物,如壳聚糖等也可能在发酵过程中获得重复利用和富集,从而提高产量。目前已有菌粕重复利用的研究申请了专利保护[40]。
ARA提炼过程中产生的皂脚因富含大量的磷脂型ARA而有较大的开发价值。与传统的甘油三酯型ARA相比,磷脂型ARA具有更强的抗氧化能力,并可可为婴幼儿大脑及神经发育提供必须的磷脂。目前国内外市场上尚未有磷脂型ARA产品面世,然而分析发现它具有较大的市场潜力。首先,目前在售的蛋黄型磷脂中具有1.8%~2.5%的磷脂型ARA,并将其作为重要营养成分之一进行功能性宣传;其次,与ARA相提并论的多不饱和脂肪酸DHA,已有磷脂型产品,并取得了较好的销售业绩。美国最大的连锁会员制仓储量贩店costco目前在售的DHA产品共有13款,其中有一款“SchiffMegaRedExtra Strength 500 mg Omega-3 Krill Oil,80 Softgels”,因主要成分为磷脂型DHA,其单价显著高于其他DHA产品。因此,磷脂型ARA不但具有较强的市场潜力,其附加值也更具吸引力。在增加经济效益的同时,还能降低排废压力,构建环境优化的绿色制造体系。
5 ARA国内外专利申请和授权现状
目前我国ARA产业在知识产权保护方面任重而道远,迄今为止,仍未形成足够的力量突破相关的知识产权壁垒,这不但与国际专利申请数量大,力度强有关,也同中国厂商在行业发展前期对知识产权的重要性认识不足有关系。图1给出了ARA相关专利申请量的年份增长情况。

图1 ARA相关专利申请趋势Fig.1 Trend analysis on patent applications of ARA
图1可以看出中国最早的ARA相关专利诞生于1988年,是默里尔多药物公司所申请的“氟化花生四烯酸衍生物”,其目的是药物应用以治疗某些疾病。2000年以前,ARA相关的专利申请增长比较缓慢,ARA技术及相关产业在国内也处于萌芽期。在此期间申请的专利,主要涉及生产制造ARA的工艺,例如发酵,提炼,包埋等,另有部分专利涉及药品、饲料方面的应用。从2001年开始,随着中国入世、ARA生产工艺的改进及应用领域的扩展,其专利的增长速度明显加快,此期间的专利主要涉及ARA产品的制造工艺的改进以及ARA产品在药品、营养品及婴幼儿产品方面的应用。
在全球范围内,花生四烯酸领域申请专利最多的三家企业分别为三得利、帝斯曼(DSM)及雀巢,其专利遍布中国、美国、欧洲、澳大利亚、加拿大和日本等国家,涉及到基因、菌种、发酵、提取、新剂型及应用等多个领域。见图2。
从图2可以看出,ARA专利拥有量前十的申请人中,外资企业有8家,国内仅有南京工业大学和蒙牛2家,且排名靠后。整体来看,在ARA领域,外资企业占据技术的主导地位。特别的,DSM公司在2010年完成对马泰克公司的收购后,无论是技术上还是市场占有率,均为本行业的领导者。
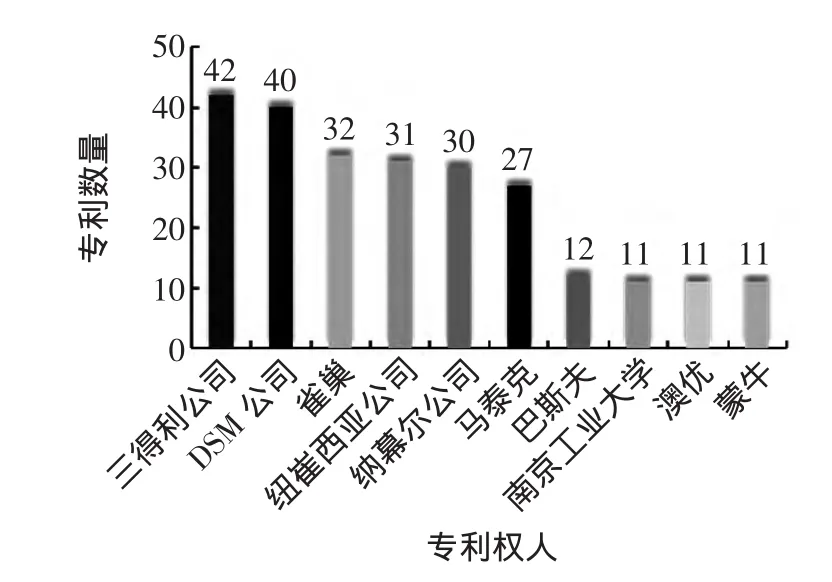
图2 专利拥有数量排名前10位的机构Fig.2 The top 10 institutions according to the number of patent applications
大量的专利构成了我国产品进入国际市场的非关税壁垒,严重影响了国内企业在这个领域的国际竞争力。国内企业必须通过关键技术的创新和突破,制定相应的全球知识产权战略,增强企业的自主创新能力,才能突破知识产权壁垒,实现全球化的目标。当前国际竞争中,知识产权的竞争已经对产品国际化产生决定性的影响。我国花生四烯酸产业在国际化的道路上,始终受知识产权的局限,未能全面突破国际市场,这是我国自主研发技术未注重知识产权保护工作的切肤之痛。因此,实现全面的核心关键技术突破和建立完善的知识产权体系,在国际上进行知识产权的战略布局,是我国花生四烯酸产业扫除知识产权障碍,走上国际化竞争舞台的现实需求。
6 结语
综上,我国花生四烯酸发酵生产技术和产业实践已经过了20余年的发展,已经初具规模,在生产工艺和技术流程等方面也形成了大量的行业标准。然而面对日益增长的市场需求,对众多以发酵技术为基础的ARA生产厂家而言,都面临着一个急需解决的问题:如何进一步优化发酵过程,实现高效和稳定的生产。而在以高产和稳产目标为导向的发酵技术研究过程中,从分子水平深入理解工业化生产过程中高山被孢霉的代谢变化规律已经成为可能,这项技术在发酵工艺上的突破和推广将对整个产业产生深远影响,包括发酵效能的提高、过程可控性加强、产率的稳定性提升,以致废弃物及污水排放的减少等,这些工作在生物发酵技术的发展中具有里程碑意义。完成花生四烯酸发酵生产关键技术的创新,将为多不饱和脂肪酸类产品的开发和制造提供共性技术支持,是未来多不饱和脂肪酸系列产品的开发和国际化竞争提前布局的战略需求。也是工业生物技术领域开创战略性新兴产业提供前沿关键技术的前瞻性需求。
[1] Gill I,Valivety R.Polyunsaturated fatty acids,part 1:occurrence,biological activities and applications [J].Trends in Biotechnology,1997,15(10):401-409
[2] Yongmanitchai W,Ward O.Omega-3 fatty acids:alternative sources of production[J].Process biochemistry,1989,24(4):117-125
[3] Suzuki O,Yokochi T,Yamashina T.Studies on production of lipids in fungi(II).Lipid compositions of six species of Mucorales in Zygomycetes[J].J Jpn Oil Chem Soc,1981,30:863-868
[4] Kyle D J.Arachidonic acid and methods for the production and use thereof,US19950367881[P/OL].1997
[5] Akira H K A K S.Production of oil and fat containing unsaturated fatty acid,JP19960230210[P/OL].1996
[6] Yuan C,Wang J,Shang Y,et al.Production of Arachidonic Acid by Mortierella alpina I~4~9-N~1~8[J].Food Technology and Biotechnology,2002,40(4):311-316
[7] 余增亮,王纪,袁成凌,等.微生物油脂花生四烯酸产生菌离子束诱变和发酵调控[J].科学通报,2012,57(11):883-890
[8] Lan W Z,Qin W M,Yu L J.Effect of glutamate on arachidonic acid production from Mortierella alpina[J].Letters in applied microbiology,2002,35(4):357-360
[9] Jang H-D,Lin Y-Y,Yang S-S.Effect of culture media and conditions on polyunsaturated fatty acids production by Mortierella alpina[J].Bioresource technology,2005,96(15):1633-1644
[10]Koizumi K,Higashiyama K,Park E.Effects of amino acid on morphological development and nucleus formation of arachidonic acid‐producing filamentous micro‐organism,Mortierella alpina[J].Journal of applied microbiology,2006,100(4):885-892
[11]Wynn J P,Ratledge C.Evidence that the rate-limiting step for the biosynthesis of arachidonic acid in Mortierella alpina is at the level of the 18:3 to 20:3 elongase[J].Microbiology,2000,146(9):2325-2331
[12]Higashiyama K,Yaguchi T,Akimoto K,et al.Effects of mineral addition on the growth morphology of and arachidonic acid production by Mortierella alpina 1S-4[J].Journal of the American Oil Chemists'Society,1998,75(12):1815-1819
[13]张玉良,汪志明,唐孝鹏.利用被孢霉发酵生产花生四烯酸工艺配方优化研究[J].中国食品添加剂,2012,2):90-97
[14]Totani N,Someya K,Oba K.Industrial production of arachidonic acid by Mortierella[J].Industrial Applications of Single Cell Oils,1992:52-60
[15]Lindberg A-M,Molin G.Effect of temperature and glucose supply on the production of polyunsaturated fatty acids by the fungus Mortierella alpina CBS 343.66 in fermentor cultures[J].Applied microbiology and biotechnology,1993,39(4-5):450-455
[16]Li Z Y,Lu Y,Yadwad V,et al.Process for production of arachidonic acid concentrate by a strain of Mortierella alpina[J].The Canadian Journal of Chemical Engineering,1995,73(1):135-139
[17]Chen H,Chang C,Chen C.Optimization of arachidonic acid production by Mortierella alpina Wuji-H4 isolate[J].Journal of the American Oil Chemists'Society,1997,74(5):569-578
[18]Singh A,Ward O.Production of high yields of arachidonic acid in a fed-batch system by Mortierella alpina ATCC 32222 [J].Applied microbiology and biotechnology,1997,48(1):1-5
[19]Higashiyama K,Yaguchi T,Akimoto K,et al.Enhancement of arachidonic acid production by Mortierella alpina 1S-4[J].Journal of the American Oil Chemists'Society,1998,75(11):1501-1505
[20]Eroshin V,Satroutdinov A,Dedyukhina E,et al.Arachidonic acid production by Mortierella alpina with growth-coupled lipid synthesis[J].Process biochemistry,2000,35(10):1171-1175
[21]Aki T,Nagahata Y,Ishihara K,et al.Production of arachidonic acid by filamentous fungus,Mortierella alliacea strain YN-15[J].Journal of the American Oil Chemists'Society,2001,78(6):599-604
[22]Hwang B-H,Kim J-W,Park C-Y,et al.High-level production of arachidonic acid by fed-batch culture of Mortierella alpina using NH4OH as a nitrogen source and pH control[J].Biotechnology letters,2005,27(10):731-735
[23]Zhu M,Yu L-J,Li W,et al.Optimization of arachidonic acid production by fed-batch culture of Mortierella alpina based on dynamic analysis[J].Enzyme and microbial technology,2006,38(6):735-740
[24]Jin M-J,Huang H,Xiao A-H,et al.A novel two-step fermentation process for improved arachidonic acid production by Mortierella alpina[J].Biotechnology letters,2008,30(6):1087-1091
[25]Jin M-J,Huang H,Xiao A-H,et al.Enhancing arachidonic acid production by Mortierella alpina ME-1 using improved mycelium aging technology[J].Bioprocess and biosystems engineering,2009,32(1):117-122
[26]Peng C,Huang H,Ji X,et al.Effects of n‐Hexadecane Concentration and a Two‐Stage Oxygen Supply Control Strategy on Arachidonic Acid Production by Mortierella Alpina ME‐1 [J].Chemical engineering&technology,2010,33(4):692-697
[27]Peng C,Huang H,Ji X,et al.A temperature-shift strategy for efficient arachidonic acid fermentation by Mortierella alpina in batch culture[J].Biochemical Engineering Journal,2010,53(1):92-96
[28]Zeng Y,Ji X-J,Chang S-M,et al.Improving arachidonic acid accumulation in Mortierella alpina through B-group vitamin addition[J].Bioprocess and biosystems engineering,2012,35(5):683-688
[29]Nicholson J K,Lindon J C.Systems biology:metabonomics[J].Nature,2008,455(7216):1054-1056
[30]Meadows A L,Karnik R,Lam H,et al.Application of dynamic flux balance analysis to an industrial Escherichia coli fermentation[J].Metabolic engineering,2010,12(2):150-156
[31]李若昕,金明杰,彭超,等.主成分分析法在花生四烯酸高产菌株代谢组学研究中的应用[J].食品科学,2008,29(7):247-250
[32]Tough A J,Isabella B L,Beattie J E,et al.Hetero-azeotropic distillation:Combining fungal dehydration and lipid extraction [J].Journal of bioscience and bioengineering,2000,90(1):37-42
[33]Zhu M,Zhou P,Yu L.Extraction of lipids from Mortierella alpina and enrichment of arachidonic acid from the fungal lipids [J].Bioresource technology,2002,84(1):93-95
[34]Catchpole O,Ryan J,Zhu Y,et al.Extraction of lipids from fermentation biomass using near-critical dimethylether[J].The Journal of Supercritical Fluids,2010,53(1):34-41
[35]You J-Y,Peng C,Liu X,et al.Enzymatic hydrolysis and extraction of arachidonic acid rich lipids from Mortierella alpina[J].Bioresource technology,2011,102(10):6088-6094
[36]Lee H J,Oh S J,Moon S H.Recovery of ammonium sulfate from fermentation waste by electrodialysis[J].Water Research,2003,37(5):1091-1099
[37]Vijayaraghavan K,Yun Y S.Utilization of fermentation waste(Corynebacterium glutamicum)for biosorption of Reactive Black 5 from aqueous solution [J].Journal of hazardous materials,2007,141(1):45-52
[38]Ohara H.Biorefinery[J].Applied microbiology and biotechnology,2003,62(5):474-477
[39]Ghosh D,Ganguli B.Production of penicillin with waste mycelium of Penicillium chrysogenum as the sole source of nitrogen[J].Applied microbiology,1961,9(3):252-255
[40]汪志明,唐孝鹏,张玉良.重复利用高山被孢霉菌粕制备花生四烯酸的方法:中国, 200910063369.6[P].2009-10-06

