吡咯喹啉醌二钠对蛋鸡生产性能和鸡蛋胆固醇含量的影响
孙丽敏 张海军 武书庚 岳洪源 王 晶 齐广海
(中国农业科学院饲料研究所,农业部饲料生物技术重点开放实验室,北京 100081)
吡咯喹啉醌(pyrroloquinoline quinone,PQQ)是一种新型氧化还原酶的辅酶,于20世纪70年代末在甲基营养菌被发现。PQQ广泛存在于动植物体内,但动物自身不能合成,肠道微生物合成和外源摄入是动物组织中PQQ的主要来源,外源PQQ对维持动物机体正常生理功能至关重要。被动物摄入后,PQQ在小肠被吸收,经肾脏排出。研究表明,PQQ 具有抗氧化应激[1]、防治肝损伤[2]、调节脂质代谢[3]等功能。日本科学家曾建议将PQQ定义为新型B族维生素,目前将PQQ划归为类维生素。PQQ二钠(PQQ·Na2)已成为美国、加拿大等国家官方承认的膳食组成成分或保健食品。
关于PQQ在畜牧业方面的研究较少。本课题组前期研究表明,将PQQ水溶液均匀喷洒于饲料后饲喂,能增强蛋鸡的抗氧化能力,提高产蛋率(laying rate,LR)并改善蛋品质[4]。维生素 E 是饲料行业广泛使用的抗氧化剂,在改善动物机体抗氧化状态的同时,尚具有调节脂质代谢,降低鹌鹑蛋胆固醇含量的作用[5]。PQQ·Na2作为PQQ的商品形式,可作为添加剂直接添加到动物饲粮中,不需要将PQQ溶于水后再与动物饲粮混合的过程,减小了工作量。关于PQQ·Na2对产蛋鸡脂质代谢和鸡蛋胆固醇含量的影响尚未见报道。因此,本试验旨在研究将PQQ·Na2直接添加到产蛋鸡饲料中,对产蛋鸡生产性能、脂质代谢和抗氧化能力的影响,探究PQQ·Na2降低鸡蛋胆固醇的可能性,并以维生素E为对照,为PQQ·Na2作为新型饲料添加剂提供理论基础。
1 材料与方法
1.1 试验材料
PQQ·Na2由化学合成,纯度 99.9%,为便于均匀混在饲料中,首先用玉米淀粉稀释PQQ·Na2为0.1%的预混剂。PQQ·Na2由上海医学生命科学研究中心有限公司馈赠。
1.2 试验设计及饲粮
试验采用单因子试验设计,选取360只产蛋率和体重相近的23周龄京红1号产蛋鸡,随机分为5组,为1个对照组和4个试验组,每组6个重复,每个重复12只鸡。试验分预试期1周和正试期8周2个阶段。预试期各组均饲喂基础饲粮;正试期,对照组饲喂基础饲粮,试验组分别饲喂在基础饲 粮 基 础 上 添 加 0.08、0.80、1.60 mg/kg PQQ·Na2和100 mg/kg维生素E的饲粮。
基础饲粮参照NRC(2004)和《鸡饲养标准》(NY/T 33—2004),结合京红1号产蛋鸡饲养手册配制。试验采用玉米-豆粕型粉状饲粮,基础饲粮组成及营养水平见表1。
1.3 饲养管理
半开放式鸡舍3层立体笼养,自然光照加人工补光,光照时间16 h/d、强度20 lx,相对湿度50%~90%,纵向负压通风。每天喂料、捡蛋、清粪各2次,每周消毒2次,自由采食和饮水。常规防疫和管理。
1.4 指标测定和方法
1.4.1 生产性能
正试期,每天以重复为单位记录产蛋数和蛋重,计算产蛋率和平均蛋重(average egg weight,AEW)。每2周称剩料,以重复为单位计算平均日采食量(average daily feed intake,ADFI)和料蛋比(the ratio of feed to egg,F/E)。
1.4.2 蛋品质
正试期第28、42和56天,每个重复随机选取接近平均蛋重的鸡蛋3枚,测定蛋品质。蛋壳强度(eggshell strength,ES)、蛋 白 高 度(albumen height,AH)、哈氏单位(Haugh unit,HU)和蛋黄颜色(yolk color,YC)采用以色列ORKA公司生产的系列鸡蛋品质测定仪测定;蛋形指数(egg shape index,ESI)采用日本富士坪公司生产的蛋形指数测定仪测定。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air-dry basis) %
1.4.3 脂质代谢
试验结束,每重复随机选取体重相近的产蛋鸡1只,翅静脉采血,肝素钠抗凝,3 600 r/min离心10 min,制备血浆,-20℃保存备用。屠宰鸡只,摘取左侧肝脏,液氮速冻,-80℃保存。肝脏粗脂肪提取方法参考 Folch等[6],以氯仿-甲醇(v/v,2 ∶1)提取;肝脏总胆固醇(total cholesterol,TC)含量采用市售试剂盒测定。血浆甘油三酯(total triglyceride,TG)、TC、高密度脂蛋白胆固醇(high density lipoprotein,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)含量采用甘油磷酸氧化酶-过氧化物酶(GPO-PAP)酶法测定,试剂盒购自北京北化康泰临床试剂有限公司。
1.4.4 鸡蛋胆固醇含量
试验结束,每重复随机采集鸡蛋3枚,称重,分离蛋黄并称重。
蛋黄相对重量(%)=(蛋黄重/蛋重)×100。
混匀蛋黄,取样用于胆固醇含量的测定。鸡蛋胆固醇含量以蛋黄胆固醇含量(mg/g)和全蛋胆固醇含量(mg/枚)表示[7]。鸡蛋胆固醇含量采用GPO-PAP酶法测定,测定方法参考江均平等[8],以乙醇提取蛋黄粗脂肪后,用市售试剂盒测定,试剂盒购自北京北化康泰临床试剂有限公司。
1.4.5 抗氧化能力
血浆和肝脏的丙二醛(MDA)含量、总超氧化物歧化酶(T-SOD)活性、总抗氧化能力(T-AOC)均采用试剂盒测定,试剂盒购自南京建成生物工程研究所。
1.5 数据统计分析
试验数据以“平均值±标准差”表示。数据采用SPSS 19.0 one-way ANOVA程序进行方差分析,Duncan氏法进行多重比较,P<0.05为差异显著性判断标准。
2 结果与分析
2.1 PQQ·Na2对蛋鸡生产性能的影响
由表2可知,与对照组相比,试验期1~4周,PQQ·Na2对产蛋率无显著影响(P>0.05);7~8周、5~8周和 1~8周 0.80 mg/kg PQQ·Na2组的产蛋率显著高于对照组(P<0.05);100 mg/kg维生素E对产蛋率无显著影响(P>0.05)。试验期3~4周、5~6周、5~8周和 1~8周,0.80 mg/kg PQQ·Na2组产蛋率均显著高于100 mg/kg维生素 E 组(P<0.05)。
与对照组相比,PQQ·Na2对试验期内各阶段的平均蛋重无显著影响(P>0.05);3~4周和5~8周,0.08 mg/kg PQQ·Na2组的平均蛋重显著高于100 mg/kg维生素 E 组(P<0.05)。
试验期1~4周,各组平均日采食量没有显著差异(P>0.05),3~ 4 周,0.80 和 1.60 mg/kg PQQ·Na2组平均日采食量显著高于对照组;试验期5~8周和1~8周,各PQQ·Na2组的平均日采食量均显著高于对照组(P<0.05),与维生素E组没有显著差异(P>0.05)。
PQQ·Na2和维生素E对料蛋比无显著影响(P>0.05)。
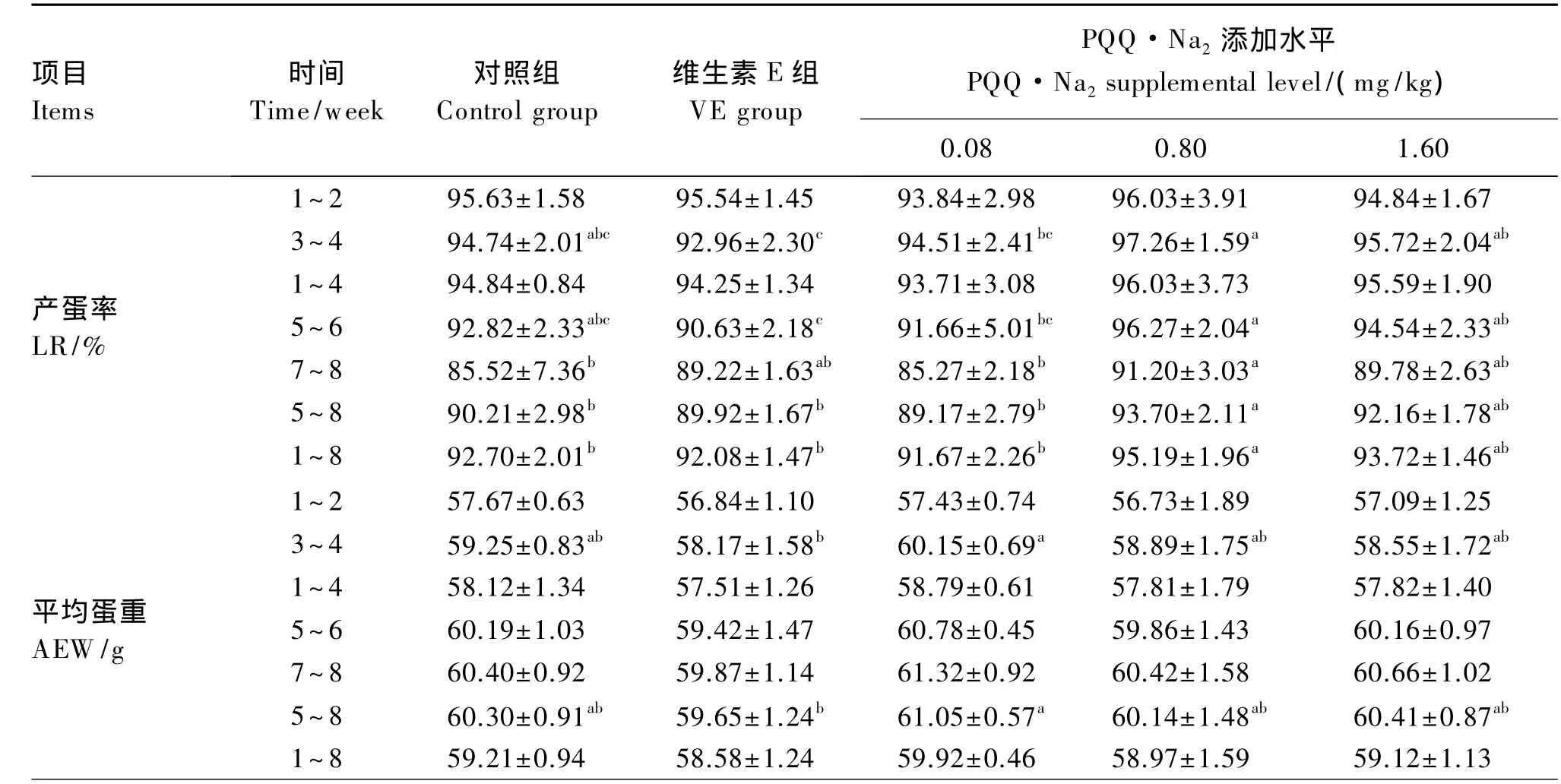
表2 PQQ·Na2对蛋鸡生产性能的影响Table 2 Effects of PQQ·Na2 on performance of laying hens

续表2
2.2 PQQ·Na2对蛋鸡蛋品质的影响
由表3可知,PQQ·Na2和维生素E对蛋形指数、哈氏单位、蛋壳强度和蛋黄颜色无显著影响(P>0.05)。42 d,0.80 mg/kg PQQ·Na2和维生素E组的蛋白高度显著高于对照组(P<0.05),1.60 mg/kg PQQ·Na2组的蛋白高度显著低于维生素 E 组(P<0.05);56 d,1.60 mg/kg PQQ·Na2组的蛋白高度显著高于对照组(P<0.05),各PQQ·Na2组的蛋白高度与维生素E组没有显著差异(P>0.05)。
2.3 PQQ·Na2对蛋鸡脂质代谢和鸡蛋胆固醇含量的影响
与对照组相比,1.60 mg/kg PQQ·Na2和维生素E显著升高血浆TG含量(P<0.05);PQQ·Na2显著升高血浆 HDL-C含量(P<0.05),对 LDL-C含量无显著影响(P>0.05)。与维生素E组相比,0.08 和 0.80 mg/kg PQQ·Na2组血浆 TG 含量显著低于维生素E组(P<0.05);各PQQ·Na2组血浆HDL-C含量均高于维生素E组,且0.08 mg/kg PQQ·Na2差异显著(P<0.05),PQQ·Na2对血浆LDL-C含量的影响与维生素E没有差异(P>0.05)。PQQ·Na2不影响蛋黄相对重量和蛋黄胆固醇含量(P>0.05)。与对照组相比,0.80 mg/kg PQQ·Na2可显著升高肝脏 TC 含量(P<0.05)、显著降低 11.27%血浆和全蛋 TC 含量(P<0.05),与维生素E组没有显著差异(P>0.05)。
2.4 PQQ·Na2对蛋鸡抗氧化能力的影响
与对照组和维生素E组相比,PQQ·Na2有提高血浆 T-SOD 活性的趋势(P>0.05);0.80 mg/kg PQQ·Na2组血浆MDA含量显著低于对照组(P<0.05),与维生素 E 组没有显著差异(P>0.05),1.60 mg/kg PQQ·Na2组MDA含量与对照组无显著差异(P>0.05),但显著高于维生素E组(P<0.05)。与对照组相比,PQQ·Na2能提高肝脏T-SOD活性和 T-AOC,且 0.08 mg/kg PQQ·Na2组差异显著(P<0.05);各 PQQ·Na2组肝脏T-SOD活性与维生素E组均无显著差异(P>0.05),T-AOC活性显著低于维生素 E组(P<0.05);1.60 mg/kg PQQ·Na2组肝脏 MDA 含量显著高于对照组和维生素E组(P<0.05)。
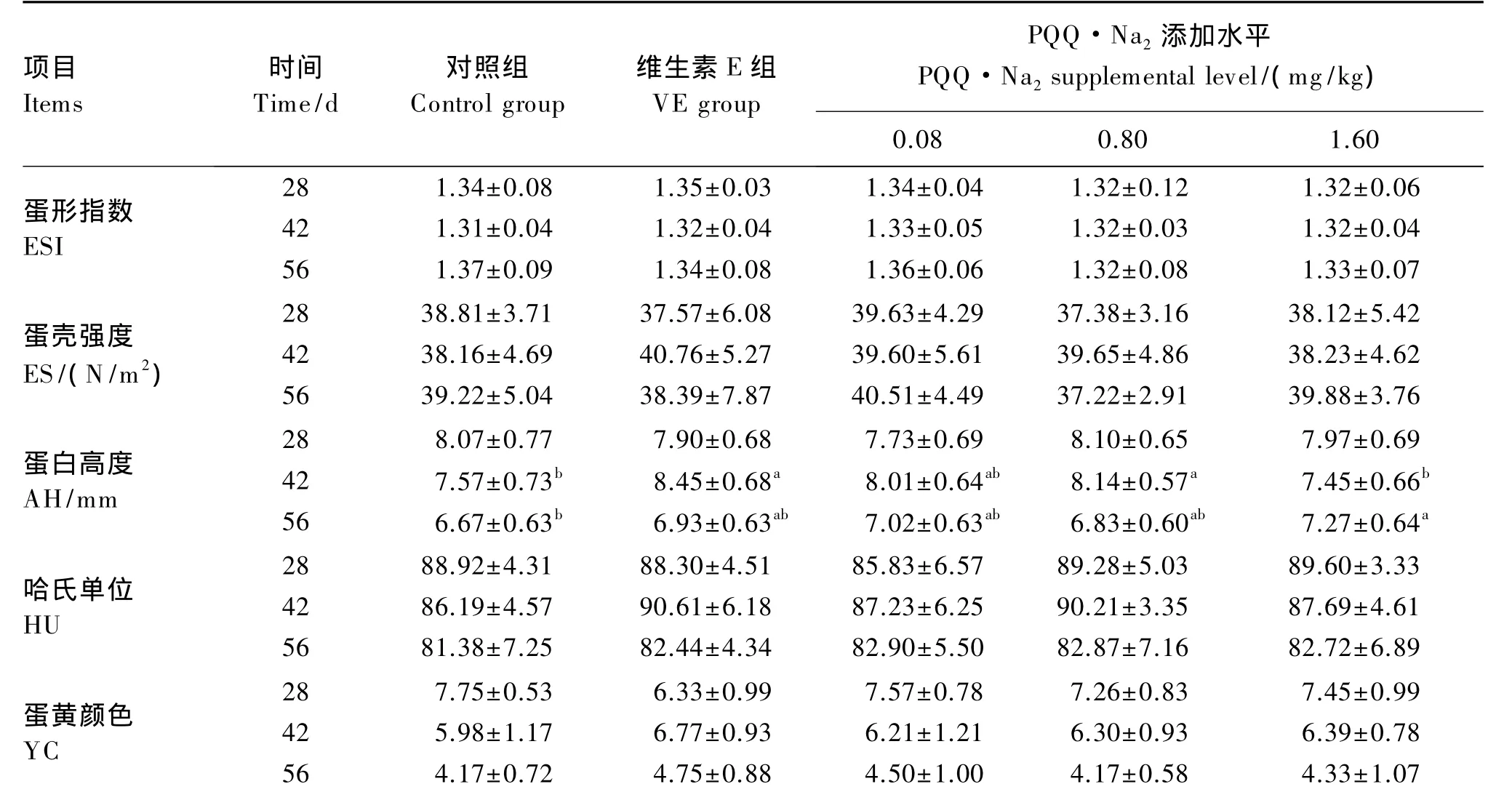
表3 PQQ·Na2对蛋鸡蛋品质的影响Table 3 Effects of PQQ·Na2 on egg quality of laying hens
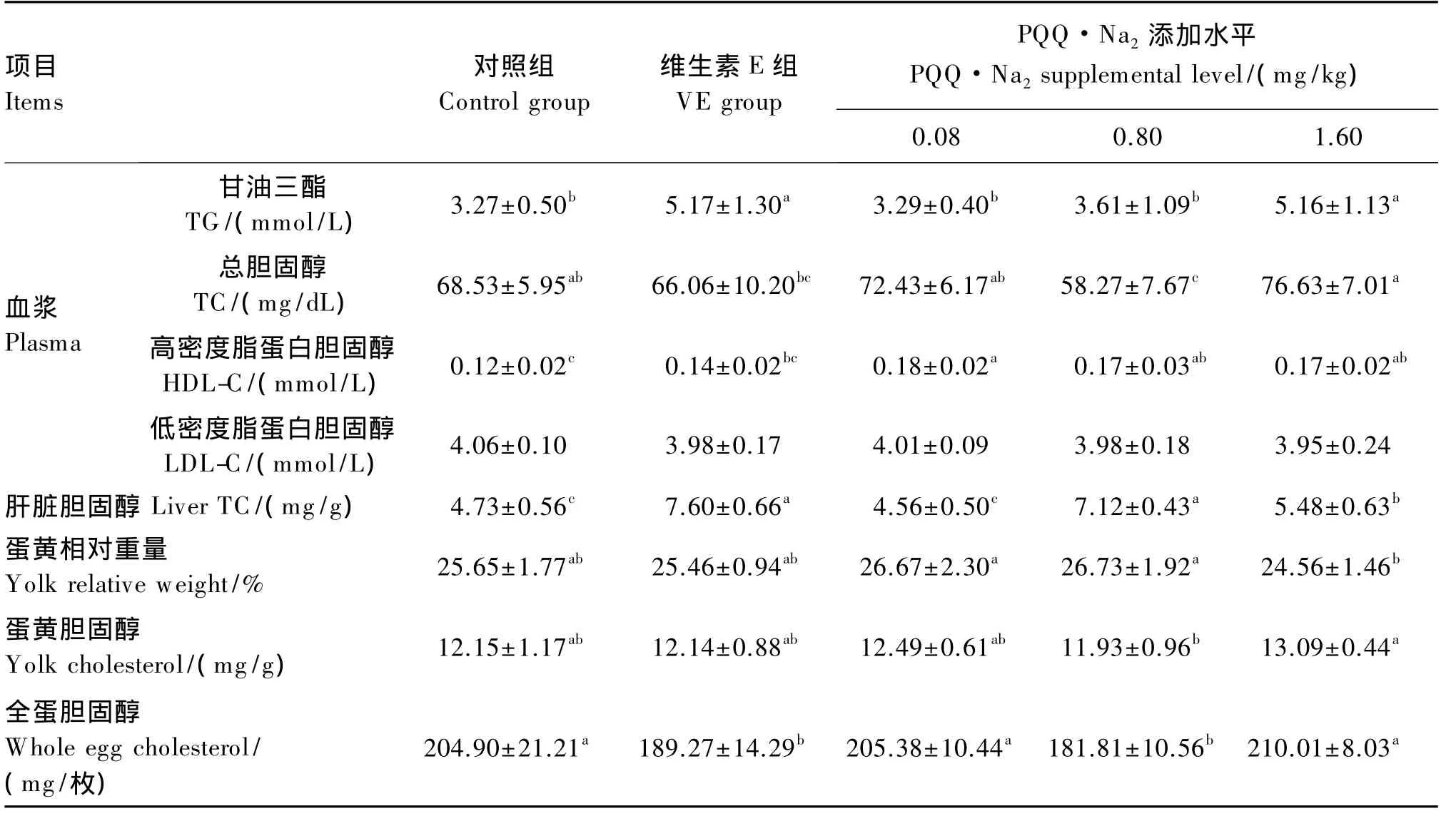
表4 PQQ·Na2对蛋鸡脂质代谢和鸡蛋胆固醇含量的影响Table 4 Effects of PQQ·Na2 on lipid metabolism and egg cholesterol content of laying hens
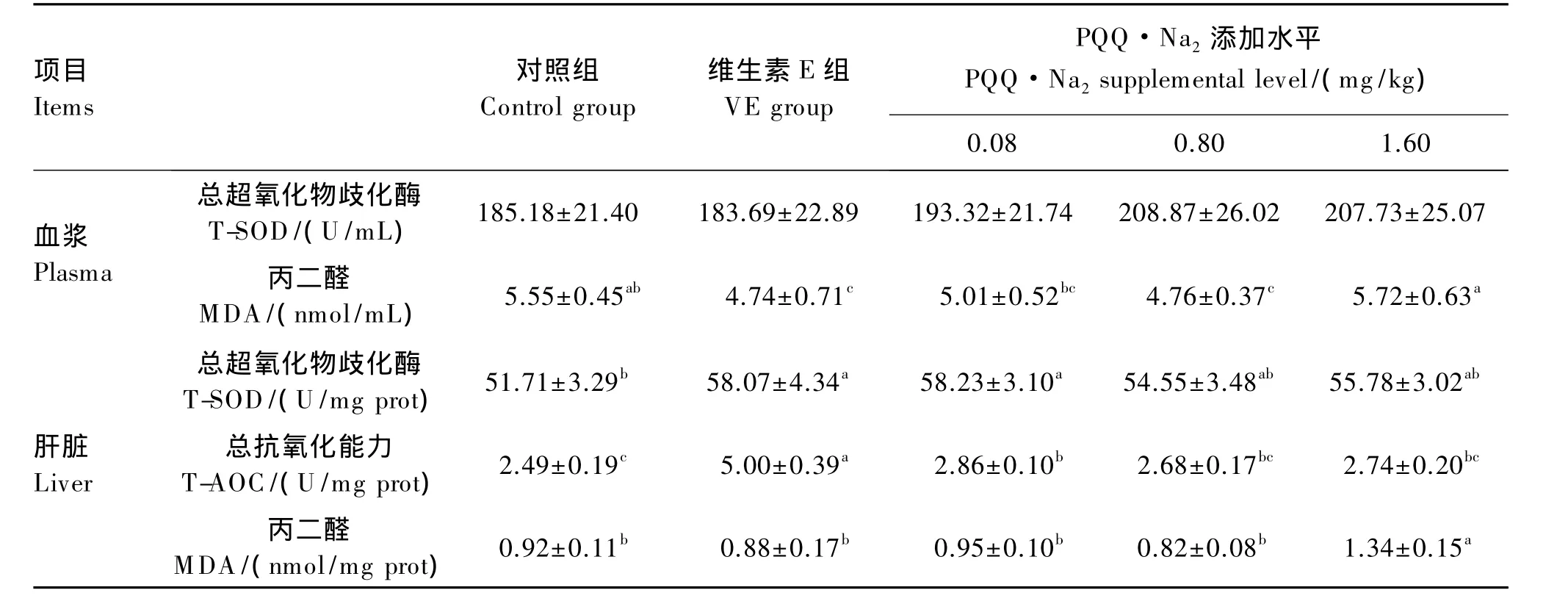
表5 PQQ·Na2对蛋鸡抗氧化能力的影响Table 5 Effects of PQQ·Na2 on antioxidant capacity of laying hens
3 讨 论
3.1 PQQ·Na2对蛋鸡生产性能和鸡蛋品质的影响
本试验表明,饲粮中添加 0.80 mg/kg PQQ·Na2能显著提高蛋鸡产蛋率和平均日采食量,对料蛋比无显著影响。产蛋率的提高可能与PQQ改善动物繁殖机能[9]有关,饲喂不含PQQ的纯合饲粮的鼠生长缓慢,存活率较低,雌鼠产仔数降低。PQQ·Na2可能通过改善蛋鸡生殖系统功能,进而提高产蛋率。蛋鸡产蛋率提高的同时,需要从饲粮中摄入更多的营养物质满足生产需要,引起采食量的增加,采食量和产蛋率同时提高,因而料蛋比无显著变化。本试验中,与对照组相比,维生素E对蛋鸡生产性能无显著影响,与前人研究结果[10-12]相符。0.80 mg/kg PQQ·Na2组产蛋率显著高于维生素E组,表明PQQ·Na2作为蛋鸡饲料添加剂较维生素E具有优越性。本试验结果表明,0.80 和 1.60 mg/kg PQQ·Na2能分别增加42和56 d蛋白高度,改善鸡蛋品质。
3.2 PQQ·Na2对蛋鸡脂质代谢和鸡蛋胆固醇的影响
维生素E对蛋黄相对重量的影响尚无一致结论。前人研究资料有维生素E可显著增加蛋黄相对重量[11,13]和不影响蛋黄相对重量[10]的报道。本试验结果显示,100 mg/kg维生素E对蛋黄相对重量无显著影响,与 Radwan等[10]结果相符。0.08和0.80 mg/kg PQQ·Na2有增加蛋黄相对重量的趋势。研究发现,250 mg/kgα-生育酚盐可显著降低鹌鹑蛋黄中胆固醇含量[5],维生素E可显著降低鸡蛋蛋黄胆固醇含量[14];但也有研究[10,12]结果没有降低。上述研究均采用蛋黄胆固醇含量(mg/g)表述鸡蛋中胆固醇含量。本文中,当以蛋黄胆固醇含量表示时,维生素E不能降低鸡蛋胆固醇含量,与后2项研究结果相符。但当转换为每枚鸡蛋中的胆固醇含量(全蛋胆固醇)时,与对照组相比,维生素E显著降低了鸡蛋胆固醇含量。0.80 mg/kg PQQ·Na2组出现相同效果,且伴随鸡蛋胆固醇含量的降低,出现血浆胆固醇含量降低和肝脏胆固醇含量升高的现象。
鸡蛋胆固醇的含量与蛋鸡品种、鸡龄、饲粮等因素有关。蛋鸡饲粮胆固醇含量一般较低,体内胆固醇主要经内源合成。肝脏和卵巢是主要合成部位,其中肝脏是最活跃的合成部位,也是血液胆固醇的主要来源。蛋鸡体内的胆固醇主要经鸡蛋排出(2/3),此外还通过粪便和胆汁酸代谢途径排出。PQQ·Na2影响蛋鸡胆固醇代谢的原因可能有:1)通过HDL-C介导逆胆固醇转运过程。血液中HDL-C被称为“好”胆固醇,能介导逆胆固醇转运过程[15],将外围组织中胆固醇逆转运至肝脏,经胆汁酸途径排出。本试验中,PQQ·Na2显著升高了血 浆 HDL-C 含 量,0.80 和 1.60 mg/kg PQQ·Na2显著升高了肝脏胆固醇含量,说明PQQ·Na2可能通过增加血液HDL-C含量,促进血液胆固醇逆转运回肝脏,促进胆固醇经胆汁酸途径排出。2)通过激活过氧化物酶体增殖物激活受体-γ共激活因子-1α(PGC-1α)间接调控胆固醇-7-α羟化酶(CYP7A1)的作用。研究表明,PQQ可激活PGC-1α启动子,增加PGC-1α的基因和蛋白质表达[16],而 PGC-1α 可激活 CYP7A1。CYP7A1是催化胆固醇转化为中性胆汁酸的主要酶,体外培养的HepG2细胞在注射表达PGC-1α的重组体腺病毒后,可直接激活CYP7A1基因的表达;在培养细胞的转染分析中,PGC-1α可激活CYP7A1的启动子[17]。PQQ·Na2可能通过增加PGC-1α的表达,进而促进CPY7A1基因的表达,增加胆固醇转化为胆汁酸排出,从而有利于鸡蛋胆固醇含量的降低。然而,本试验中,不同剂量PQQ·Na2对鸡蛋胆固醇含量的影响呈现不规律性。原因可能是低浓度(0.08 mg/kg)PQQ·Na2对蛋鸡体内胆固醇代谢影响较弱,不能表现明显的降鸡蛋胆固醇作用。对于高浓度(1.60 mg/kg)PQQ·Na2组而言,血浆HDL-C含量升高,介导逆胆固醇转运过程,引起肝脏胆固醇含量升高,同时,高浓度PQQ·Na2可能对CPY7A1基因表达影响较大,加速胆汁酸肠肝循环,使以粪便中游离胆盐形式排出的胆固醇增加。但机体为了维持正常的肠肝循环,弥补胆盐损失,肝脏可能通过合成更多的胆固醇以补充随粪便排泄掉的部分,同时多余的胆固醇进入血液和鸡蛋。因此,高浓度PQQ·Na2升高肝脏胆固醇含量的同时,并没有引起血液和鸡蛋胆固醇含量的降低。不同剂量PQQ·Na2对鸡蛋胆固醇含量产生的影响不同,说明PQQ·Na2对鸡蛋胆固醇含量的影响存在剂量关系。本试验中PQQ·Na2梯度设置较少,关于PQQ·Na2对胆固醇代谢的规律性影响,还有待进一步研究。
3.3 PQQ·Na2对蛋鸡抗氧化能力的影响
PQQ具有较强的抗氧化能力,约能参与2万个氧化还原循环而不发生自身氧化或多聚反应。PQQ能降低缺血/再灌注模型下心肌组织[18]内MDA含量的升高,防止高氧应激引起的啮齿动物认知能力的下降[19]。维生素E是饲料行业广泛使用的抗氧化剂,能缓解蛋鸡机体受到的氧化应激[20]。本试验中,与对照组相比,PQQ·Na2和维生素 E不影响血浆 T-SOD活性,0.80 mg/kg PQQ·Na2和100 mg/kg维生素E显著降低了血浆MDA含量;PQQ·Na2和维生素E均能提高肝脏T-SOD活性和T-AOC,显示PQQ·Na2和维生素E均能改善蛋鸡机体抗氧化能力。
本试验中,1.60 mg/kg PQQ·Na2组血浆和肝脏MDA含量均增加,可能与不同条件下PQQ表现出促氧化能力有关[21]。在氧气(O2)存在时,PQQ与还原型辅酶Ⅱ[NAD(P)H]反应,伴随过氧化氢(H2O2)和过氧根离子(O-2)的产生[22],PQQ的过量摄入可能加速活性氧的产生,增加其毒性。本试验中,MDA含量的增加可能因1.60 mg/kg PQQ·Na2含量较高,活性氧产生较多,增加其攻击脂质的可能,增加脂质过氧化物的产生。此外,血浆MDA含量的略微增加也可能由该组血浆胆固醇含量升高所致。肝脏MDA含量增加说明1.60 mg/kg PQQ·Na2可能对蛋鸡机体造成一定程度的负面影响。但以往文献研究表明PQQ·Na2安全性较好:小鼠口服250~2 000 mg/kg体重的PQQ对其红细胞核没有影响[23];体外基因毒性试验表明,PQQ不会引起染色体的变化。给大鼠饲喂2 000 mg/kg体重的PQQ·Na2,未见基因毒性[24]。关于 PQQ·Na2在产蛋鸡上的安全剂量有待进一步研究。
4 结论
①本试验条件下,PQQ·Na2能提高蛋鸡产蛋率,0.80 mg/kg组生产性能优于100 mg/kg维生素E组;PQQ·Na2对鸡蛋品质影响不大,可在一定程度上增加蛋白高度。
②PQQ·Na2可能通过升高蛋鸡血浆HDL-C含量介导逆胆固醇转运,促进胆汁酸途径,有利于降低鸡蛋胆固醇含量。
③PQQ·Na2可增强蛋鸡机体抗氧化能力,降低蛋鸡血浆MDA含量,升高肝脏T-SOD活性和T-AOC。
[1] ZHANG P,XU Y P,SUN JX,et al.Protection of pyrroloquinoline quinone against methylmercury-induced neurotoxicity via reducing oxidative stress[J].Free Radical Rearch,2009,43(3):224-233.
[2] TSUCHIDA T H,YASUYAMA T F,HIGUCHI K H,et al.The protective effect of pyrroloquinoline quinone and its derivatives against carbon tetrachloride-induced liver injury of rats[J].Journal of Gastroenterology and Hepatology,1993,8(4):342-347.
[3] BAUERLY K,HARRIS C,CHOWANADISAI W,et al.Altering pyrroloquinoline quinone nutritional status modulates mitochondrial,lipid,and energy metabolism in rats[J].PLoS One,2011,6(7):e21779.
[4] 徐磊,张海军,武书庚,等.吡咯喹啉醌对蛋鸡生产性能、蛋品质及抗氧化功能的影响[J].动物营养学报,2011,23(8):1370-1377.
[5] SAHIN N,SAHIN K,ONDERCI M,et al.Effects of dietary lycopene and vitamin E on egg production,antioxidant status and cholesterol levels in Japanese quail[J].Asian-Australasian Journal of Animal Sciences,2006,19(2):224-230.
[6] FOLCH J,LEES M,SLOANE STANLEY G H.A simple method for the the isolation and purification of total lipides from animal tissues[J].The Journal of Biological Chemistry,1957,226(1):497-509.
[7] 尹靖东.类黄酮对鸡蛋胆固醇及其氧化物形成的影响[D].博士学位论文.北京:中国农业科学院,2000.
[8] 江均平,蔡丽君,卢卫东,等.利用酶法简捷测定鸡蛋总胆固醇含量研究[J].畜牧与兽医,2010,42(5):37-39.
[9] STEINBERG F,STITES T E,ANDERSON P,et al.Pyrroloquinoline quinone improves growth and reproductive performance in mice fed chemically defined diets[J].Experimental Biology and Medicine,2003,228(2):160-166.
[10] RADWAN NADIA L,HASSAN R A,QOTA E M,et al.Effect of natural antioxidant on oxidative stability of eggs and productive and reproductive performance of laying hens[J].International Journal of Poultry Science,2008,7(2):134-150.
[11] ÇIFTÇI M,ERTAS O N,GÜLER T.Effects of vitamin E and vitamin C dietary supplementation on egg production and egg quality of laying hens exposed to a chronic heat stress[J].Revue de Medecine Veterinaire,2005,156(2):107-111.
[12] MOHITI-ASLI M,SHARIATMADARI F,LOTFOLLAHIAN H,et al.Effects of supplementing layer hen diets with selenium and vitamin E on egg quality,lipid oxidation and fatty acid composition during storage[J].Canadian Journal of Animal Science,2008,88(3):475-483.
[13] QI G H,SIM J S.Natural tocopherol enrichment and its effect in n-3 fatty acid modified chicken eggs[J].Journal of Agricultural and Food Chemistry,1998,46(5):1920-1926.
[14] 元娜.万寿菊提取物和维生素E对鸡蛋品质、抗氧化能力及免疫应答影响的研究[D].硕士学位论文.保定:河北农业大学,2009.
[15] TOTH P P,DAVIDSON M H.Therapeutic interventions targeted at the augmentation of reverse cholesterol transport[J].Current Opinion in Cardiology,2004,19(4):373-379.
[16] CHOWANADISAI W,BAUERLY K A,TCHAPARIAN E,et al.Pyrroloquinoline quinone stimulates mitochondrial biogenesis through cAMP response elementbinding protein phosphorylation and increased PGC-1α expression[J].The Journal of Biological Chemistry,2010,285(1):142-152.
[17] SHIN D J,CAMPOS J A,GIL G,et al.PGC-1αactivates CYP7A1 and bile acid biosynthesis[J].The Journal of Biological Chemistry,2003,278(50):50047-50052.
[18] ZHU B Q,ZHOU H Z,TEERLINK JR,et al.Pyrroloquinoline quinone(PQQ)decreases myocardial infarct size and improves cardiac function in rat models of ischemia and ischemia/reperfusion[J].Cardiovascular Drug and Therapy,2004,18(6):421-431.
[19] OHWADA K,TAKEDA H,YAMAZAKI M,et al.Pyrroloquinoline quinone(PQQ)prevents cognitive deficit caused by oxidative stress in rats[J].Journal of Clinical Biochemistry and Nutrition,2008,42(1):29-34.
[20] SAHIN N,SAHIN K,ONDERCI M.Vitamin E and selenium supplementation to alleviate cold-stress-associated deterioration in egg quality and egg yolk mineral concentrations of Japanese quails[J].Biological Trace Element Research,2003,96(1/2/3):179-189.
[21] ISHII T,AKAGAWA M,NAITO Y,et al.Pro-oxidant action of pyrroloquinoline quinone:characterization of protein oxidative modifications[J].Bioscience,Biotechnology and Biochemistry,2010,74(3):663-666.
[22] SUGIOKA K,NAKANO M,NAITO I,et al.Properties of a coenzyme,pyrroloquinoline quinone:generation of an active oxygen species during a reduction-oxidation cycle in the presence of NAD(P)H and O2[J].Biochimica et Biophysica Acta(BBA):General Subjects,1988,964(2):175-182.
[23] WATANABE A,HOBARA N,OHSAWA T,et al.Nephrotoxicity of pyrroloquinoline quinone in rats[J].Hiroshima Journal of Medical Sciences,1989,38(1):49-51.
[24] NAKANO M,SUZUKI H,IMAMURA T,et al.Genotoxicity of pyrroloquinoline quinone(PQQ)disodium salt(BioPQQTM)[J].Regulatory Toxicology and Pharmacology,2013,67(2):189-197.

