饲粮硝酸钾对湖羊瘤胃硝态氮浓度和瘤胃发酵特性的影响
林 淼 张建刚 王 严 姚文成 赵国琦
(扬州大学动物科学与技术学院,扬州 225009)
反刍动物饲粮氮的来源主要包括真蛋白氮和非蛋白氮,其中非蛋白氮包括硝态氮、胺类、氨化物、氨基酸氮和尿素氮等。硝态氮能够在一定程度上替代尿素和真蛋白质饲料,降低饲养成本。国内外研究表明,反刍动物饲粮中可以用硝酸盐)替代尿素和真蛋白质饲料作为瘤胃氮来源,同时减少甲烷的生成,改变瘤胃发酵模式,提高瘤胃微生物氮合成量[1-7]。由于反刍动物复杂的瘤胃内环境及体外培养法的条件限制,对动物瘤胃发酵特性的影响仍限于模型模拟,且已有的报道结果并不一致,因此该模型尚不能准确代表对瘤胃液pH、氨态氮(NH3-N)产量、挥发性脂肪酸(VFA)浓度、微生物蛋白质产量等影响程度的实际数据;此外,动物采食后,其瘤胃液和亚硝酸盐()浓度随时间的变化趋势仍有待深入研究。为此,本试验旨在通过对湖羊直接饲喂不同水平的硝酸钾(KNO3),采集各时间点的瘤胃液,研究浓度的动态变化规律及其对瘤胃发酵参数、血液指标等的影响,探讨对反刍动物瘤胃代谢的影响,为生产实践中合理有效地添加提供一定参考依据。
1 材料与方法
1.1 试验动物及试验设计
采用单因子试验设计,选取9头体况良好、体重相近[(35.0±3.0)kg]、安装永久性瘤胃瘘管的湖羊,随机分为3组,每组3头,分别饲喂含0(对照组)、0.5%、1.0%KNO3的饲粮。适应期 30 d,之后为3 d采样期。
1.2 试验饲粮及饲养管理

表1 试验饲粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets(DM basis) %
1.3 样品的采集与分析
1.3.1 样品采集及测定指标
适应期内为达到最终添加浓度,采用逐级递增的添加方式,每隔5 d升高1个KNO3的梯度,直至分别保持0.5%、1.0%的添加水平。采样期内分别于晨饲后 0、0.5、1、1.5、2、4、6、8 h 通过真空负压装置,从瘤胃上下左右不同位点采集约30 mL瘤胃液,经4层纱布过滤,立即采用pHS-3C型pH计测定其 pH,之后分装于10 mL离心管中,-20℃冰箱中保存待测其他指标。采样期每日晨饲后2 h,颈静脉采血,分装,一份加入抗凝剂,待测血液高铁血红蛋白浓度;另一份静止30 min,待析出血清时,3 000 r/min离心10 min,吸取上清液,置于-20℃冰箱保存,待测血清生化指标。
1.3.2 指标测定方法
1)NH3-N浓度:采用酚-次氯酸钠比色法[8]。
2)微生物蛋白质浓度:对 Hall等[9]的方法改进,采用差速离心法,取4 mL瘤胃液放入5 mL的离心管中,离心10 min(500 r/min),沉淀为原虫,上清液转移到5 mL离心管中;将装有上清液的5 mL离心管再经过15 min离心(12 000 r/min),沉淀为细菌;然后分别将两者的沉淀加4 mL 10%三氯乙酸(TCA),混合均匀,置室温30 min,沉淀蛋白质;在沉淀中加入4 mL 5%氢氧化钠(NaOH)溶解;离心10 min(4 000 r/min),取上清液;以5%NaOH作空白,用756型紫外分光光度计测定280和260 nm处的吸光度。
计算公式:蛋白质浓度(mg/mL)=(1.45A280-0.74A260)×稀释倍数。
3)VFA浓度:发酵液经10 000 r/min离心10 min,取上清液 1 mL,加 0.2 mL 20%的偏磷酸(含60 mmol/L巴豆酸),10 000 r/min再次离心15 min,取上清液1μL,以巴豆酸为内标物,采用日本岛津GC-14B气相色谱仪测定乙酸、丙酸、丁酸和总挥发性脂肪酸(TVFA)浓度[10]。测定条件:毛细管柱CP-WAX(柱长30 m,内径0.53 mm,膜厚 1 μm);载气为高纯 N2(压力 0.7 MPa,流量30 mL/min);燃气为 H2(流量30 mL/min);气化室温度200℃,火焰离子化检测仪(FID)检测器温度200℃;柱温采用程序升温法,初温100℃,末温130℃,升温速率3℃/min,灵敏度为10,衰减为25。
6)血液指标:血清生化指标由全自动生化分析仪测定;血液高铁血红蛋白浓度按照Benesch等[12]的方法进行。
1.4 统计分析
试验数据采用 Excel软件整理,采用 SPSS 13.0软件的one-way ANOVA进行方差分析,并用Duncan氏法进行差异显著性比较,结果以“平均值±标准差”表示。
2 结果与分析
2.1 湖羊瘤胃液和浓度的动态变化
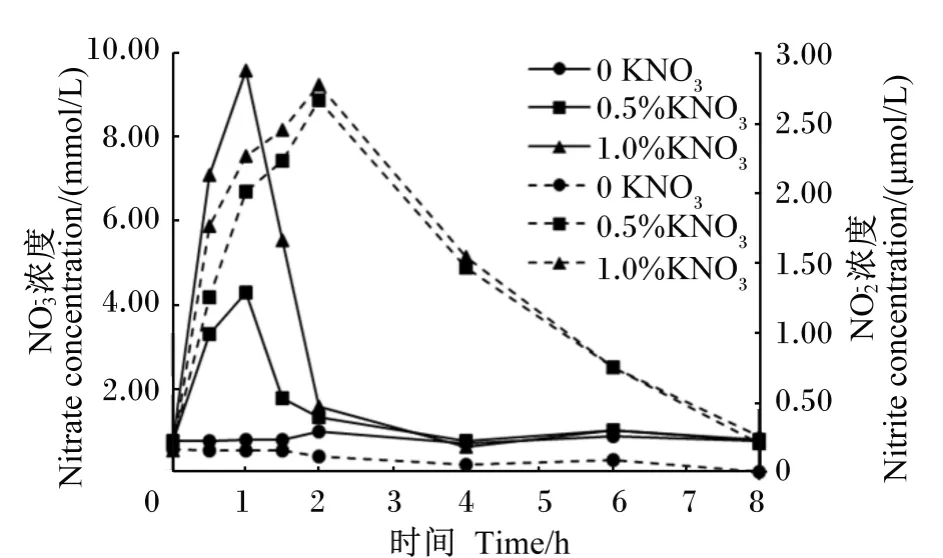
图1 湖羊瘤胃液和浓度的动态变化Fig.1 Dynamic changes of nitrate and nitrite concentrations in rumen fluid of Hu sheep
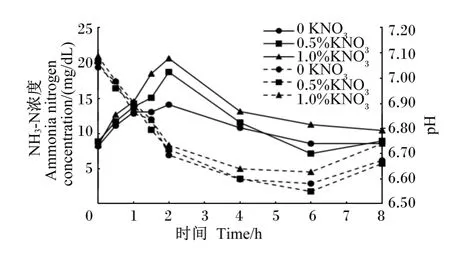
图2 对湖羊瘤胃液p H和NH 3-N浓度的影响Fig.2 Effects of nitrate on pH and NH3-N concentration in rumen fluid of Hu sheep
表2 对湖羊瘤胃液微生物蛋白质浓度的影响Table 2 Effects of nitrate on concentration of microbial protein in rumen fluid of Hu sheep mg/mL
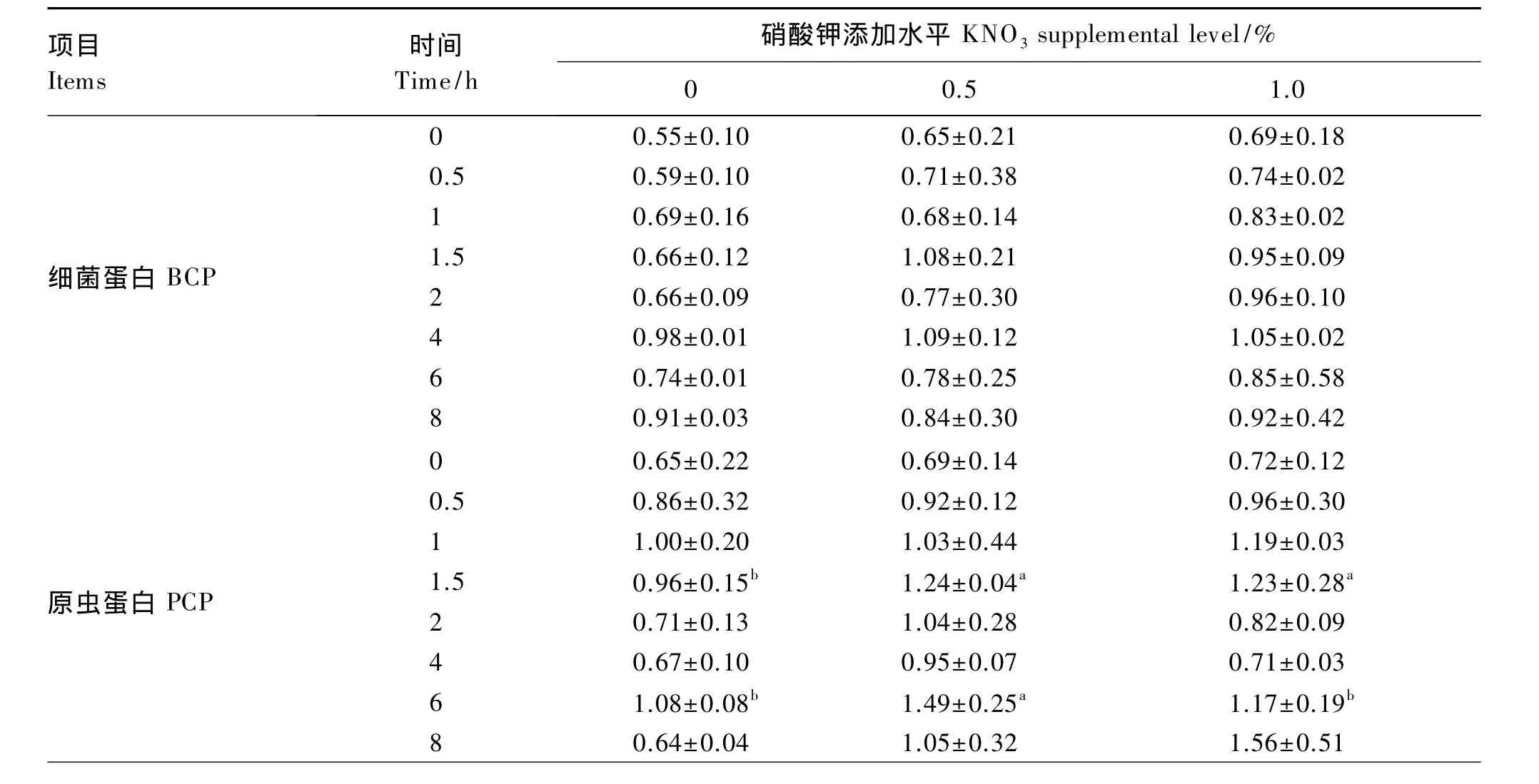
表2 对湖羊瘤胃液微生物蛋白质浓度的影响Table 2 Effects of nitrate on concentration of microbial protein in rumen fluid of Hu sheep mg/mL
项目Items时间Time/h硝酸钾添加水平KNO3supplemental level/%0 0.5 1.0 0细菌蛋白BCP 0.55±0.10 0.65±0.21 0.69±0.18 0.5 0.59±0.10 0.71±0.38 0.74±0.02 1 0.69±0.16 0.68±0.14 0.83±0.02 1.5 0.66±0.12 1.08±0.21 0.95±0.09 2 0.66±0.09 0.77±0.30 0.96±0.10 4 0.98±0.01 1.09±0.12 1.05±0.02 6 0.74±0.01 0.78±0.25 0.85±0.58 8 0.91±0.03 0.84±0.30 0.92±0.42 0原虫蛋白PCP 0.65±0.22 0.69±0.14 0.72±0.12 0.5 0.86±0.32 0.92±0.12 0.96±0.30 1 1.00±0.20 1.03±0.44 1.19±0.03 1.5 0.96±0.15b 1.24±0.04a 1.23±0.28a 2 0.71±0.13 1.04±0.28 0.82±0.09 4 0.67±0.10 0.95±0.07 0.71±0.03 6 1.08±0.08b 1.49±0.25a 1.17±0.19b 8 0.64±0.04 1.05±0.32 1.56±0.51
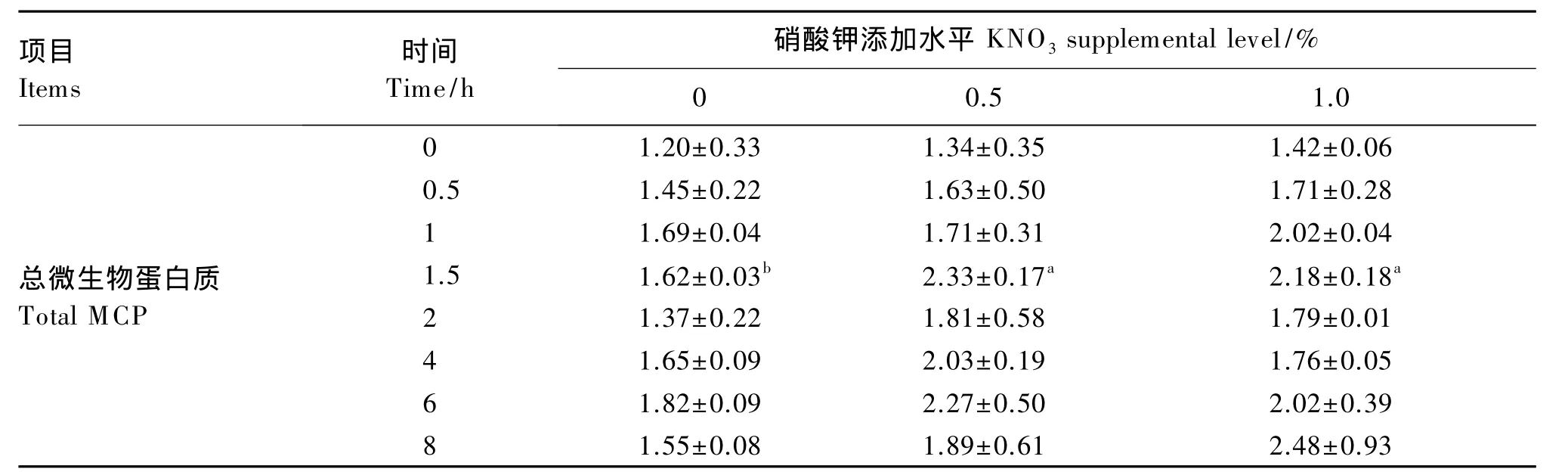
续表2
表3 对湖羊瘤胃液VFA浓度的影响Table 3 Effects of nitrate on concentrations of volatile fatty acids in rumen fluid of Hu sheep

表3 对湖羊瘤胃液VFA浓度的影响Table 3 Effects of nitrate on concentrations of volatile fatty acids in rumen fluid of Hu sheep
项目Items时间Time/h硝酸钾添加水平KNO3supplemental level/%0 0.5 1.0 0 76.98±5.02b 89.05±1.84ab 99.95±10.49总挥发性脂肪酸TVFA/(mmol/L)a 0.5 81.78±6.40 91.68±6.97 98.83±17.96 1 82.91±3.98 90.67±14.09 107.10±2.78 1.5 90.53±4.35 97.48±6.53 113.19±25.65 2 104.91±1.27 115.89±17.80 119.73±24.32 4 91.76±0.66c 116.59±0.83a 109.88±1.77b 6 96.99±0.52 111.97±13.05 103.65±12.95 8 70.37±3.44b 90.72±1.55a 94.28±3.28 0乙酸Acetate/(mmol/L)a 53.33±4.95b 59.96±9.05ab 79.56±6.62a 0.5 59.38±5.50 70.00±5.55 79.96±17.16 1 60.07±1.09b 69.41±10.03ab 82.44±2.20a 1.5 65.92±2.93 73.09±4.77 89.47±20.08 2 76.55±0.72 86.55±11.59 96.10±23.22 4 64.50±0.45b 86.03±0.29a 87.53±3.94a 6 68.66±0.28 82.78±12.44 79.24±11.53 8 50.49±1.41c 66.99±0.25b 75.74±1.19a 0丙酸Propionate/(mmol/L)14.35±0.88 16.83±4.72 14.78±2.92 0.5 13.68±1.12 13.38±0.40 13.67±0.73 1 14.01±0.65 13.57±2.63 16.99±0.32 1.5 14.78±0.16 15.12±1.42 16.61±4.02 2 16.41±0.45 18.27±3.80 16.81±1.21 4 15.76±0.14 18.51±1.04 16.34±1.53 6 16.45±0.09 17.38±1.40 16.82±0.49 8 11.94±0.59 14.07±0.16 13.23±1.48
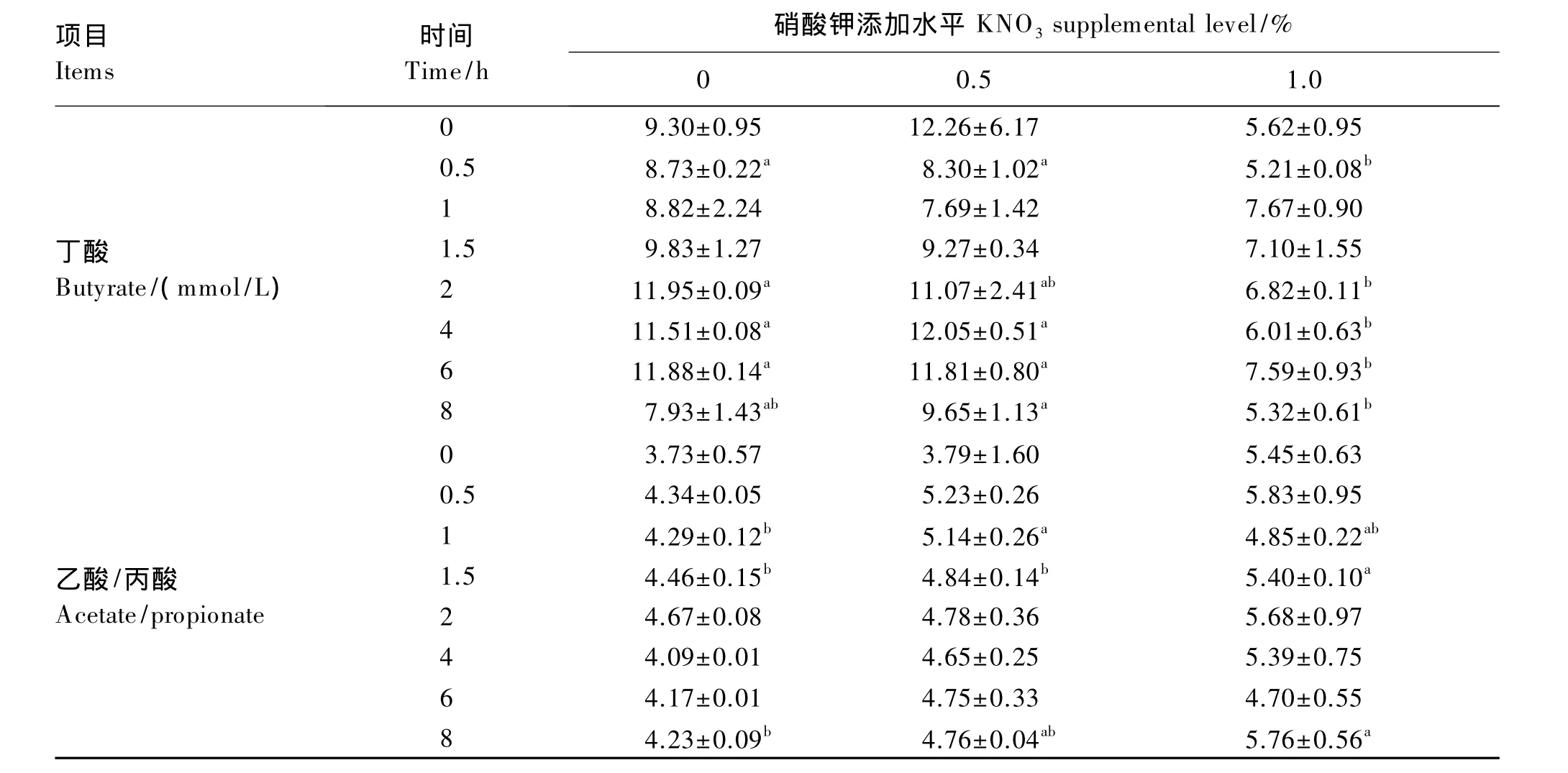
续表3
表4 对湖羊血液指标的影响Table 4 Effects of nitrate on blood indices of Hu sheep

表4 对湖羊血液指标的影响Table 4 Effects of nitrate on blood indices of Hu sheep
项目Items硝酸钾添加水平KNO3supplemental level/%0 0.5 1.0总蛋白TP/(g/L)71.53±4.48 68.30±3.32 71.13±2.40白蛋白 ALB/(g/L) 34.10±3.96 33.68±1.75 34.03±2.39球蛋白 GLB/(g/L) 37.43±3.55 34.63±4.64 37.10±0.56葡萄糖 GLU/(mmol/L) 3.99±0.63 3.89±0.56 4.14±0.05尿素氮 UN/(mmol/L) 5.78±0.80 5.80±0.88 5.47±0.33甘油三酯 TG/(mmol/L) 0.35±0.09 0.21±0.10 0.28±0.07总胆固醇 TCH/(mmol/L) 2.10±0.30 1.94±0.36 1.82±0.40高铁血红蛋白BM/% <0.1 <0.1 <0.1
3 讨论
各组的pH变化在正常范围内(6.55~7.09),喂后2、6、8 h的1.0%组pH显著高于对照组,其他时间点3个组间无显著差异。结果与Guo等[4]类似,但与其他结果不同。Phuc等[14]研究指出,给每头山羊每天饲喂 0、2、4、6 g 的 KNO3,对瘤胃液pH仍无显著影响。代俊芳等[7]通过体外法发现在饲粮中添加含不同比例硝态氮的颗粒料未对瘤胃液pH产生显著影响。Lin等[2,15]比较不同氮源和适应前后的体外瘤胃pH均无显著差异。与前人研究结果不同的可能原因是本试验采用活体研究且添加水平与前人略有不同。
从发酵时间来看,NH3-N浓度的变化主要是由于饲粮中含氮物质不断降解产生氨,导致NH3-N浓度快速上升;之后瘤胃微生物以氨为原料合成细菌蛋白,导致NH3-N浓度逐渐下降。Sar等[16]报道,当绵羊饲粮组成为提摩西草∶苜蓿干草∶精料=400∶400∶200时,按每头绵羊每 kg代谢体重(BW0.75)添加 1.3 g 硝酸钠(NaNO3),也引起了NH3-N浓度的增加。同时,1.0%组显著高于对照组,这与Kemp等[17]研究结果相近。
本试验关于VFA浓度的结果与 Guo等[4]研究结果相近,表明的添加使得瘤胃发酵模式更倾向于乙酸发酵,可能是由于还原过程中改变了瘤胃微生物的某些代谢途径,在一定程度上阻断了乙酸向丙酸合成的过程[12];或者是的快速降解使得电子从丁酸形成转移到还原的方向[2]。但也有报道认为可以提高瘤胃液丙酸和丁酸产量,使发酵模式更倾向于丙酸发酵[6]。差异的原因可能是不同试验中采用的试验方法的添加水平以及动物的耐受程度不同。
本试验中发现各组间血清生化指标差异不显著,说明1.0%的添加水平不影响湖羊的代谢。同时,各组均未检测到高铁血红蛋白浓度(<0.1%),可能是由于添加水平较低。
4 结论
① 在湖羊饲粮中添加KNO3,瘤胃液和浓度分别在1和2 h达到最大值,喂后6~8 h趋近于0。
② 与对照组相比,1.0%组的喂后2、6和8 h的pH显著提高,1、1.5和2 h的氨态氮浓度显著增加;同时,喂后1.5 h原虫蛋白和总微生物蛋白质浓度及喂后4、8 h乙酸和总挥发性脂肪酸的浓度显著提高,喂后 0.5 h、2~6 h丁酸浓度显著降低,瘤胃发酵模式倾向于乙酸发酵。
[1] LENG R A.The potential of feeding nitrate to reduce enteric methane production in ruminants[R]//A report to the department of climate change.Canberra:Commonwealth Government of Australia,2008.
[2] LIN M,SCHAEFER D M,GUO W S,et al.Comparisons of in vitro nitrate reduction,methanogenesis,and fermentation acid profile among rumen Bacterial,protozoal and fungal fractions[J].Asian-Australasian Journal of Animal Sciences,2011,24(4):471-478.
[3] IWAMOTO M,ASANUMA N,HINO T.Ability of Selenomonas ruminantium,Veillonella parvula,and Wolinella succinogenes to reduce nitrate and nitrite with special reference to the suppression of ruminal methanogenesis[J].Anaerobe,2002,8(4):209-215.
[4] GUO W S,SCHAEFER D M,GUO X X,et al.Use of nitrate-nitrogen as a sole dietary nitrogen source to inhibit ruminal methanogenesis and to improve microbial nitrogen synthesis in vitro[J].Asian-Australasian Journal of Animal Science,2009,22(4):542-549.
[5] LI L,SILVEIRA C I,NOLAN J V,et al.Effect of added dietary nitrate and elemental sulfur on wool growth and methane emission of Merino lambs[J].Animal Production Science,2013,53(11):1195-1201.
[6] 郭望山.饲料硝态氮对CP测定的影响及瘤胃微生物区系、发酵特性和阉公羊生产性能对添加硝态氮的反应[D].博士学位论文.北京:中国农业大学,2009.
[7] 代俊芳,孟庆翔,周振明,等.硝态氮添加水平对体外瘤胃发酵和微生物合成效率的影响[J].中国农业科学,2010,43(16):3418-3424.
[8] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6/7):37.
[9] HALL M B,HEREJK C.Differences in yields of microbial crude protein from in vitro fermentation of carbohydrates[J].Journal of Dairy Science,2001,84(11):2486-2493.
[10] WEIMER P J,SHI Y,ODT C L.A segmented gas/liquid delivery system for continuous culture of microorganisms on insoluble substrates and its use for growth of Ruminococcus flavefaciens on cellulose[J].Applied Microbiology and Biotechnology,1991,36(2):178-183.
[11] 罗雪华,蔡秀娟.紫外分光光度法测定蔬菜硝酸盐含量[J].华南热带农业大学学报,2004,10(1):13-16.
[12] BENESCH RUTH E,BENESCH R,YUNG S.Equations for the spectrophotometric analysis of hemoglobin mixtures[J].Analytical Biochemistry,1973,55(1):245-248.
[13] 林淼.硝态氮在瘤胃内的微生物还原特性及其对发酵的影响[D].博士学位论文.北京:中国农业大学,2011.
[14] PHUC H T,QUANG D H,PRESTON T R,et al.Nitrate as a fermentable nitrogen supplement for goats fed forage based diets low in true protein[J/OL].Livestock Research in Rural Development,2009,21(1).http://www.lrrd.org/lrrd21/1/trin21010.htm.
[15] LIN M,SCHAEFER D M,ZHAO G Q,et al.Effects of nitrate adaptation by rumen inocula donors and substrate fiber proportion on in vitro nitrate disappearance,methanogenesis,and rumen fermentation acid[J].Animal:An International Journal of Animal Bioscience,2013,7(7):1099-1105.
[16] SAR C,SANTOSO B,MWENYA B,et al.Manipulation of rumen methanogenesis by the combination of nitrate with beta 1-4 galacto-oligosaccharides or nisin in sheep[J].Animal Feed Science and Technology,2004,115(1/2):129-142.
[17] KEMP A,GEURINK JH,HAALSTRA R T,et al.Nitrate poisoning in cattle,2:changes in nitrite in rumen fluid and methemoglobin formation in blood after high nitrate intake[J].Netherlands Journal of Agricultural Science,1977,25(1):51-62.
[18] MARAIS J P,THERION J J,MACKIE R I,et al.Effect of nitrate and its reduction products on the growth and activity of the rumen microbial population[J].British Journal of Nutrition,1988,59(2):301-313.
[19] SAKTHIVEL P C,KAMRA D N,AGARWAL N,et al.Effect of sodium nitrate and nitrate reducing bacteria on in vitro methane production and fermentation with buffalo rumen liquor[J].Asian-Australasian Journal of Animal Sciences,2012,25(6):812-817.

