掺杂Fe3+改性TiO2光催化降解6-硝废水的研究
袁果园 李 霞 刘德蓉 宿 云 邱会东 冯 建 熊 伟(重庆科技学院 化学化工学院,中国 重庆401331)
0 概述
染料在印染、食品加工等工业生产中使用广泛,已成为各行业大量使用的物质之一[1]。染料废水因具有较高的CODCr和色度,含盐量高,日产量大,有机物难生化降解,目前是我国几种较难治理的行业性废水之一[2]。近年来,随着光催化技术的发展,采用TiO2光催化氧化降解有机废水逐渐被人们所关注[3]。作为光催化剂TiO2只能被波长小于387nm的紫外光激发,而被光激发产生的电子与空穴又容易复合[4]。因此,TiO2光催化氧化降解有机废物的效果受到限制。为了提高TiO2光催化活性,可以采用掺杂改性、染料敏化和贵金属离子沉积等方法改变TiO2的能带结构,拓展光波的吸收范围和降低光电子-空穴复合几率[5-6]。王艳芹等[7]研究发现,掺杂Fe3+的TiO2吸收波长发生转移,扩展了光吸收范围。余锡宾等[8]研究认为,掺杂Fe3+等过渡金属离子,能提高TiO2光量子效率,提高TiO2作为光催化剂的效力。为此,笔者拟将掺杂Fe3+改性TiO2应用于实际染料废水6-硝废水的降解处理,通过实验验证纳米TiO2光催化处理实际废水的可行性,为6-硝废水的工业化降解提供技术指导。
1 实验方法
1.1 掺杂Fe3+改性TiO2催化剂的制备
准确量取一定量的钛酸正丁酯,并依次加入无水乙醇、冰乙酸,搅拌30min分钟,陈化过夜,即可制得均匀透明的TiO2凝胶[9-10]。把凝胶置于烘箱中,干燥制成黄色晶状固体,研磨成粉末状,放入马弗炉中,在一定温度下焙烧5h,即可得到白色粉末状纳米TiO2。取上述纳米TiO2,按乔世俊[11-13]所示方法即可制得掺杂Fe3+改性TiO2催化剂。
1.2 实验和分析方法
1.2.1 废水处理
取一定量6-硝废水置于烧杯中,在不断搅拌下,加入电石渣调节废水pH,加一定量2%的聚铝作絮凝剂,搅拌2-4分钟后缓慢搅拌10min,静止半个小时后抽滤即可。
1.2.2 实验方法
在锥形瓶中加入50ml处理过的6-硝废水,加入一定量掺杂Fe3+改性的TiO2催化剂,加入一定量的H2O2,在400W紫外灯照射下反应。反应结束,抽滤后测定滤液CODCr。
1.2.3 分析方法
CODCr按重铬酸钾法(GB11914-89)测定。
2 实验结果与讨论
2.1 不同焙烧温度制备的改性的纳米TiO2对废水降解率的影响
表1考察了不同焙烧温度下制备掺杂Fe3+改性的TiO2对6-硝废水降解率的影响。结果表明,当焙烧温度为300℃时,6-硝废水CODCr降解率为61.47%。随着制备催化剂时焙烧温度的升高,6-硝废水CODCr降解率增加,当焙烧温度达到500℃时,降解率达到86.73%,但继续升高焙烧温度制得的催化剂,对6-硝废水CODCr的降解率下降。其原因可能是由于不同焙烧温度制得的改性二氧化钛的结晶度、晶粒尺寸与晶相不同,导致光催化性能及影响机理有差异[14]。在通常情况下,锐钛矿相纳米TiO2向金红石相转变的温度为600℃,而转变温度与TiO2颗粒大小和杂质含量及其制备方法有关[15]。颗粒越小,转变温度越低,因此500℃的TiO2主要由锐钛矿相组成,可能含有少量的金红石,而一定比例的混晶具有更高的催化活性。在500℃时,TiO2吸收光达到最大值,增加了对可见光的吸收,提高了光催化效率,因此500℃下焙烧制备得到的改性TiO2具有高的光催化活性。继续增加焙烧温度,锐钛矿相向催化活性降低的金红石相转变,700℃时TiO2含有大部分金红石相,且此时晶粒长大,故催化活性有降低。综上分析,实验选用焙烧温度为500℃时,制备的纳米TiO2作为光催化剂。
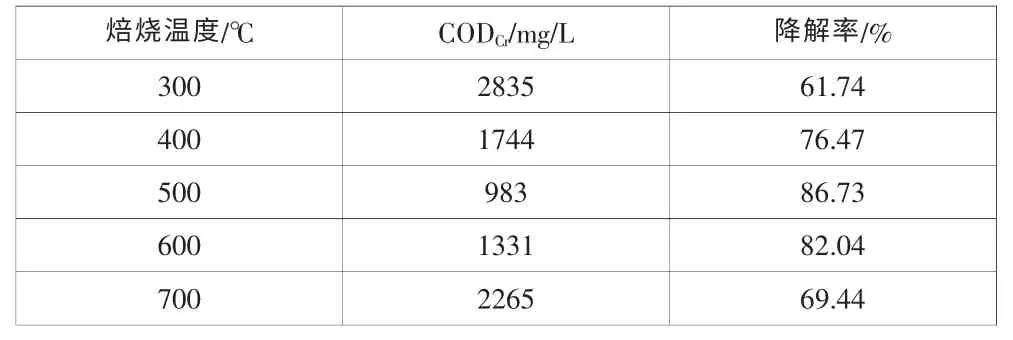
表1 不同焙烧温度制备的纳米TiO2对6-硝废水CODCr降解率的影响
2.2 掺杂不同Fe3+量的纳米TiO2对废水降解率的影响
表2是掺杂不同Fe3+量的纳米TiO2对6-硝废水CODCr降解率的影响。表2的结果表明,未掺杂Fe3+的纳米TiO2对6-硝废水CODCr降解率仅为60.47%,掺杂Fe3+量为0.033wt%时降解率达到71.80%。随着掺杂Fe3+量的增大,改性纳米TiO2对6-硝废水CODCr降解率逐渐增大,掺杂量达到0.100wt%时,6-硝废水CODCr降解率达到最大86.73%。但掺杂Fe3+量的继续增加,降解率逐渐下降,这可能是由于Fe3+的掺入,引起二氧化钛微粒的晶型畸变,形成晶粒微小、晶化度很低的锐钛矿与金红石混相结构,Fe3+掺杂还可以形成氧空位,促使活性·OH基团的形成,导致光催化活性提高[16]。同时,Fe3+特殊的电子结构也有利于半导体光生电子的浅度捕获;这种浅度捕获有利于光生电-空穴对的快速移动并且有效分离,从而提高半导体的量子效率与
催化活性[6]。Fe3+的掺杂有一最佳掺杂比,当掺杂比较小时,半导体没有足够的载流子捕获陷阱,效果不明显;而掺杂比过大时,半导体中捕获位间的距离就会降低,使得电子-空穴对重重新复合的几率增加,还会使Fe3+无法有效地渗入二氧化钛晶格中,将附着二氧化钛离子表面占据活性位,减少了二氧化钛的比表面积,使得降解率降低[17]。综上分析,实验选用掺Fe3+量为0.100wt%的纳米TiO2作为光催化剂。
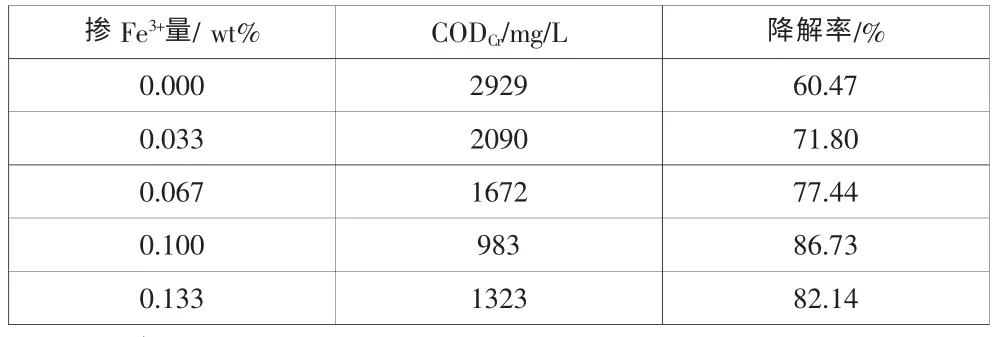
表2 不同Fe3+掺杂量的纳米TiO2对6-硝废水CODCr降解率的影响
2.3 不同催化剂用量对废水降解率的影响
表3考察了不同催化剂用量对6-硝废水CODCr降解率的影响。表3的结果表明,当催化剂用量较小时,光催化活性较差,6-硝废水CODCr降解率为66.96%。随着催化剂用量的增加,可能是催化剂对6-硝废水的吸附量有所增加,表观反应速度加快,降解率上升,当催化剂用量为0.300g时,降解率达到最大86.73%。但当用量继续增加时,光降解效率反而降低,这可能是由于催化剂颗粒为不溶性物质,浓度太高时,会使溶液的浊度增加,TiO2颗粒对光的散射增强,透光度减小,阻挡紫外线的透射深度,导致某些催化剂得不到光照而失去催化活性,无法发挥催化作用,降解率下降。
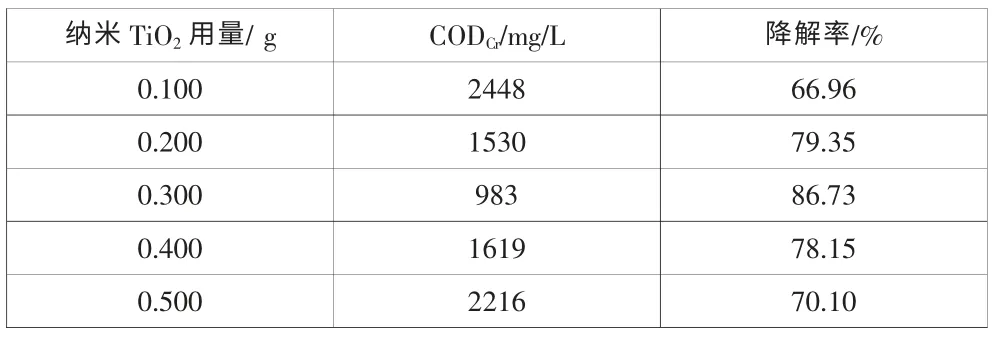
表3 不同催化剂用量对6-硝废水CODCr降解率的影响
2.4 不同H2O2用量对废水降解率的影响
图1考察了不同H2O2用量对6-硝废水CODCr降解率的影响。结果表明,H2O2对光催化6-硝废水的降解率有极大的促进作用,H2O2用量对降解率的影响先增大后减少。H2O2用量在3.0ml增加到4.0ml之间时,6-硝废水CODCr的降解率也随之增加,在投加量为4.0ml时降解率达到最大86.73%,继续增加H2O2的用量,6-硝废水CODCr降解率又呈现降低的趋势。这可能是因为:H2O2不仅可以在紫外光的照射下可以产生·OH,氧化有机污染物,它还是一种电子俘获剂[18],能有效地阻止光生载流子的复合。因此,H2O2的投加量增加时,产生的·OH的数量和捕获电子的能力也随之增加,从而使有机物的降解效率提高。H2O2投加量达到一定程度后发生如下反应[19]:H2O2+OH·→·O2H+H2O,抑制了·OH的产生。另外,H2O2投加量过大会和有机分子在TiO2表面活性位点存在吸附竞争,会削弱有机物的吸附和降解,且吸附H2O2的同时还会消耗一部分表面的空穴,这样就抑制了6-硝废水的降解。
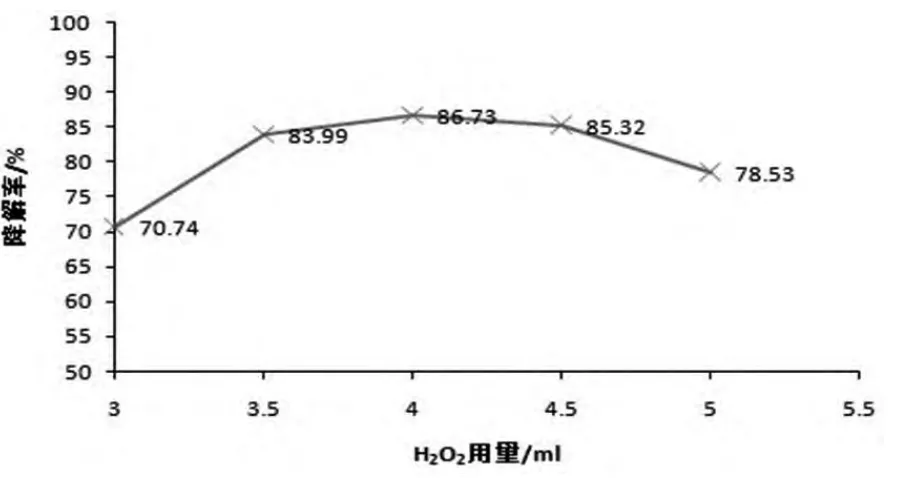
图1 不同H2O2用量对6-硝废水降解率的影响
2.5 废水初始pH值对废水降解率的影响
用电石渣调节6-硝废水的pH值,图2考察不同初始pH值对废水降解率的影响。初始pH值对6-硝废水降解率的影响见图2。从图2可以看出,pH值的影响作用不是很明显,6-硝废水的降解率在pH=2.0时取得了较高的降解率86.73%,随着溶液的pH值升高,降解率逐渐降低,当pH=11时,降解率又随之增大。这可能是因为TiO2表面等电点在6.8左右[20],而当低于此pH值时,催化剂表面带正电性,带负电荷的有机物同催化剂表面由于静电作用而使得有机物的降解速率加快。同理,当溶液的pH值超过TiO2的等电点时,TiO2表面带负电性,此时带正电荷的有机物的降解速率则随pH值的增加而增加。
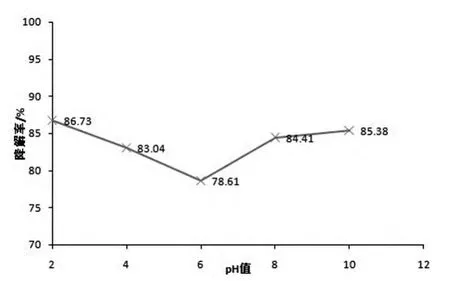
图2 初始pH值对6-硝废水降解率的影响
2.6 光照时间对废水降解率的影响
图3考察了不同光照时间对6-硝废水降解率的影响。从图3可以看出,没有紫外光照射时,6-硝废水降解率很低,而随着光照时间的增加,降解率急剧增大,当时间超过1h后,光降解速率逐渐下降,降解率增加趋于平缓。这是由于随着光催化反应的进行,形成的中间产物逐渐吸附在催化剂TiO2表面,从而使催化剂失活,阻止光催化反应的进行;另外随着6-硝废水被逐渐分解,浓度下降,也使得吸附在TiO2上的污染物浓度下降。6-硝废水在前1.5个小时降解效果已经很好。
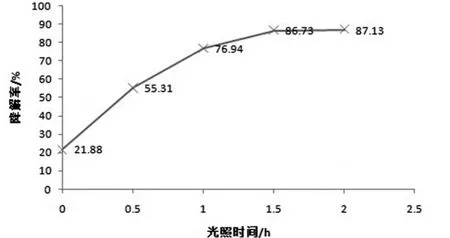
图3 紫外光光照时间对6-硝废水降解率的影响
3 结论
本文采用溶胶—凝胶法制备纳米TiO2,围绕着其在不同条件下对6-硝废水降解效果开展了研究。以钛酸四丁酯为前驱体,采用溶胶—凝胶法制备纯纳米TiO2和掺杂Fe3+改性TiO2催化剂。考察了不同焙烧温度、不同掺杂Fe3+量制得的改性TiO2催化剂、不同废水pH、不同H2O2用量、不同反应时间对6-硝废水降解率的影响。结果表明,掺杂Fe3+量为0.100wt%、焙烧温度为500℃、催化剂用量为0.300g、H2O2用量为4.0ml、废水pH值为2.0、反应时间为1.5h时6-硝废水的降解率达到最大的86.73%。同时本文验证了纳米TiO2光催化处理实际废水是可行的,为掺杂Fe3+改性TiO2光催化降解6-硝废水工业化提供了技术指导。
[1]陈婵维,付忠田,于洪蕾,姜彬慧.染料废水处理技术进展[J]。环境保护与循环经济,2010,04:37-40.
[2]任南琪,周显娇,郭婉茜,杨珊珊.染料废水处理技术研究进展[J].化工学报,2013,01:84-94.
[3]彭书传,王诗生,陈天虎,黄川徽,李辉.负载型TiO2光催化氧化法处理硝基苯酚工业废水[J].工业水处理,2003,11:34-36.
[4]高治国,陈文通,郑琳琳.光催化氧化处理造纸废水的试验研究[J].辽宁化工,2011,03:227-229.
[5]马明远,刘岭松,李佑稷,王小华.铁铈共掺杂TiO2纳米复合体的制备及光催化性能[J].硅酸盐学报,2009,09:1458-1463.
[6]赵德明,金宁人.过渡金属Fe3+离子掺杂改性TiO2的光催化性能研究进展[J].浙江工业大学学报,2005,02:165-169.
[7]王艳芹,程虎民,马季铭.二氧化钛和三氧化二铁复合纳米晶电极的光电化学性质[J].物理化学学报,1999,03:222-227.
[8]余锡宾,王桂华,罗衍庆,陈秀红,朱建.TiO2微粒的掺杂改性与催化活性[J].上海师范大学学报:自然科学版,2000,01:75-82.
[9]肖红艳,史元元,陈衍夏,施亦东.Fe3+/TiO2负载型活性炭的制备及其光催化活性的研究[J].印染,2007,24:9-12.
[10]李英柳,李爱莲,吴凤丽.Fe3+改性TiO2光催化降解甲醛废水试验研究[J].江苏工业学院学报,2006,02:19-21.
[11]李磊,郑立辉,张尊举.Fe3+掺杂TiO2纳米膜的制备及光催化性能的研究[J].环境科学与管理,2009,04:110-112.
[12]乔世俊,赵爱平,徐小莲,赵慧宏,吴仁铭.二氧化钛光催化降解处理氨氮废水[J].环境科学研究,2005,03:43-45.
[13]Tsutomu Hirakawa,Yoshlo Nosaka.Properties of O2-and OH-Formed in TiO2Aqueous Suspensions by Photocatalytic Reaction and the influence of H2O2and Some Ions[M].Lang-muir 2002,18:3247-3254.
[14]李玉生,张俊卿,冯德荣,季祥.微乳液法制备掺杂铁的纳米二氧化钛及其光催化降解苯酚的研究[J].内蒙古石油化工,2006,07:11-14.
[15]宋来洲,张文茂.TiO2纳米膜光催化降解有机污染物的研究[J].燕山大学学报,2003,27(4):327-330.
[16]菅盘铭,夏亚穆,李德宏,王晓燕.掺杂TiO2纳米粉的合成、表征及催化性能研究[J].催化学报,2001,02:161-164.
[17]Zhang Z B,Wang CC,Zakaria R.Role of particle size in nanocatalysts all ine TiO2-based photo catalysts[J].JPhys Chem B,1998,102(52):10871-10878.
[18]曹广秀,马淮凌,姜芳婷,王磊.掺杂Fe2O3纳米TiO2膜光催化降解有机染料废水中甲基橙[J].工业水处理,2006,12:44-47.
[19]刘梅.铁掺杂TiO2光催化剂的制备及其降解有机染料的研究[D].陕西:陕西科技大学,2009:3-4.
[20]孙振世,杨晔,陈英旭,朱松.纳米TiO2薄膜光催化降解2,4-二氯酚的动力学研究[J].环境科学学报,2003,06:716-720.

