红粒小麦粗类黄酮的水浴醇提工艺优化及体外抗氧化研究
郝教敏 李 云 杨珍平 杨 华 朱迎春 孙 敏 高志强
(山西农业大学食品科学与工程学院1,太谷 030801)
(山西农业大学农学院2,太谷 030801)
红粒小麦粗类黄酮的水浴醇提工艺优化及体外抗氧化研究
郝教敏1李 云1杨珍平2杨 华1朱迎春1孙 敏2高志强2
(山西农业大学食品科学与工程学院1,太谷 030801)
(山西农业大学农学院2,太谷 030801)
试验以红粒小麦全麦粉为材料,采用单因素试验与三元二次正交试验,研究其粗类黄酮的水浴醇提工艺及体外清除DPPH·和·OH的能力。结果表明,乙醇浓度、料液比、浸提温度及浸提时间对粗类黄酮得率的影响均符合开口向下的抛物线模型。确定乙醇体积分数为95%,关键参数料液比(X1)、浸提温度(X2)、浸提时间(X3)对粗类黄酮得率的影响符合三元二次回归模型;主效应:X1>X2>X3;交互效应:X1X3>X1X2>X2X3;最优工艺参数:料液比1∶19,66℃浸提107 min,类黄酮得率46.02 mg/g。红粒小麦粗类黄酮对DPPH·的清除率明显大于对·OH的清除率,且随浓度提高,清除率显著提高。研究为红粒小麦深加工提供参考。
小麦 粗类黄酮 水浴醇提 抗氧化能力
1 材料与方法
1.1 材料与设备
1.1.1 原料
小麦(Triticum aestivum L.):山西农业大学农学院育成的高产优质小麦品种“山农129”,籽粒红色。
1.1.2 试剂
二苯代苦味酰肼自由基:美国Sigma公司。
1.1.3 仪器
FZ102型微型植物粉碎机:天津市泰斯特仪器有限公司;WFJ2100型可见分光光度计:尤尼柯上海仪器有限公司;DA7200型品质分析仪:瑞典 Perten公司。
1.2 试验方法
1.2.1 芦丁标准曲线的绘制
[20]。
1.2.2 粗类黄酮的提取和测定
小麦籽粒风干,粉碎,过筛,得全麦粉。取全麦粉2 g于150 mL烧瓶中,加入一定浓度一定剂量的乙醇溶液,封口,摇匀,置于恒温水浴锅水浴浸提一定时间,过滤。取滤液1 mL置于25 mL容量瓶中,按照1.2.1方法测定提取液的吸光值,并计算类黄酮得率[21]。
类黄酮得率/mg/g=提取液中类黄酮的质量/mg/样品质量/g
1.2.3 试验设计
试验设乙醇体积分数(%)、料液比(m∶V)、水浴浸提温度(℃)及浸提时间(min)4个单因素试验(表1)。根据单因素试验结果,确定3个主要影响因素,采用三元二次正交回归设计优化提取工艺。

表1 单因素试验因素与水平
1.2.4 粗类黄酮制取
根据正交优化的最佳条件,冷凝回流浸提粗类黄酮。将浸提液过滤,再次提取,合并滤液,减压浓缩至原体积的1/4左右,加入4倍体积的95%乙醇溶液,4℃过夜静置,抽滤,自然干燥,即得粗类黄酮。
1.2.5 粗类黄酮清除DPPH·能力测定
参照Yamaguchi等[22]的报道略作改进。将粗类黄酮配成20 mg/mL溶液,并作梯度稀释。DPPH·物质的量浓度为0.25mmol/L。在试管中分别加入0.5 mL待测液和0.5 mL DPPH·溶液,充分振摇后放于暗处反应30 min,517 nm处测定吸光值。0.5 mL待测液加等体积的甲醇作样品对照,0.5 mL DPPH·溶液加等体积的甲醇作空白,纯甲醇调零。计算样品对DPPH·的清除能力。
DPPH·清除率 =[1-(Ai-Aj)÷Ac]×100%
式中:Ai为样液与DPPH·试剂混合液的吸光值;Aj为样液与空白溶剂混合液的吸光值;Ac为DPPH·试剂与空白溶剂混合液的吸光值。
1.2.6 粗类黄酮清除·OH能力测定

式中:Ai为样液与水杨酸溶液混合液的吸光值;Aj为样液与空白溶剂混合液的吸光值;Ac为水杨酸溶液与空白溶剂混合液的吸光值。
1.3 数据分析
对所得数据用EXCEL数理统计分析软件整理制表,并采用SAS9.1.3统计分析软件进行方差分析与Duncan’s多重比较,以及 RSREG回归分析、GCONTOUR等值线响应面绘图分析。
2 结果与分析
2.1 单因素试验结果分析
由图1a~图1d可知,4个单因素对红粒小麦粗类黄酮得率的影响均符合开口向下的抛物线模型,且在其他3个因素确定的条件下,另外1个因素对类黄酮得率的影响差异均达到显著水平(P<0.05)。
比较发现,乙醇浓度(图1a)对类黄酮得率的影响的变化幅度最大(3.2~30.4 mg/g),以95%乙醇溶液的得率最高(P<0.05)。这可能是因为类黄酮为醇溶性物质,浸提液中乙醇的比例越高,越利于类黄酮溶出,但无水乙醇会使一些醇溶性杂质及亲脂性成分也溶出,从而降低类黄酮得率。试验中发现,由于小麦籽粒中淀粉含量较高,料液比(图1b)越低,提取过程中越容易糊化,影响类黄酮溶出;以1∶20时的类黄酮得率最高。可能的原因是超过1∶20时,不仅原料内的类黄酮化合物已完全溶出,一些醇溶性杂质及亲脂性成分也可能溶出,影响类黄酮得率。同样,浸提温度<70℃(图1c)或浸提时间<2 h(图1d),都不利于类黄酮的充分溶出;但温度太高或时间太长,则可能会破坏类黄酮的活性结构或加速乙醇溶液蒸发引起糊化,进而降低类黄酮得率。值得注意的是,当浸提时间超过2.5 h后,类黄酮得率没有显著变化(P>0.05),可能此时包括黄酮类化合物在内的醇溶性或亲脂性物质已完全溶出。根据单因素试验,选择乙醇体积分数、料液比、提取温度及提取时间分别为:95%、1∶20、70℃、2 h,进一步工艺优化。
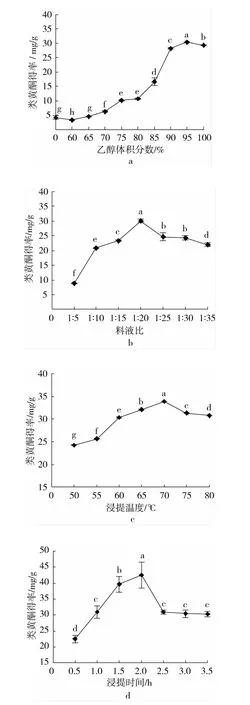
图1 乙醇体积分数、料液比、浸提温度、浸提时间对红粒小麦类黄酮得率的影响
2.2 正交回归试验结果分析
确定乙醇浓度为95%,采用三元二次正交设计,分析料液比(X1)、提取温度(X2)、提取时间(X3)及其交互作用对红粒小麦粗类黄酮得率的影响,并获得最佳提取工艺。三元二次正交因素水平见表2,正交结果见表3。
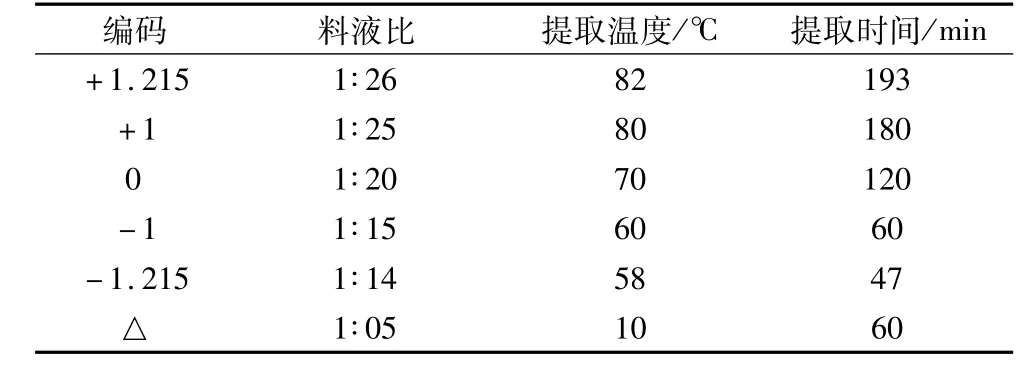
表2 三因素二次正交因素水平编码
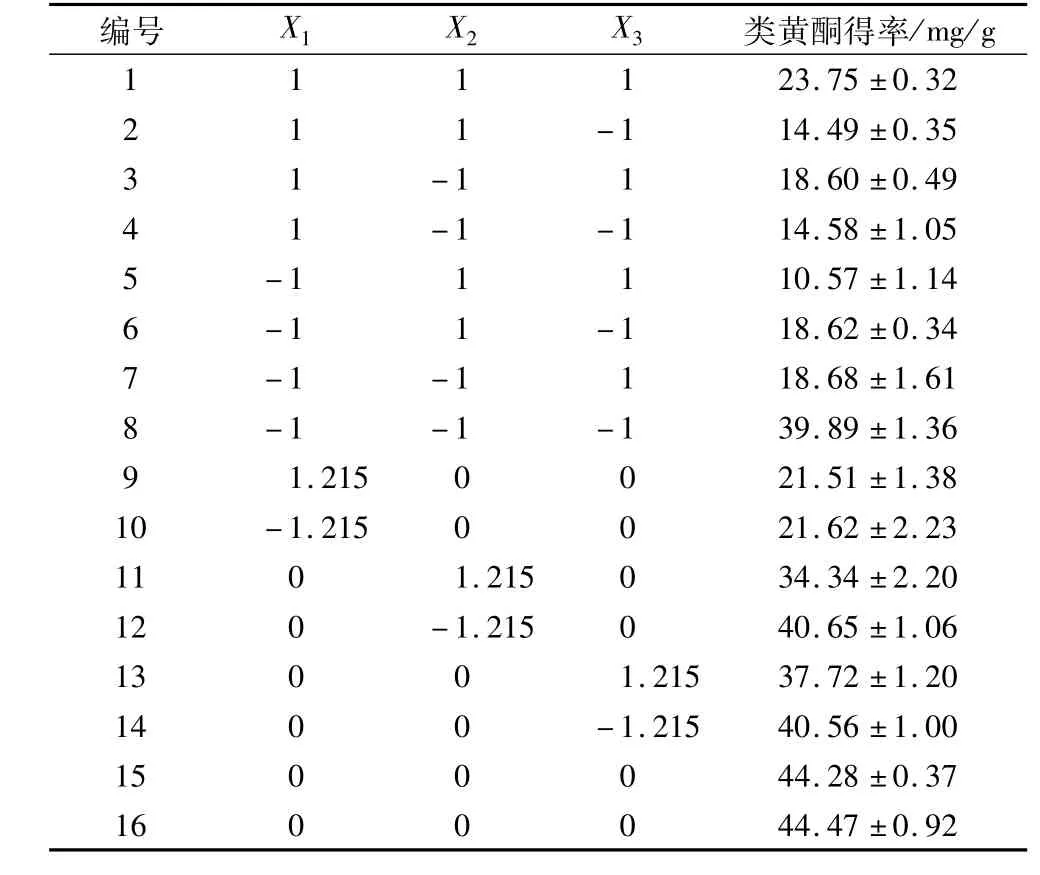
表3 三因素二次正交设计及结果(n=6)
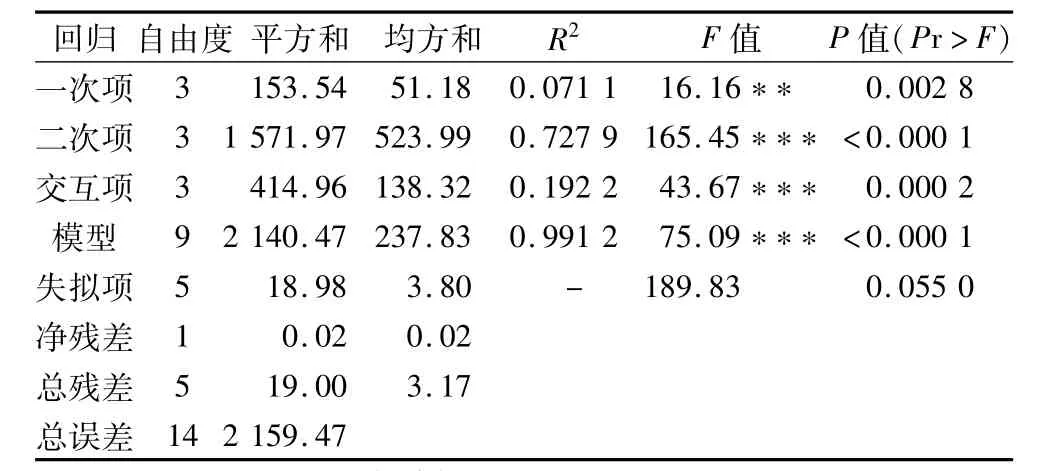
表4 回归模型的方差分析
采用SAS软件RSREG过程对表3三因素编码水平与类黄酮得率指标进行回归分析,得Y=B0+∑得类黄酮得率指标(Y)对试验因素X1~X3编码间的回归方程:

由回归模型(1)方差分析与F检验(表4)可知,F拟合=75.09(P<0.000 1),达到高度显著水平;回归方程的决定系数R2=0.991 2,说明模型方程差异显著,且拟合较好。因此可以用该模型分析各工艺参数对粗类黄酮得率的影响。
2.2.1 主效应分析
回归模型(1)的偏回归系数显著性检验(表5)表明,料液比、浸提温度、浸提时间的二次项和一次项均为负效应,且|B11|>|B22|>|B33|,|B2|>|B3|>|B1|;交互项为正效应,且|B13|>|B12|>|B23|;所有系数均达到0.05以上的显著水平。说明当超过最佳料液比、最佳浸提温度及最佳浸提时间后,类黄酮得率显著下降,以料液比的下降幅度最大,浸提温度次之,浸提时间的下降幅度最小;类黄酮得率不仅受三因素的单因子效应影响(见图1),而且两两因子间具有显著的互作效应。通过对三因素主效应作显著性检验(表6)表明,三因素对类黄酮得率的影响均达到0.001的极显著水平,且料液比>浸提温度>浸提时间。
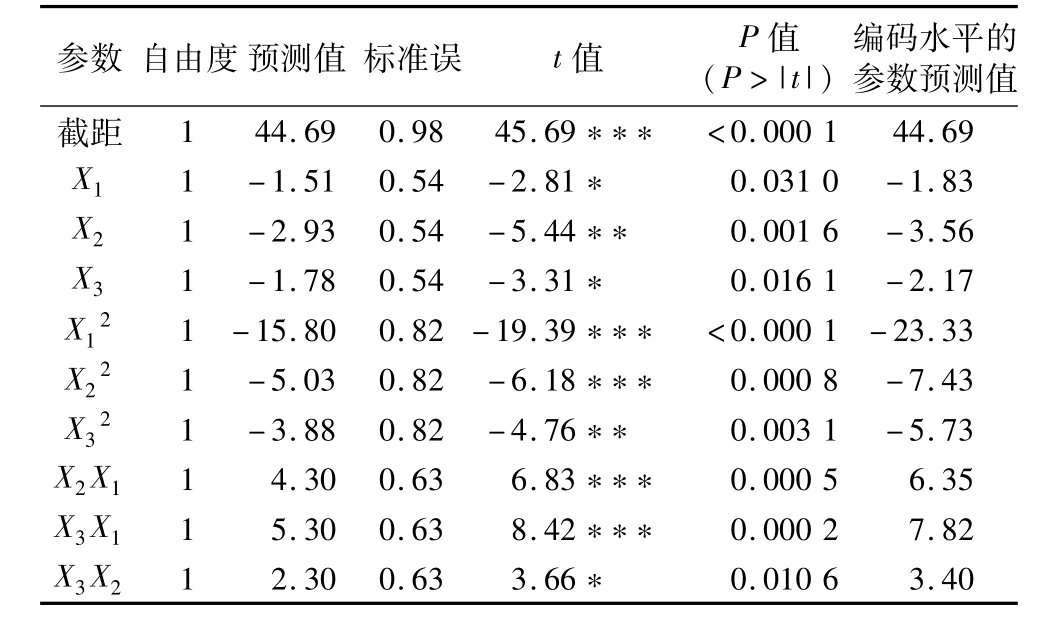
表5 参数的显著性检验
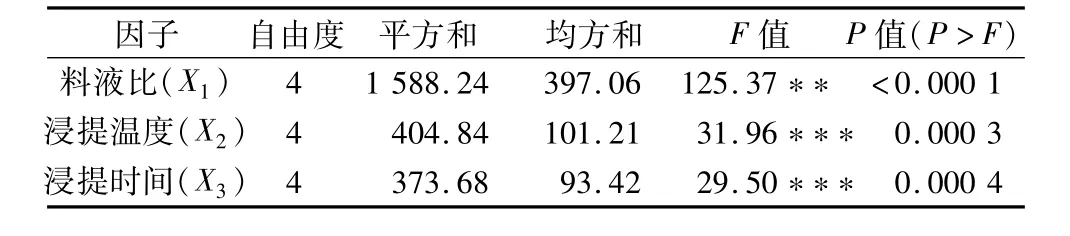
表6 主效应的方差分析
产生上述结果的可能原因是,小麦籽粒主要由皮层、糊粉层、淀粉质胚乳和胚4部分组成,淀粉是小麦籽粒的主要物质成分,其次是蛋白质。本试验中的山农129经籽粒品质测定,其出粉率约为70%,蛋白质约占14%以上,水分约占12%左右。黄酮类化合物属于次生代谢物质,在小麦中质量分数不足1%[18],且通常存在于植物细胞的胞基质及液泡中,其向溶剂扩散要克服细胞膜的阻力,因此其溶出及扩散速度既与浸提溶剂用量、浸提温度、浸提时间等工艺有密切关系[24],也受到籽粒内其他物质的干扰。首先料液比决定类黄酮物质能否充分溶出,是否会发生淀粉糊化现象;其次浸提温度的高低决定溶出速率快慢与溶剂挥发程度,同时也影响淀粉糊化及蛋白质变性等;而浸提时间长短则影响类黄酮及其他醇溶性物质的溶出程度,进而影响比色测定。
2.2.2 交互效应分析
从模型(1)互作项的偏回归系数可以看出,B31>B21>B32,且对类黄酮得率的影响均达0.05及其以上显著水平(表4),说明类黄酮得率的变化不仅在于各因子的主效应,而且还有两两互作效应的协同或拮抗。采用降维法将模型方程(1)中的某一因子Xi固定在“0”编码水平,获得类黄酮得率与另外两因子的偏回归模型(2)~回归模型(4)。
根据模型(2)~模型(4),利用 SAS软件的GCONTOUR过程,绘制互作等值线图(图2a~图2c)。由图2a~图2c可以看出,料液比的作用>浸提时间>浸提温度。经计算,当X1、X3(图2a)分别在 -0.080(即1∶19.5)、-0.244(即113min)编码水平时,Y值最大 45.03 mg/g;随 X1、X3分别从 -1.215提高到-0.080、-0.244时,Y值增大,二者协同;随X1、X3分别从 -0.080、-0.244提高到1.215时,Y值减小,二者拮抗。类似地,随 X1、X2(图2b),或 X2、X3(图2c)分别从 -1.215提高到 -0.076(即1∶19.5)、-0.272(即67℃),-0.303(即67℃)、-0.279(即112 min)时,二者协同,Y值增大(最大值分别为45.24、45.53 mg/g);随 X1、X2,或 X2、X3分别从 -0.076、-0.272,-0.303、-0.279提高到1.215时,二者拮抗,Y值减小。出现上述结果的原因可能是在相对较短的时间范围内或较低的温度范围内,提高料液比,有利于类黄酮向溶剂充分的溶出及扩散;继续增加料液比,并延长浸提时间或提高浸提温度,则一方面会导致浸提溶剂蒸发量加大、淀粉糊化,另一方面也可能引起其他醇溶性物质的溶出,进而影响类黄酮得率。同理,在较低的温度范围内,延长浸提时间,有利于类黄酮充分溶出;提高温度并延长浸提时间,则会因浸提溶剂的蒸发、淀粉的糊化、蛋白质的变性以及类黄酮结构的破坏等,而影响类黄酮得率。
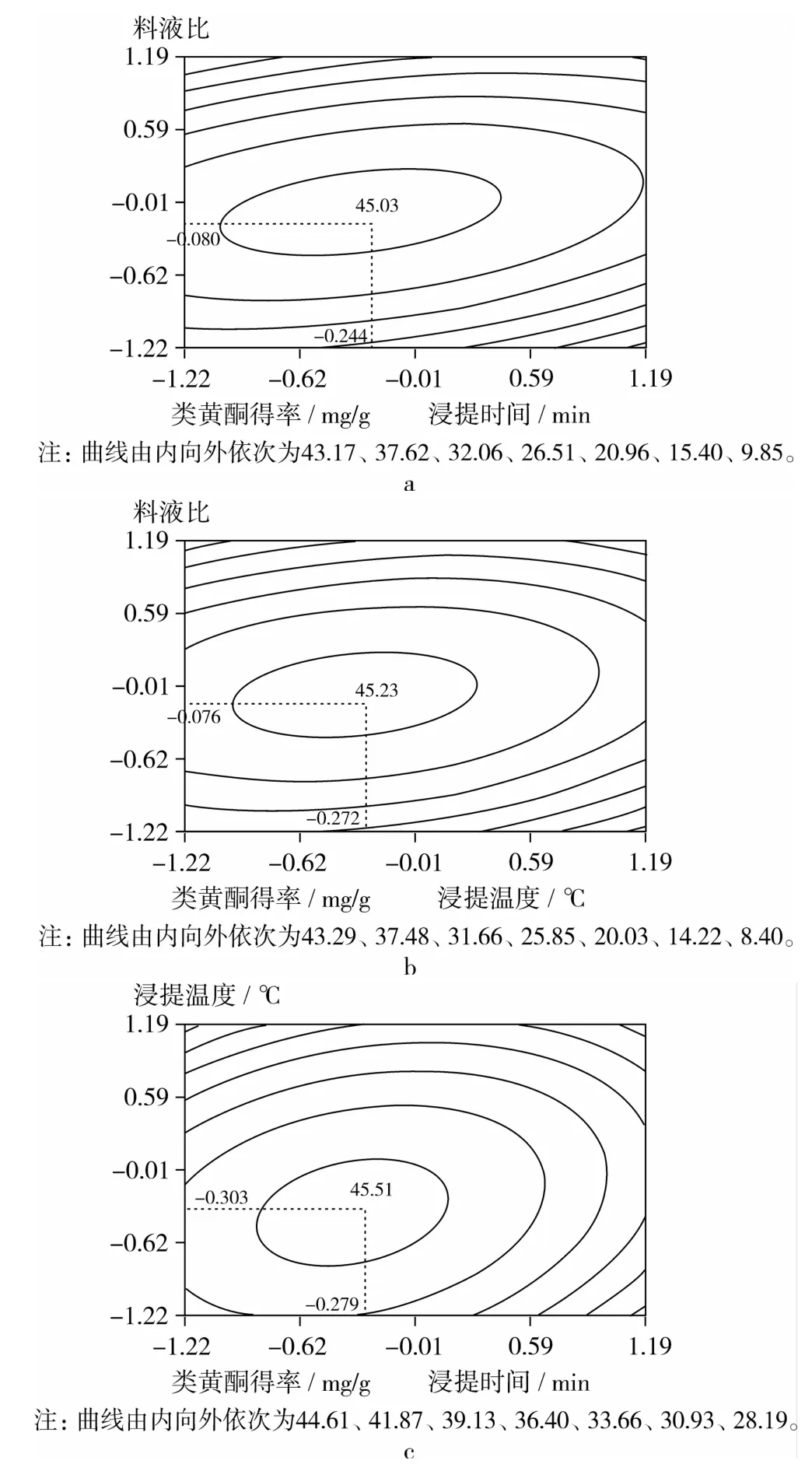
图2 料液比(X1)、浸提温度(X2)和浸提时间(X3)之间两两互作的等值线图
2.2.3 最佳工艺参数的确定及回归模型的验证
由SAS软件RSREG过程中3因素典型性分析结果可知,当料液比(X1)、提取温度(X2)、提取时间(X3)分别为1∶19(对应编码值 -0.165)、66℃(对应编码值-0.406)、107 min(对应编码值 -0.422)时,红粒小麦粗类黄酮得率最大46.02 mg/g。经实测验证该最佳工艺的得率为46.08 mg/g,标准偏差为0.04。所以该模型较好地反映了各因素对红粒小麦粗类黄酮得率的影响。
2.3 全麦粉粗类黄酮的体外清除自由基效果分析
红粒小麦粗类黄酮对DPPH·和·OH的清除率见图3。

图3 红粒小麦粗类黄酮对自由基的清除能力
由图3可以看出,当粗类黄酮质量浓度较低(1.25 mg/mL)时,对DPPH·和·OH的清除能力均较弱(前者为0.97%,后者为3.87%);随质量浓度增大到2.5 mg/mL,对DPPH·的清除率明显提高到8.22%(P<0.05),而对·OH的清除率(3.57%)没有显著变化(P>0.05);继续增大浓度,对2种自由基的清除率均明显增强(P<0.05),且对DPPH·的清除率增加幅度更大;质量浓度达到20 mg/mL时,对DPPH·的清除率达到66.21%,对·OH的清除率达到29.24%,前者是后者的2倍以上。将清除率与粗类黄酮浓度进行多项式回归,回归方程分别为Y=-0.173 1X2+7.147 5X-7.638(R2=0.998 4,DPPH·),Y=-0.046 0X2+2.398 9X-0.289 3(R2=0.989 0,·OH),回归方程拟合程度均达到98%以上。本试验结果表明,红粒小麦粗类黄酮具有较强的清除自由基能力,清除能力与类黄酮浓度呈正相关,且对DPPH·的清除效果强于对·OH的清除效果。
3 讨论
3.1 红粒小麦粗类黄酮的水浴醇提工艺
植物类黄酮的提取依据是相似相溶原理[24],其提取过程实质上是类黄酮从植物体内部向溶剂转移的传质过程。麦黄酮是小麦籽粒中的主要黄酮类化合物之一,其基本结构为 5,7,4′-三羟基 -3′,5′-二甲氧基黄酮[10],属于极性较大的O-糖苷类;考虑到乙醇的极性和相对安全性,本研究确定乙醇作为提取溶剂,并对醇提工艺进行优化。结果表明,料液比对粗类黄酮得率的影响(P<0.000 1)>浸提温度(P<0.00 1)>浸提时间(P<0.00 1);料液比与浸提时间的交互作用(P<0.001)>料液比与浸提温度(P<0.00 1)>浸提温度与浸提时间(P<0.05)。如前所述,本试验所用红粒小麦籽粒淀粉和蛋白质质量分数分别高达70%、14%以上,因此,在提取过程中,这些含量较高的物质极易造成一定的干扰,尤其是明显发生的淀粉糊化问题。可见料液比是影响红粒小麦全麦粉粗类黄酮得率的首要因素。经优化工艺得到的类黄酮得率为46.02 mg/g,实测验证得率为46.08 mg/g,标准偏差为 0.04。比赵善苍[10]采用甲醇超声并过0.22μm微孔滤膜所得到的白粒小麦全麦粉中的麦黄酮含量(47.1 mg/g)略低,但比许钢[25]采用80%乙醇溶液超声抽滤获得的白粒玉米粗类黄酮含量(41.1 mg/g)要高。
3.2 红粒小麦粗类黄酮的抗氧化能力
植物类黄酮是天然植物抗氧化活性的有效成分之一,已被在多种植物中证实[26-29]。不同植物、不同器官类黄酮结构不一,因而其抗氧化能力亦不同[11,30]。检 测 抗 氧 化 能 力 常 用 的 方 法 有 清 除DPPH·、·OH和O2-·[11,16],清除率越大,抗氧化能力越强。在天然谷物中,荞麦富含黄酮类化合物是众所周知的,其较强的抗氧化能力也是公认的[31]。本研究中红粒小麦经乙醇提取制备的粗类黄酮具有较强的抗氧化活性,随浓度增加,其抗氧化能力明显增强(P<0.05);且对DPPH·的清除能力明显强于对·OH的清除能力;当类黄酮质量浓度为20 mg/mL时,对·OH的清除能力为29.24%,对DPPH·的清除能力可以达到66.21%,是·OH自由基清除率的2.26倍。这可能与粗类黄酮的具体结构以及清除不同自由基的具体作用机理不同有关。比如,荞麦中类黄酮化合物种类及含量丰富[30],其中以芦丁和槲皮素含量较高,其结构上含有较多的多聚羟基(C—OH)(如A环上的C-5和C-7羟基,B环上的C-3′和C-4′羟基,C环上的 C-3羟基等),成为脂类过氧化的潜在抑制物,而麦黄酮结构上仅具3个C—OH[32]。当然也不排除本试验中制取的粗类黄酮纯度较低的原因。若经过超声萃取辅助水浴浸提,再经大孔树脂分离、除杂、过柱纯化,得到纯度更高的类黄酮,则相关指标的测定可能有较高的提升。
4 结论
研究优化了红粒小麦粗类黄酮水浴醇提工艺,最佳参数为:以95%乙醇为提取剂,料液比、提取温度、提取时间的最适条件分别为1∶19、66℃、107 min,类黄酮得率为46.02 mg/g。经实测验证该最佳工艺的类黄酮得率为46.08 mg/g,标准偏差为0.04。红粒小麦粗类黄酮有较强的清除自由基能力,且随浓度提高,清除率显著提高(P<0.05);在同一浓度下,对DPPH·的清除率明显大于对·OH的清除率。研究为红粒小麦深加工提供参考。
参考文献
[1]Dreher D,Junod A F.Role of oxygen free radicals in cancer development[J].European Journal of Cancer,1996,32A(1):30-37
[2]周桂娟,王坤,刘佳明,等.彩色小麦色素的光谱及抗氧化特性[J].中国农学通报,2011,27(5):109-114
[3]古勇,李安明.类黄酮生物活性的研究进展[J].应用与环境生物学报,2006,12(2):283-286
[4]步文磊,王茵,荫士安,等.植物类黄酮改善认知功能方面的动物实验研究进展[J].中华预防医学杂志,2009,43(9):817-820
[5]Baublis A,Decker E A,Clydesdale FM.Antioxidant effect of aqueous extracts from wheat based ready-to-eat breakfast cereals[J].Food Chemistry,2000,68(1):1-6
[6]Madhujith T,Shahidi F.Optimization of the extraction of antioxidative constituents of six barley cultivars and their antioxidant properties[J].Journal of Agricultural and Food Chemistry,2006,54(21):8048-8053
[7]Liyana-Pathirana C,Dexter J,Shahidi F.Antioxidant properties of wheat as affected by pearling[J].Journal of Agricultural and Food Chemistry,2006,54(17):6177-6184
[8]陈智毅,徐玉娟,尹艳,等.甜玉米多酚类成分的测定[J].食品科学,2010,31(10):235-238
[9]孙玲,陈俊秋,张名位,等.稻米种皮颜色与其生物抗氧化性的关系[J].中国粮油学报,2002,17(4):25-27
[10]赵善仓.不同品种的彩色小麦天然抗氧化活性物质的分析研究 [D].泰安:山东农业大学,2009
[11]宗学凤,张建奎,李帮秀,等.小麦籽粒颜色与抗氧化作用[J].作物学报,2006,32(2):237-242
[12]陈卫军,曹炜.麦胚提取物的抗氧化性研究[J].食品科学,2004,25(10):294-300
[13]连彩霞.脱脂麦胚提取物抗氧化、抗肿瘤活性的研究[D].无锡:江南大学,2010
[14]周会会,朱科学.小麦胚芽提取物的抗肿瘤活性研究进展[J].中国粮油学报,2012,27(11):114-118
[15]江生,吴向阳,仰榴青,等.小麦麸皮不同提取物清除自由基的作用[J].食品研究与开发,2009,30(6):27-29
[16]张东阳,李集临,张杰.黑粒小麦的选育及其抗氧化特性[J].中国农学通报,2010,26(5):93-96
[17]肖香,钱静亚,崔凤杰,等.碱性蛋白酶降解小麦面筋蛋白制备抗氧化产物的工艺优化[J].食品研究与开发,2009,30(8):38-40
[18]郭红英.麦胚蛋白酶解物的制备及其抗氧化功能研究[D].镇江:江苏大学,2009
[19]王建方,王金,吴向阳,等.小麦麦麸碱提物的体外抗氧化作用[J].食品研究与开发,2009,30(3):56-59
[20]黄晔,龙光锦,姜林华,等.玉米须总黄酮的提取及鉴别[J].时珍国医国药,2006,17(6):1008-1009
[21]李南薇,李燕杰,唐凤欣.柚皮黄酮的提取工艺优化[J].广东农业科学,2011(6):110
[22]Yamaguchi T,Matoba T,Terao J,et al.HPLCmethod for evaluation of the free radical-scavenging activity of foods by using 1,1-diphenyl-2-picrylhydrazyl[J].Bioscience,Biotechnology,and Biochemistry,1998,62(6):1201-1204
[23]吴亚楠,鲁晓翔,连喜军,等.玉米须黄酮清除自由基活性的研究[J].食品研究与开发,2009,30(1):5-8
[24]欧阳平,张高勇,康保安.类黄酮的新兴提取技术原理、应用及前景[J].天然产物研究与开发,2003,15(6):553-556
[25]许钢.玉米不同部位提取物的抗氧化性能比较[J].食品与发酵工业,2004,30(4):88-91
[26]杨维.白骨壤果实中黄酮类化合物的提取、分离纯化及抗氧化活性研究 [D].广州:广东海洋大学,2011
[27]龙春.银杏黄酮的提取、抗氧化活性及构效关系研究[D].重庆:重庆大学,2006
[28]赵静.芦笋类黄酮及其抗氧化活性研究 [D].济南:山东师范大学,2006
[29]江相兰.竹叶黄酮的提取、检测、分离、抗氧化活性及构-效关系的研究[D].重庆:重庆大学,2005
[30]王炜,欧巧明,杨随庄.苦荞麦化学成分及生物活性研究进展[J].杂粮作物,2010,30(6):419-423
[31]张莉,李志西.传统荞麦制品保健功能特性研究[J].中国粮油学报,2009,24(3):53-57
[32]王龙,孙建设.类黄酮的化学结构及其生物学功能[J].河北农业大学学报,2003,26(z1):144-147.
The Optimal Ethanol Extraction Process in Water Bath and Antioxidant Ability in Vitro of Red-Grain Wheat Flavonoids
Hao Jiaomin1Li Yun1Yang Zhenping2Yang Hua1Zhu Yingchun1Sun Min2Gao Zhiqiang2
(College of Food Science and Engineering,Shanxi Agricultural University1,Taigu 030801)
(College of Agriculture,Shanxi Agricultural University2,Taigu 030801)
In the paper,thewholemeal of red-grain wheatwas used,and four single-factor experimentswith three factors quadratic orthogonal design was adopted to research the ethanol extraction process of flavonoids in the water bath.The scavenging abilities against DPPH·and hydroxyl radicals(·OH)in vitro of flavonoidswere determined.The results indicated that the effects of ethanol concentration,solid-liquid ratio,extracting temperature and extracting time on the yields of flavonoids were in line with the downward parabola models.On condition that the 95%ethanol solventwas ascertained,the effects of the three parameters including solid-liquid ratio(X1),extracting temperature(X2)and extracting time(X3)on the yields of flavonoidswere in linewith the three factors quadratic regression model.Themajor effectswere X1>X2>X3.Themutual effects among parameterswere X1X3>X1X2>X2X3.The optimum parameterswere solid-liquid ratio of 1∶19,extracting for 107 min at 66℃,and the yield of flavonoidswas 46.02 mg/g.The results also indicated that the red-grain wheat flavonoids expressed more powerful scavenging activities against DPPH· than hydroxyl radicals(·OH).The scavenging rates increased significantly with the increased flavonoids concentration.The study could provide a reference for deep-processing of red-grain wheat.
wheat,flavonoids,ethanol extraction in water bath,antioxidant ability
S512.1
A
1003-0174(2015)07-0012-07
山西省科技攻关(20110311001-4),现代农业产业技术体系建设专项(CARS-03-01-24)
2014-02-20
郝教敏,男,1974年出生,副教授,天然植物抗氧化物质的提取及应用
杨珍平,女,1973年出生,教授,植物资源学与植物生理生态

