生物酰化酶Ι(acylaseΙ)对溴代苯丙氨酸手性拆分的研究
于 芳,郭栋才,于海洋,刘莎莎,何宇鹏
(辽宁石油化工大学 化学与材料科学学院, 辽宁 抚顺 113001)
科研与开发
生物酰化酶Ι(acylaseΙ)对溴代苯丙氨酸手性拆分的研究
于 芳,郭栋才,于海洋,刘莎莎,何宇鹏
(辽宁石油化工大学 化学与材料科学学院, 辽宁 抚顺 113001)
利用生物酰化酶 Ι (acylase Ι)可以选择性的切除S-型苯丙氨酸上酰胺键的特点,高效快捷的对外消旋溴代苯丙氨酸进行手性拆分,成功的分离得到了互为异构体的溴代苯丙氨酸盐酸盐,并使用了核磁共振、高分辨质谱和旋光值对结果进行了表征,为含有苯丙氨酸衍生物结构的天然产物分子和药物分子的合成提供了一个高效便捷的路线。
酰化酶 Ι;溴代苯丙氨酸;手性拆分
目前,非天然氨基酸的合成及手性拆分已经成为了有机化学合成界的热点[1],目前比较普遍的方法主要是有通过有机小分子催化剂[2,3]和手性配体[4]的调控来实现非天然氨基酸的不对称合成和手性拆分。在上述方法中,特定的小分子催化剂和手性配体对于氨基酸特定的手性构型有着较强的专一性,比较适合用于合成单一构型的非天然氨基酸化合物。但是如果在合成过程中,需要同时得到两种互为对映异构体的非天然氨基酸分子,小分子催化剂和手性配体的的实用性则略显不足。2002年,德国的Waldmann教授总结归纳了大量的利用天然生物酶对外消旋氨基酸进行手性拆分的实例[5]。其中提到了酰化酶Ι(acylase Ι)[6-8]可以用于苯丙氨酸的手性拆分,即可以同时得到两种互为对映异构体的手性氨基酸。苯丙氨酸是生命体不可缺少的氨基酸,苯丙氨酸的衍生物也是在诸多天然产物分子和药物分子中经常出现的重要结构片段,而溴代苯丙氨酸因为其芳溴结构可以做出进一步更为多样的衍生化而显得更为重要[9-11]。本文则是利用了acylase Ι作为催化剂对溴代苯丙氨酸进行手性拆分的学术研究。
1 实验部分
1.1 试剂及仪器
二苯亚甲基氨基乙腈,3-溴苄溴,苄基三乙基氯化铵,二氯化钴,乙酸酐,acylase Ι等分析纯试剂,美国Aldrich公司。核磁共振仪:Varian Mercury 400。(FAB)-质谱仪:Typs Jeol SX 102 A。旋光仪:Schmidt + Haensch HH8,Na-D-Linie。
1.2 外消旋3-溴苯丙氨酸(5)的合成
实验使用了二苯亚甲基氨基乙腈(1)和3-溴苄溴(2)作为初始反应物,以甲苯作为溶剂,并在相转移催化剂-苄基三乙基氯化铵(TEBA)(3)和30%的NaOH水溶液的作用下制备了氨基酸前体分子4,之后再用盐酸将二苯基脱去得到外消旋的3-溴苯丙氨酸(5)。反应路线如图1所示。
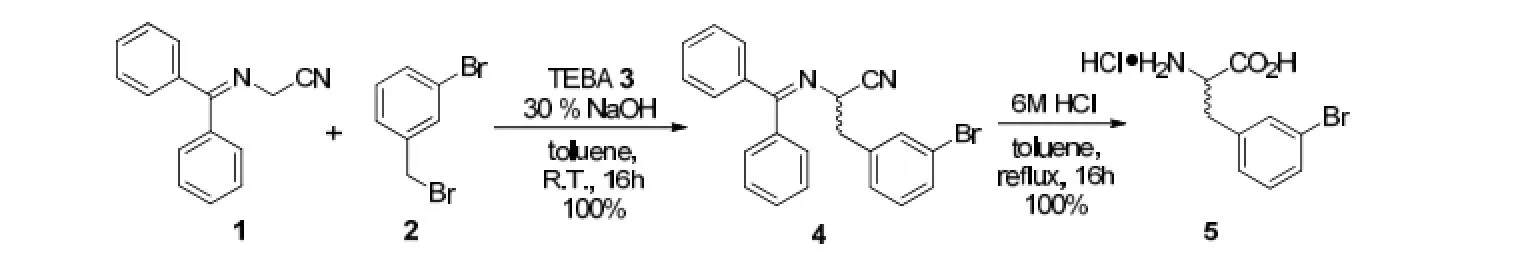
图1 外消旋的3-溴苯丙氨酸(5)的合成Fig.1 Synthesis of racemic 3-bromophenylalanine (5)
操作步骤:
将80 g (0.36 mol) 二苯亚甲基氨基乙腈(1)和6.9 g (0.03 mol) 苄基三乙基氯化铵(3) 溶于150 mL的甲苯溶剂中,再向溶剂中加入250 mL的30% NaOH水溶液。将反应体系冷却至0 ℃,并向溶剂中滴加3-溴苄溴(2)的甲苯溶液(100 g 3-溴苄溴溶于100 mL甲苯溶液)。反应在室温下搅拌16 h后,向反应液中加入200 mL水,并用300 mL的二氯甲烷萃取3次。再将合并的有机相用饱和食盐水洗涤一次,并用无水硫酸镁进行干燥,过滤。蒸干溶剂后可得到无色的固体产物4,产率92%。
将140 g (0.36 mol) 分子4溶于300 mL甲苯溶液中,并加入800 mL 6 mol/L的盐酸水溶液。将反应液加热回流16 h后冷却至室温,将反应体系中的不溶物过滤,可得到无色固体产物5,产率100%。
1.3 (S)/(R)-3-溴苯丙氨酸盐酸盐(7, 9)的合成
实验首先使用了乙酸酐对外消旋3-溴苯丙氨酸进行酰基化,得到氨基酸衍生物6,而后在氯化钴的作用下利用acylase Ι 将S-型氨基酸的酰胺键脱去[8],得到(S)-3-溴苯丙氨酸(7),而R-型氨基酸8的酰胺键则被保留[8]。此时两种不同构型的氨基酸由于取代基团已经不同,其分子结构展示出较大的极性差异,可以通过萃取的方式进行分离。脱去了酰胺键的S-型氨基酸由于极性非常大,所以可以在水中完全溶解;而保留了酰胺键的R-型氨基酸则可以溶于有机溶剂。之后再将未脱去酰胺键的R-型氨基酸用HCl将酰胺键脱去,即可得到(R)-3-溴苯丙氨酸(9)。反应路线如图2所示。

图2 (S)/(R)-3-溴苯丙氨酸盐酸盐(7, 9)的合成Fig.2 Synthesis of (S)/(R)-3-bromobenzenealanine hydrochloride (7, 9)
操作步骤:
将100 g (0.35 mol) 外消旋氨基酸5 溶于1 L水中,并用2 mol/L的氢氧化钠溶液将溶剂的pH值调至12[12]。之后将水蒸干,并将剩余的部分转移到900 mL醋酸中。之后向此醋酸溶液中缓慢滴加39 mL (0.42 mol)乙酸酐,并在室温下搅拌16 h。反应结束后将醋酸溶剂蒸干,并将剩余部分转移到1 L的水中,再用饱和的盐酸水溶液将反应体系的pH值调制1。用100 mL的乙酸乙酯萃取三次,将合并的有机相用饱和食盐水洗涤一次,并用无水硫酸镁进行干燥,过滤。蒸干溶剂后可得到无色的固体产物6,产率78%。
将75 g (0.26 mol) 乙酰氨基酸6加入到1.5 L的水中,并用4 mol/L的氢氧化钠水溶液将反应液的pH值调制7.5~8.0之间。在氩气的保护下向反应液中加入0.74 g (5.72 mol) 的二氯化钴和3.17 g acylase Ι,并在室温下搅拌24 h(尽可能做到每4个小时测一次pH值)。向反应液中加入1 g的活性炭,并在60 ℃搅拌30 min。冷却至室温后,用饱和盐酸水溶液将反应液的pH值调制1,然后用500 mL的乙酸乙酯萃取三次。将水相的溶剂蒸干,可得到无色固体(S)-3-溴苯丙氨酸盐酸盐(7),产率46%。将合并的有机相用饱和食盐水洗涤一次,并用无水硫酸镁进行干燥,过滤,蒸干溶剂后可得到无色的固体产物8,产率48%。
将R-型乙酰氨基酸8加入到1 L的3 mol/L的盐酸溶液中,并加热回流16个小时。之后将反应冷却至室温,蒸干溶剂,得到无色的固体(R)-3-溴苯丙氨酸盐酸盐(9),产率100%。
2 结果与讨论
2.1 (S)-3-溴苯丙氨酸盐酸盐(7)的数据表征
核磁共振数据:1H-NMR (400 MHz, CD3OD): δ = 3.20 (dd,3J = 7.4 Hz, 7.2 Hz, 1H), 3.44 (dd,3J = 5.7 Hz, 7.3 Hz, 1H), 4.30 (dd,3J = 7.4Hz, 7.2 Hz, 1H), 7.32 (m, 2H), 7.51 (m, 1H), 7.54 (m, 1H).13C-NMR (100 MHz, CD3OD): δ = 37.6, 55.7, 124.7, 130.3, 132.7, 132.8, 134.4, 139.1, 174.9. 由上述数据可知,在氢谱中,化学位移值在3.20和3.44处为苄基上的两个氢,4.30处为手性中心的氢,从7.32至7.54之间的4个氢为苯环上的氢;碳谱中,37.6为苄基碳,55.7为手性碳原子,从124.7至139.1处为六个苯环碳,174.9为羰基碳。
另外,高分辨质谱测得了该化合物去掉了一个氯离子的分子量,理论值[M-Cl-]+为243.9958,实际测量值为243.9964,误差为百万分之二。旋光值(c = 1.0, MeOH)。
2.2 (R)-3-溴苯丙氨酸盐酸盐(9)的数据表征
核磁共振数据:1H-NMR (400 MHz, CD3OD): δ = 3.20 (dd,3J = 7.4 Hz, 7.0 Hz, 1H), 3.44 (dd,3J = 5.7 Hz, 7.3 Hz, 1H), 4.31 (dd,3J = 7.4Hz, 7.2 Hz, 1H), 7.33 (m, 2H), 7.51 (m, 1H), 7.54 (m, 1H).13C-NMR (100 MHz, CD3OD): δ = 37.6, 55.7, 124.7, 130.3, 132.7, 132.8, 134.4, 139.1, 174.8. 由上述数据可知,在氢谱中,化学位移值在3.20和3.44处为苄基上的两个氢,4.31处为手性中心的氢,从7.33至7.54之间的4个氢为苯环上的氢;碳谱中,37.6为苄基碳,55.7为手性碳原子,从124.7至139.1处为六个苯环碳,174.8为羰基碳。
另外,高分辨质谱测得了该化合物去掉了一个氯离子的分子量,理论值[M-Cl-]+为243.9968,实际测量值为243.9950,误差为百万分之四。旋光值(c = 1.0, MeOH)。
2.3 (S/R)-3-溴苯丙氨酸盐酸盐(7/9)的数据对比
由此互为对映异构体的3-溴苯丙氨酸盐酸盐的数据对比可见,两个化合物的核磁谱图完全重合,且氢谱裂分几乎完全一致。但两个化合物旋光值的绝对值相近,而且正负相反,可以得出结论,本实验所得到的确实为互为对映异构体的两个3-溴苯丙氨酸盐酸盐。
3 结 论
(1)本实验成功的使用了酰化酶(acylase Ι)对乙酰化的外消旋3-溴苯丙氨酸进行了选择性的去酰胺化,并以较高的产率得到了互为对映异构体的溴苯丙氨酸盐酸盐分子。
(2)通过核磁共振、高分辨质谱以及旋光值等数据进一步证明了该实验结果的准确性。
(3)本实验结果说明了酰化酶(acylase Ι)可以成功的拆分含有溴取代的苯丙氨酸衍生物,对含有苯丙氨酸衍生物结构的天然产物分子和药物分子的合成提供了一个高效便捷的路线。
[1]Wipf P. Synthetic Studies of Biologically Active Marine Cyclopeptides[J]. Chem. Rev., 1995, 95: 2115-2134.
[2]Benjamin L. Introduction: Organocatalysis, Chem. Rev. [J].2007,107(12): 5413-5415.
[3]李楠,刘伟军,龚流柱.手性有机小分子催化最新进展[J]. 化学进展, 2010, 22 (7): 1362-1379.
[4]Jacobsen E N. Asymmetric Catalysis of Epoxide Ring-Opening Reactions[J]. Acc. Chem. Res.,2000,33(6): 421-431.
[5]Drauz K, Waldmann H. Enzyme Catalysis in Organic Synthesis, 3 ed[M]. Wiley-VCH, Weinheim, 2002.
[6]Baker S R, Goldsworthy J, Harden R C,Salhoff C R, Schoepp D D. Enzymatic resolution and pharmacological activity of the enantiomers of 3,5-dihydroxyphenylglycine, a metabotropic glutamate receptor agonist[J]. Bioorganic & Medicinal Chemistry Letters, 1995, 5 (3): 223-228.
[7]Liu J, Deng X, Fitzgerald A E, Sales Z S, Venkatesan H, Mani N S. Protecting-group-free synthesis of a dual CCK1/CCK2 receptor antagonist[J]. Biomol. Chem. , 2011, 9: 2654-2660.
[8]Bois-Choussy M, Zhu J. Chemoenzymatic Synthesis of D-N-Boc-3,5-dihydroxy-4-methoxyphenylglycine[J]. J. Org. Chem. , 1998, 63: 5662-5665.
[9]Netherton M R, Dai C, Neuschütz K, Fu G C. Room-Temperature Alkyl -Alkyl Suzuki Cross-Coupling of Alkyl Bromides that Possess β Hydrogens[J]. J. Am. Chem. Soc , 2001, 123: 10099-10100.
[10]Western E. C., Daft J. R., Johnson E. M., Gannett P. M., Shaughnessy. K. H. Efficient One-Step Suzuki Arylation of Unprotected Halonucleosides, Using Water-Soluble Palladium Catalysts [J]. J. Org. Chem. 2003, 68: 6767-6774.
[11]Devasher R B, Moore L R, Shaughnessy K H. Aqueous-Phase, Palladium-Catalyzed Cross-Coupling of Aryl Bromides under Mild Conditions, Using Water-Soluble, Sterically Demanding Alkylphosphines[J]. J. Org. Chem ., 2004, 69: 7919-7927.
[12]Gade W, Brow J L. Purification, characterization and possible function of alpha-N-acylamino acid hydrolase from bovine liver, Biochim[J]. Biophys. Acta ., 1981, 662: 86-9.
Study on Chiral Resolution of Bromophenylalanine by Biological Acylase Ι
YU Fang, GUO Dong-cai, YU Hai-yang, LIU Sha-sha, HE Yu-peng
(School of Chemistry and Material Science, Liaoning Shihua University, Liaoning Fushun 113001, China)
Racemic bromophenylalanine was separated into enantiomeric isomers by biological caylase Ι which can remove the amide bond of S-type phenlyalamine selectivity and efficiency. The isolated products were characterized by NMR, HR-MS, and Polarimeter. Finally the results provided an efficient and convenient route to synthesize nature products and drug molecules with optically pure phenylalanine derivative structure.
Acylase Ι; Bromophenylalanine; Chiral separation
TQ 028
: A
: 1671-0460(2015)02-0221-03
国家自然科学基金项目, 项目号:21202077。
2014-12-08
于芳(1984-),女,湖北恩施人,讲师,博士,2011年毕业于沈阳药科大学药物化学专业,研究方向:从事天然产物化学和不对称催化方面的研究。E-mail:yufang1112002@163.com。
何宇鹏(1979-),男,副教授,博士,2010年毕业于德国Max-Planck-Institute for Molecular Physiology in Dortmund, 研究方向:从事天然产物化学和不对称催化方面的研究。E-mail:yupenghe2014@163.com。

