抑制自嗜增强Salirasib诱导的骨肉瘤细胞凋亡
王进军 刘建民 梁勇
Ras超家族是一类重要的功能蛋白。它们介导生长因子、细胞因子和多种细胞外信号的信息通路,对细胞生长、分化、存活、增殖等有重要作用。Ras通路的激活与人类很多肿瘤的发生、发展有关,超过33%的肿瘤伴有Ras亚型(H,K,N)的突变[1],因此,Ras蛋白常被作为肿瘤治疗的靶向。Salirasib(FTS)是一种合成的Ras抑制剂,它能阻止Ras蛋白固着于膜上,降低了细胞中Ras的水平,进而抑制了Ras依赖的细胞生长[2]。
自嗜,是细胞成分的自我消化过程,能够维持蛋白合成及降解之间的平衡。自嗜对细胞的正常生长很重要。细胞在遭遇诸如缺氧、化疗或放疗等应激时,会启动赖以生存的自嗜。
通过自嗜,细胞可以清除降解胞内受损的细胞结构、衰老的细胞器以及不再需要的生物大分子等[3]。在消化的同时,自嗜也为细胞内细胞器的重新构建提供了原料,即细胞结构的再循环。因此,作为应激状态下启动的生存机制,自嗜对细胞的存活起着关键作用。研究表明,自嗜参与了诸如胰腺癌、乳腺癌和肝癌等肿瘤疾病的进程。然而,关于自噬在促进生存和诱导死亡之间变化的具体分子机制尚不完全明确,可能与细胞代谢失衡有关[4]。氯喹通常作为抗疟疾药使用,研究显示,氯喹可以通过阻止自嗜体与溶酶体的结合而终止自嗜[5]。
近年研究显示,抑制自嗜可以作为肿瘤治疗的一种新方法[6]。本研究中们检测了氯喹联合FTS对细胞活性的影响。结果显示,单独FTS能诱导人骨肉瘤细胞系MG 63和U 2-OS中自嗜的发生,并对细胞的生长起抑制作用。氯喹抑制自嗜后,能增强FTS对细胞的生长抑制及诱导Caspase-3依赖的细胞凋亡。本研究表明,联合治疗较单药效果更为突出。
1 资料与方法
1.1 细胞系来源 人骨肉瘤细胞系MG 63和U 2-OS购于中科院典藏细胞库。
1.2 主要试剂及仪器
1.2.1 主要试剂 FTS和CQ购自Sigma-Aldrich,Anti-actin 购自MP Biomedicals,Anti-caspase 3和Antisurvivin 购自 Santa Cruz,Anti-LC 3 购自 Sigma-Aldrich。
1.2.2 主要仪器 流式细胞仪(FCM,Becton Dickinson)、倒置相差显微镜(O L Y M P U S,I X 70-S 8F)、超净台(HERAEUS,HFSafe 1200)、CO2培养箱(HERAEUS)、恒温培养箱(Thermo Inc)、超纯水装置(MILLIPORE)、小型台式离心机(SIGMA)、电子天平(TC 32 A)、低温冰箱(Sanyo)、高速离心机(Biofμge HERAEUS)、核酸蛋白定量分光光度计(GeneQuant,美国Amersham公司)Western电泳设备(Bio-Rad)、荧光定量PCR 仪(ABI Prism 7000)、琼脂糖胶电泳仪(Bio-Rad)。
1.3 实验方法
1.3.1 细胞培养 细胞用10%胎牛血清的DMEM培养液培养,放置在37℃,5%CO2孵箱中。测细胞活性时,将其与等量0.4%的台盼蓝溶液混合,然后在显微镜下观察。
1.3.2 细胞质、细胞核提取物的制备 通过CelLytic TM和NuCLEAR TM试剂盒制备细胞提取物。先用无菌的PBS水洗涤细胞,吸净PBS,将含有蛋白酶抑制剂的裂解液均匀滴在细胞上,放在冰上15 min后,用刮匙将细胞从培养皿刮下,收集混合液。然后高速离心15 min,收集上清液,于-20℃储存。通过蛋白定量分析评估蛋白浓度,所得提取物用于Western blot分析。
1.3.3 Western印迹 制备12%的SDS-PAGE电泳凝胶后,将蛋白裂解液每个泳道上蛋白样20 μg。然后,以80 V,90 min分离蛋白。之后,恒压120 v进行转膜,持续90 min。将PVDF膜于牛奶中封闭1 h,然后加入一抗结合PVDF膜,于4℃孵育过夜。第2天,将膜在室温下摇1 h,然后孵育二抗,1 h后用PBST洗膜3次。之后,通过标准增强化学发光发检测标记信号。
1.3.4 Sub-G 1期的检测 用无菌的PBS将经过药物处理的细胞清洗2遍,于0.1% Triton X-100环境孵育10 min,再次洗涤,之后再于25 mg/mL的碘化丙啶及1 μg/mL的RNase A中孵育15 min。通过FACScan流式细胞计数分析细胞荧光,检测细胞Sub-G 1期。
1.4 统计学方法 应用SPSS 10.1软件进行统计学分析。正态计量资料采用“±s”表示;2组正态计量数据的组间比较采用t检验;计数资料用例数(n)表示,计数资料组间率(%)的比较采用χ2检验;P<0.05为差异有统计学意义。
2 结果
2.1 FTS诱导骨肉瘤细胞系MG 63和U 2-OS中自嗜的发生为了确定FTS能否诱导骨肉瘤细胞系MG 63和U 2-OS中自嗜的发生,Western检测了LC 3-II蛋白的表达水平。LC 3-II蛋白是自嗜发生的标志蛋白。用不同特定浓度的FTS处理细胞一定时间,Western检测LC 3-II蛋白的表达。结果显示,FTS在两个细胞系中均诱导了自嗜的发生,且呈剂量依赖关系。见图1。
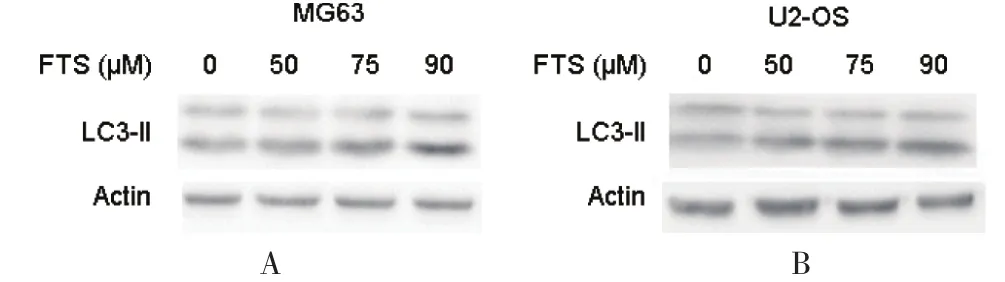
图1 FTS诱导骨肉瘤细胞系MG 63和U 2-OS中 LC 3-II蛋白的表达
2.2 氯喹对FTS诱导骨肉瘤细胞系MG 63和U 2-OS中自嗜的影响 确定了FTS可以诱导骨肉瘤细胞系MG 63和U 2-OS发生自嗜后,进一步检测氯喹对 LC 3-II蛋白表达水平的影响。氯喹能通过抑制自嗜体和溶酶体的融合而抑制自嗜过程的进展,因此会导致细胞内 LC 3-II蛋白的积累。用特定浓度的FTS单药或者联合氯喹处理细胞。结果显示,氯喹处理能明显增加FTS诱导的 LC 3-II蛋白的积累。与单独FTS处理相比,联合治疗明显增强了 LC 3-II蛋白的水平。见图2。
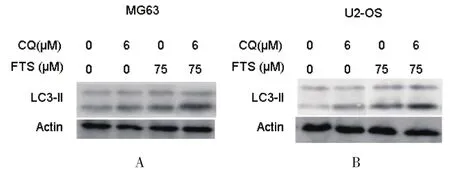
图2 氯喹增强了骨肉瘤细胞系MG 63和U 2-OS中FTS诱导的自嗜
2.3 FTS联合氯喹对细胞活性的影响 检测单独FTS及联合氯喹治疗对细胞活性的影响。分别用60um和50um的FTS单独或联合氯喹(4uM)处理骨肉瘤细胞系MG63和U2-OS一定时间。台盼蓝实验检测细胞活性。如图3A和B所示,单独FTS治疗已明显抑制了细胞的生长。在联合氯喹的情况下,FTS的效果更加明显。该结果表明,FTS可以抑制细胞生长,但其诱导的自嗜可能部分保护细胞,氯喹抑制自嗜可以增强细胞对药物的敏感性。
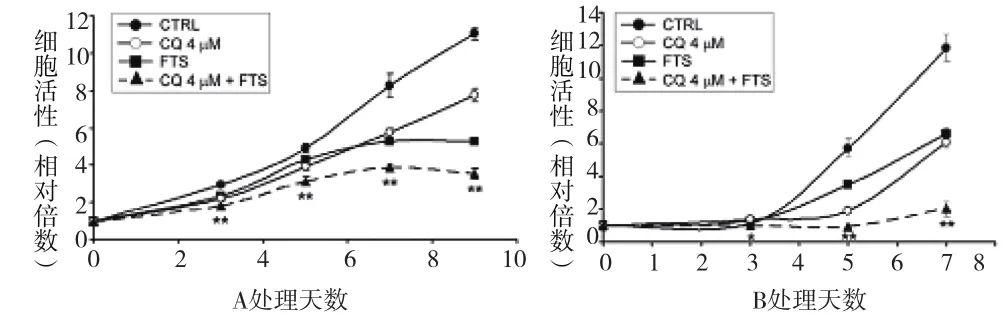
图3 氯喹增强骨肉瘤细胞系MG 63和U 2-OS中FTS诱导的细胞生长抑制
2.4 FTS联合氯喹对细胞凋亡的影响 流式细胞技术检测联合治疗对细胞凋亡的影响。结果显示,在2个细胞系中,氯喹均增强了FTS诱导的细胞凋亡。图4显示,与单独治疗组相比,联合治疗使处于Sub-G 1期的细胞数明显增多。因此,氯喹促进了FTS诱导的细胞凋亡。

图4 与单独治疗组相比,联合治疗使处于Sub-G 1期的细胞数明显增多
2.5 FTS联合氯喹诱导细胞凋亡的机制 为了进一步阐明FTS联合氯喹诱导细胞凋亡的机制,检测了经处理后细胞系中两种重要凋亡蛋白的表达:caspase-3和survivin。结果显示,联合治疗明显增强了Caspase-3的水平,减弱了survivin的表达。见图5。因此,FTS联合氯喹诱导了两种细胞系中依赖Caspase-3的凋亡。
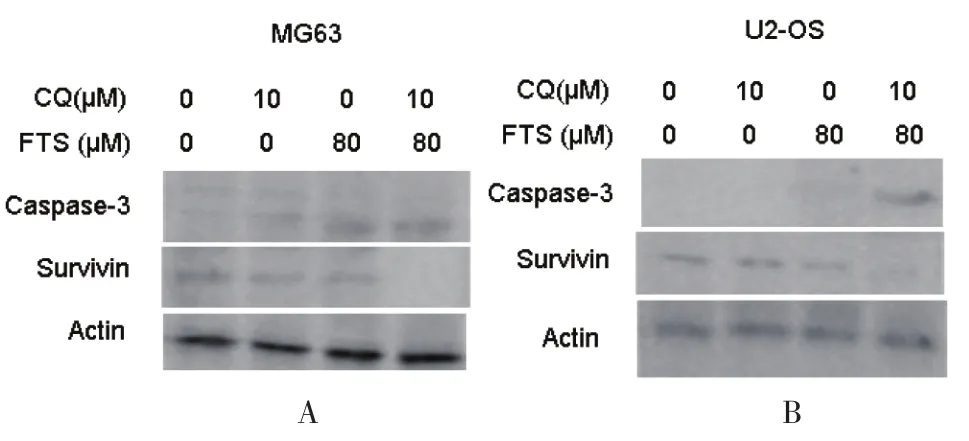
图5 与单独治疗组相比,联合治疗明显诱导了两种细胞系中依赖caspase-3的凋亡
3 讨论
本研究显示,FTS能诱导骨肉瘤细胞系MG 63和U 2-OS中自嗜的发生,并对细胞的生长起抑制作用。氯喹抑制自嗜后,能显著增强FTS对细胞的生长抑制及Caspase-3依赖的细胞凋亡。
Ras通路是许多信号通路的交汇点,对细胞活性起着调控作用[7]。作为一种Ras抑制剂,FTS能阻止Ras蛋白固着于膜上,降低了细胞中Ras的水平,进而抑制了Ras依赖的细胞生长。然而,FTS在抑制细胞生长的同时,也诱导了自嗜的发生。自嗜是一种进化高度保守的过程,是细胞内的防御和应激调控机制[8]。通过自嗜,细胞可以消除和降解受损、变性、衰老及失去功能的细胞器、变性蛋白质及核酸大分子等,以维持细胞内环境的稳态。有文献认为,自嗜的发生有助于促进细胞的存活,但也有文献表明,过度自嗜将诱导细胞凋亡[9]。还有研究表明,自嗜不仅有抑癌作用,在肿瘤的形成过程中自嗜也起作用[10]。
先前有研究表明,FTS诱导的自嗜在一定程度上对细胞起保护作用,该结果提示我们可以研究FTS联合自嗜抑制剂对肿瘤细胞活性的影响。多年来,氯喹在临床上一直被用于疟疾的治疗,其药效安全,是理想的自嗜抑制剂。一些研究报道,氯喹还具有抗肿瘤的良好效果。总之,本研究表明FTS除了能抑制细胞生长外,还能诱导保护性的自嗜并激活凋亡通路,氯喹抑制自嗜将增强FTS诱导的凋亡,这为肿瘤治疗提供了一种新的途径。
[1] Vigil D,Cherfils J,Rossman KL,et al.Ras superfamily GEFs and GAPs:validated and tractable targets for cancer therapy[J].Nat Rev Cancer,2010,10(12):842-857.
[2] Jagannath C,Lindsey DR,Dhandayuthapani S,et al.Autophagy enhances the efficacy of BCG vaccine by increasing peptide presentation in mouse dendritic cells[J].Nat Med,2012,15:267-276.
[3] Ogier-Denis E,Codogno P.Autophagy:a barrier or an adaptive response to cancer.Biochim Biophys Acta[J].2013,603:113-128.
[4] 李博,姜秀秀,曹晶,等.自噬与非小细胞肺癌对吉非替尼耐药关系的实验研究[J].国现代生物医学进展,2014,14(27):5204-5206.
[5] Jiang M,Liu K,Luo J,et al.Autophagy is a renoprotective mechanism during in vitro hypoxia and in vivo ischemia-reperfusion injury[J].Am J Pathol,2011,176:1181-1192.
[6] Yang S,Wang X,Contino G,et al.Pancreatic cancers require autophagy for tumor growth[J].Genes Dev,2012,25(7):717-729.
[7] Lock R,Roy S,Kenific CM,et al.Autophagy facilitates glycolysis during Ras-mediated oncogenic transformation[J].Mol Biol Cell,2011,22(2):165-178.
[8] Mathew R,Karp CM,Beaudoin B,et al.Autophagy suppresses tumorigenesis throμgh elimination of p 62[J].Cell,2009,137(6):1062-1075.
[9] Debnath J,Baehrecke EH,Kroemer G.Does autophagy contribute to cell death?[J].Autophagy,2010,1(2):66-74.
[10] Liu EY,Ryan KM.Autophagy and cancer - issues we need to digest[J].J Cell Sci,2012,125:2349-2358.

