分散固相萃取净化-超高效液相色谱-串联质谱法测定鸡蛋和鸡肉中金刚烷胺和金刚乙胺残留
林 涛, 樊建麟, 刘兴勇, 陈兴连, 李彦刚, 刘宏程*
(1. 云南省农业科学院质量标准与检测技术研究所, 云南 昆明 650223; 2. 农业部农产品质量安全风险评估实验室(昆明), 云南 昆明 650223)
研究论文
分散固相萃取净化-超高效液相色谱-串联质谱法测定鸡蛋和鸡肉中金刚烷胺和金刚乙胺残留
林 涛1,2, 樊建麟1, 刘兴勇1, 陈兴连1, 李彦刚1, 刘宏程1,2*
(1. 云南省农业科学院质量标准与检测技术研究所, 云南 昆明 650223; 2. 农业部农产品质量安全风险评估实验室(昆明), 云南 昆明 650223)
建立了鸡蛋和鸡肉中金刚烷胺和金刚乙胺残留量的分散固相萃取-超高效液相色谱-串联质谱测定方法。鸡蛋和鸡肉样品经氨水-乙腈(2∶98, v/v)提取后,提取液经氮气吹干至1 mL后,利用C18和NH2填料进行分散固相萃取净化,过滤膜后分析。采用ZORBAX C18色谱柱分离,用1 mmol/L乙酸铵水溶液(含0.1%(v/v)甲酸)-甲醇作为流动相进行梯度洗脱,正离子多反应监测模式。结果表明,金刚烷胺和金刚乙胺在0.15~10.0 μg/L范围内具有较好的线性关系,鸡蛋和鸡肉中的检出限均为0.05 μg/kg,定量限均为0.20 μg/kg。当2种药物在鸡蛋和鸡肉中的加标水平为0.2、1.0和2.0 μg/kg时,平均回收率范围为89%~108%,相对标准偏差范围为5.0%~8.6%。该方法能够满足鸡蛋和鸡肉中金刚烷胺和金刚乙胺残留量分析的要求。
分散固相萃取;超高效液相色谱;串联质谱;金刚烷胺;金刚乙胺;鸡蛋;鸡肉
金刚烷胺(amantadine)和金刚乙胺(rimantadine)都属于金刚烷胺类药物(化学结构如图1所示),其结构中都含有对称的3个6元环,其C-C键的键长为0.154 nm,具有较高的对称性,使其能够在晶格中紧密堆积而具有较好的稳定性。熔点较高,约为200~210 ℃。同时在其结构中还含有氨基,呈现出一定的碱性,常温条件下为白色至淡黄色粉末,易溶于有机溶剂,不溶于水[1,2]。

图1 金刚烷胺和金刚乙胺的化学结构Fig.1 Chemical structures of amantadine and rimantadine
金刚烷胺和金刚乙胺是最早用于抑制人类流感病毒的药物[3],随后又广泛用于禽类流感的治疗,对于流感的预防和治疗效果较好,但是禽类体内过量残留的金刚烷胺类药物会对机体的神经系统产生较大的危害,再加上耐药性的日趋严重[4,5],因此美国食品药品监督管理局(FDA)在2006年已经禁止了金刚烷胺类药物在畜禽中的使用,而我国农业部也在2005年就已经规定了禁止在畜禽养殖中使用金刚烷胺类药物,且不得检出。但目前违法使用金刚烷胺类药物的现象仍然时有发生,这对于我国消费者的身体健康、畜禽及其产品的出口贸易都将造成很大的影响。
金刚烷胺类药物残留的测定方法主要包括气相色谱[6,7]和液相色谱[8,9]等,这些方法操作复杂,通常都需要衍生化反应,耗时费力。近年来,高效液相色谱-三重四极杆质谱因其分析速度快、灵敏度高、定性准确等而广泛地应用于农兽药残留的检测中[10-12],也大量应用于畜禽及其产品中金刚烷胺类药物的快速筛查和测定[13-15]。利用高效液相色谱-串联质谱对畜禽及其产品中金刚烷胺类药物的测定过程中,常采用固相萃取小柱对其进行富集净化[16,17],固相萃取小柱法作为经典的样品前处理方法,对于金刚烷胺类药物的净化富集效果较好,但是利用固相萃取柱对于金刚烷类的净化步骤较为复杂,所需的洗脱溶剂复杂,需要多种溶剂首先对固相萃取柱进行活化后上柱,然后再使用多种溶剂洗脱杂质后才能对目标化合物进行洗脱,且使用的固相萃取小柱通常为价格昂贵的离子交换柱,对于常规的筛查测定不具有普遍性;另一方面,我国畜禽及其产品中的金刚烷胺类药物残留的测定方法目前尚没有国家标准,不利于相关部门对畜禽及其产品中金刚烷胺类药物的监管。因此,利用常规的净化填料,采用便捷简单的分散固相萃取法,建立简单快速、能够广泛推广应用的金刚烷胺类药物残留的测定方法,具有十分重要的意义。本研究以鸡蛋和鸡肉为研究对象,优化了分散固相萃取的条件以及色谱、质谱等相关条件,以建立快速准确的测定方法,为畜禽及其产品中金刚烷胺类药物测定标准的建立提供理论依据和实验基础。
1 实验部分
1.1 仪器与试剂
1290超高效液相色谱仪(美国Agilent公司); ZORBAX RRHD色谱柱 (50 mm×2.1 mm, 1.8 μm,美国Agilent公司); API4000三重四极杆质谱仪(美国AB公司);涡旋振荡器(美国Thermo Scientific公司); AE100电子分析天平(瑞士Mettler Toledo公司); TGL-15B型高速台式离心机(上海安亭科学仪器厂); N-EVAP型氮吹仪(美国Organomation公司)。
金刚烷胺、金刚乙胺(纯度≥97%,美国Sigma公司);氨水(分析纯,含量25%~28%,国药集团化学试剂上海有限公司);甲醇、乙腈(色谱纯,德国Merck公司);甲酸、乙酸(色谱纯,美国Sigma公司);无水MgSO4(分析纯,国药集团化学试剂北京有限公司);纯净水(杭州娃哈哈公司); ProElut C18、PSA、NH2、Florisil填料(50 μm,中国迪马科技)。
1.2 标准溶液及相关溶液配制
分别称取适量的金刚烷胺和金刚乙胺标准物质,用乙腈稀释成1 000 mg/L的标准储备液。再分别准确吸取1 mL标准储备液于容量瓶中,用乙腈定容至25 mL,得到40 mg/L的金刚烷胺和金刚乙胺混合标准溶液,低温下避光保存。
氨水-乙腈(2∶98, v/v)溶液:取2 mL氨水于100 mL容量瓶中,用乙腈定容至100 mL,混匀,现配现用。
1.3 样品处理
鸡蛋样品去壳后用组织捣碎机搅拌混匀(鸡肉样品去毛、去皮后用组织捣碎机搅拌混匀),称取2 g(精确至0.01 g)鸡蛋或鸡肉样品于50 mL离心管中,加入10.0 mL氨水-乙腈(2∶98, v/v)溶液,涡旋提取3 min, 5 000 r/min下离心5 min后将上清液转移至10 mL刻度试管中,氮吹仪吹至1 mL,分别加入20 mg C18填料、30 mg NH2填料和150 mg无水MgSO4,涡旋提取15 s,混合液过0.22 μm滤膜,待分析。
1.4 色谱条件
流动相A为甲醇,B为1 mmol/L乙酸铵水溶液(含0.1%(v/v)甲酸);流速:0.2 mL/min;柱温:35 ℃;进样量:1 μL;梯度洗脱程序:0.00~3.00 min, 20%A~95%A; 3.00~4.00 min, 95%A; 4.00~4.20 min, 95%A~20%A; 4.20~6.00 min, 20%A。
1.5 质谱条件
离子源:ESI源;扫描方式:正离子扫描;GS1 55 L/min, GS2 55 L/min,气帘气20 L/min;辅助加热气温度650 ℃,喷雾电压5 500 V;监测模式:MRM。
2 结果与讨论
2.1 质谱和色谱条件的优化
文献中对于金刚烷胺和金刚乙胺的检测离子对的报道已经较多,但是不同质谱仪的结构及设计不同,相关的电压各不相同。在质谱分析中,对于化合物的电离影响较大的主要包括了去簇电压(DP)和碰撞电压(CE)。当DP高时,化合物可能在源内分解或碎裂,且高的DP值会导致多电荷离子比例低,多聚体也减少;而当DP低时,母离子丰度相对提高,灵敏度也会相应提高,使得谱图简单。当CE过高时,会产生过多的碎片,使得二级质谱信息过多而复杂;当CE过低时,则会产生大碎片和母离子,使得二级质谱信息较少。因此,本实验中参照文献[18]中的离子对,利用针泵进样,分别对DP和CE等进行了优化,优化后的离子对及其相关参数如表1所示,同时根据所得的离子对信息对金刚烷胺和金刚乙胺的断裂方式做了初步推断(见图2)。

表1 金刚烷胺和金刚乙胺的相关质谱参数
* Quantitative ion.
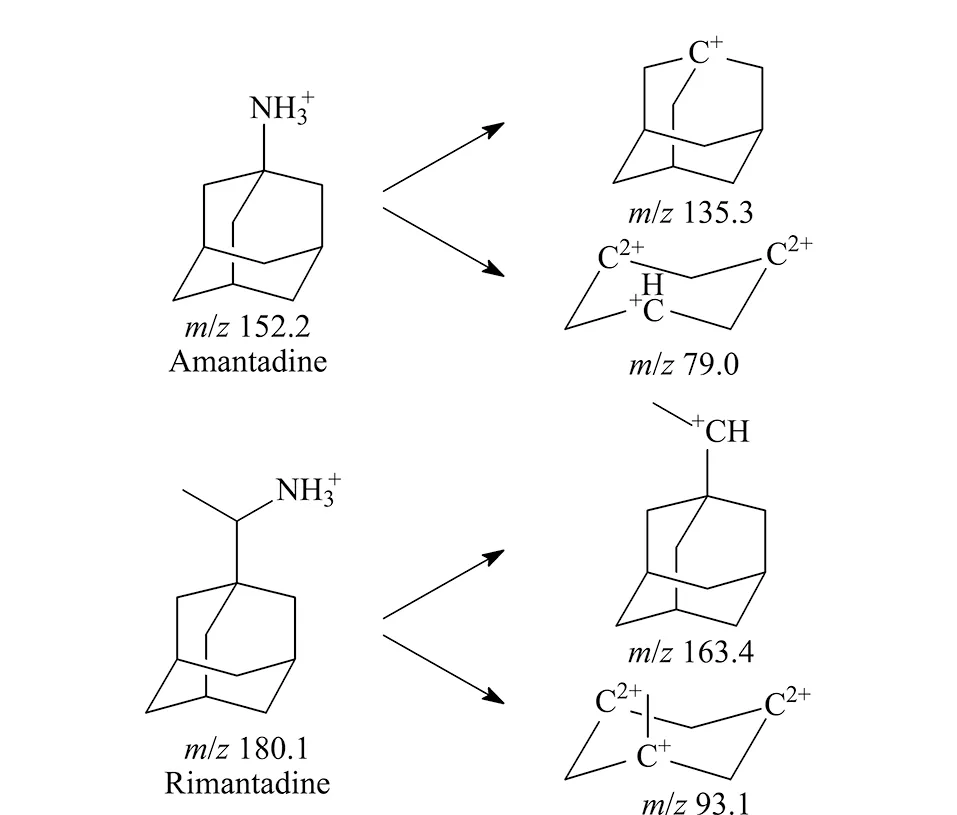
图2 金刚烷胺和金刚乙胺可能的断裂方式Fig.2 Possible fragmentation patterns of amantadine and rimantadine
金刚烷胺和金刚乙胺中都带有一个氨基,呈现出一定的碱性,本研究中首先采用了常用的乙腈-水溶液作为色谱的流动相,但结果表明,金刚烷胺和金刚乙胺在C18色谱柱上峰形较差,拖尾严重,基线噪声较大,图3a为乙腈-水溶液作为流动相的色谱图;当在水相中加入了0.1%(v/v)的甲酸后,金刚烷胺和金刚乙胺在C18色谱柱上峰形较好、无拖尾现象,且基线噪声明显降低,图3b为乙腈-0.1%(v/v)甲酸水溶液作为流动相的色谱图,推测甲酸的加入能够在一定程度上中和氨基的碱性,从而提高其在C18柱上的保留行为;另一方面,在正离子模式下,乙酸铵的加入可抑制目标化合物[M+Na]+峰的形成,从而促进[M+H]+峰的形成,在进行子离子碎片扫描时可以得到较强的碎片;同时乙酸铵的加入还能够调节溶液的离子强度,使色谱峰形更对称,也提高了化合物的响应。因此,本研究在水相中加入了1 mmol/L的乙酸铵,金刚烷胺和金刚乙胺都达到了较好的响应值。

图3 金刚烷胺和金刚乙胺在不同流动相中的色谱图Fig.3 Chromatograms of amantadine and rimantadine in different mobile phases a. acetonitrile-water; b. acetonitrile-0.1%(v/v) formic acid.
实验中还比较了甲醇和乙腈作为流动相的色谱峰形,结果表明,采用甲醇作为流动相时,对于金刚乙胺的影响不大,但是可以明显地改善金刚烷胺的峰形,使其由原来的宽峰变为对称的尖峰,如图4所示。因此实验最终选择了1.4节的流动相条件。

图4 金刚烷胺和金刚乙胺在甲醇和乙腈中的色谱图Fig.4 Chromatograms of amantadine and rimantadine in methanol and acetonitrile a. amantadine in acetonitrile; b. rimantadine in acetonitrile; c. amantadine in methanol; d. rimantadine in methanol.
2.2 提取溶剂的选择
本研究选择鸡蛋作为实验对象,首先比较了纯乙腈、甲酸-乙腈(1∶99, v/v)、乙酸-乙腈(1∶99, v/v)和氨水-乙腈(1∶99, v/v)对于金刚烷胺和金刚乙胺的提取效果,结果表明氨水-乙腈(1∶99, v/v)溶液对于两种化合物的提取效果最好,平均提取率分别达到了103%和92%,比其他提取溶液的提取率高,原因可能为金刚烷胺和金刚乙胺的化学结构中都带有氨基,呈现出一定的碱性,氨水-乙腈的碱性环境可抑制金刚烷胺和金刚乙胺的电离,使得目标化合物在乙腈中的分配系数增加,从而提高了提取效率。
其次,比较了氨水-乙腈(0.5∶99.5, v/v)、氨水-乙腈(1∶99, v/v)、氨水-乙腈(2∶98, v/v)和氨水-乙腈(4∶96, v/v)对于金刚烷胺和金刚乙胺的提取效果,如图5所示,氨水-乙腈(2∶98, v/v)和氨水-乙腈(4∶96, v/v)溶液具有较好的提取效果,由于氨水的挥发性较大,且刺激性较强,不利于实验操作者的身体健康,因此,选择氨水-乙腈(2∶98, v/v)溶液作为提取溶液。

图5 氨水与乙腈的体积比对金刚烷胺和金刚乙胺提取率的影响Fig.5 Effect of volume ratio of ammonium hydroxide and acetonitrile on extraction rate for amantadine and rimantadine
2.3 净化填料的选择
在本实验中,首先考察了将提取溶液浓缩后直接进样分析的效果,结果表明,金刚烷胺和金刚乙胺的平均回收率均大于130%,可能存在一定的基质增强效应,同时经浓缩后的提取溶液颜色较深,且含有少量的脂肪和蛋白质等干扰物质,不利于质谱分析。因此,本实验中选择在浓缩后的提取溶液中加入净化填料,以期得到较好的净化效果。
在农兽药残留分析中,常用的净化填料主要有C18、Florisil、NH2和PSA等,本研究中比较了上述4种填料对于金刚烷胺和金刚乙胺的净化效果。分别在1 mL的浓缩提取液中加入50 mg填料和150 mg无水MgSO4,结果表明,4种填料的加入都能够使金刚烷胺和金刚乙胺的提取率保持在70%~110%之间,都能够满足净化的要求;而通过提取率的比较可知,C18和NH2填料对于金刚烷胺和金刚乙胺的净化效果较好,提取率都在100%左右,可以对提取溶液中的杂质等干扰物质进行有效的吸附,且对于目标化合物的吸附较小;而Florisil和PSA填料相对于C18和NH2填料的提取率稍差,对于金刚烷胺和金刚乙胺具有一定程度的吸附,影响了提取效率。因此,选择C18和NH2的混合填料作为本实验的净化填料。
另一方面,本实验以C18和NH2作为混合净化填料进行实验,在1 mL浓缩提取液中加入150 mg无水MgSO4,并加入50 mg C18和NH2的混合填料,比较了C18和NH2的质量比分别为1∶4、2∶3、1∶1、3∶2、4∶1时对于金刚烷胺和金刚乙胺的净化效果,如图6所示,对于金刚烷胺,当C18和NH2的质量比为1∶4、2∶3和1∶1时,提取效果较好,而当C18和NH2的质量比为2∶3和3∶2时,对于金刚乙胺的提取效果较好。因此,选择C18和NH2的质量比为2∶3,对于两种化合物的提取效果都较好。
2.4 线性范围和检出限
将金刚烷胺和金刚乙胺的标准溶液稀释成不同的浓度,以定量离子的峰面积对其各自的浓度进行线性回归;同时利用鸡蛋空白基质进行检出限和定量限的考察,以3倍和10倍信噪比来确定金刚烷胺和金刚乙胺的检出限和定量限。如表2所示,金刚烷胺和金刚乙胺的相关系数(R2)较好,检出限较低,能够满足兽药残留的测定要求。
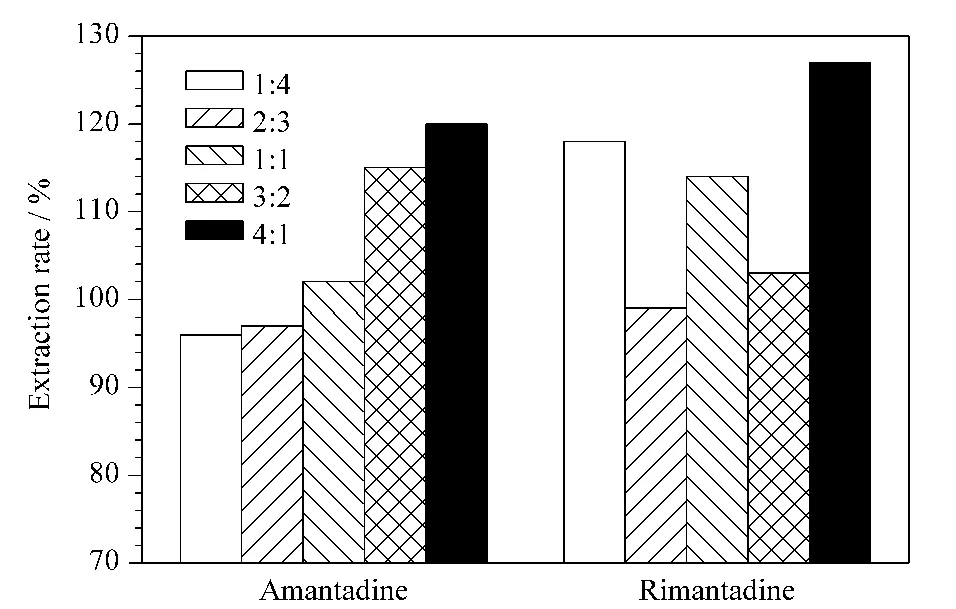
图6 C18与NH2的质量比对金刚烷胺和金刚乙胺提取率的影响Fig.6 Effect of mass ratio of NH2 to C18 on the extraction rate for amantadine and rimantadine

表2 金刚烷胺和金刚乙胺的线性范围、线性方程、相关系数(R2)、检出限和定量限
y: peak area of quantitative ion;x: mass concentration, μg/L.
2.5 回收率和精密度
分别采用鸡蛋和鸡肉的空白基质,根据金刚烷胺和金刚乙胺的定量限,分别以1倍、5倍、10倍定量限作为添加浓度进行回收率试验,每个试验对象做6次平行试验,计算其平均回收率。通过表3可知,金刚烷胺和金刚乙胺的平均回收率范围为89%~108%,相对标准偏差范围为5.0%~8.6%,符合兽药残留测定的要求。
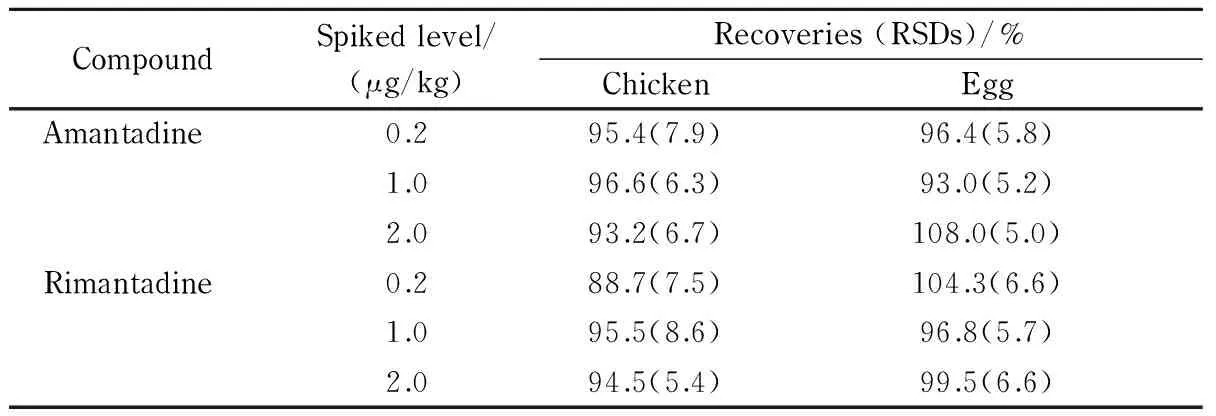
表3 金刚烷胺和金刚乙胺的加标回收率和相对标准偏差(n=6)
3 结论
本文建立了分散固相萃取-超高效液相色谱-串联质谱快速测定鸡蛋和鸡肉中金刚烷胺和金刚乙胺残留的方法。以氨水-乙腈(2∶98, v/v)作为提取溶液,C18和NH2混合填料净化,采用优化后的MRM模式,外标法定量,能够快速完成鸡蛋和鸡肉中金刚烷胺和金刚乙胺的定性和定量分析,具有较好的准确度和精确度,适合鸡蛋和鸡肉中金刚烷胺和金刚乙胺的快速分析测定。
[1] Liu D, Fan Z C, Zhang Y, et al. China Pharmacist (刘丹, 范子宸, 张瑛, 等. 中国药师), 2009, 12(11): 1640
[2] Gao Z, Wang Y, Su X M, et al. Guangzhou Chemistry (高治, 王艳, 苏晓明, 等. 广州化学), 2004, 29(4): 59
[3] Ai L F, Ma Y S, Chen R C, et al. Chinese Journal of Analytical Chemistry (艾连峰, 马育松, 陈瑞春, 等. 分析化学), 2013, 41(8): 1194
[4] Chen Y W, Shieh J P, Chen Y C, et al. Eur J Pharmacol, 2012, 693(1/2/3): 25
[5] Guay D R P. Drugs & Aging, 1994, 5(1): 8
[6] Lou Y J, Chen S, Tao Q F. Chinese Journal of Pharmaceutical Analysis (楼永军, 陈爽, 陶巧凤. 药物分析杂志), 2011, 31(3): 493
[7] Rakestraw D. J Pharm Biomed Anal, 1993, 11(8): 699
[8] Zhang L Y, Wang K, Qian Y X. Chinese Journal of Pharmaceutical Analysis (张芦燕, 王坤, 钱一鑫. 药物分析杂志), 2012, 32(1): 159
[9] Higashi Y, Uemori I, Fujii Y. Biomed Chromatogr, 2005, 19(9): 655
[10] Cao Y F, Kang J, Chang Q Y, et al. Chinese Journal of Chromatography (曹亚飞, 康健, 常巧英, 等. 色谱), 2015, 33(2): 132
[11] Meng X, Xie S H, Xie S T, et al. Journal of Analytical Science (孟霞, 谢世红, 谢世涛, 等. 分析科学学报), 2015, 31(2): 208
[12] Peng X T, Hu X Z, Shen J, et al. Journal of Analytical Science (彭西甜, 胡西洲, 沈菁, 等. 分析科学学报), 2014, 30(4): 572
[13] Arndt T, Guessregen B, Hohl A, et al. Clin Chim Acta, 2005, 359(1/2): 125
[14] Zhao S, Li D, Qiu J, et al. Anal Methods, 2014, 6(17): 7062
[15] Li N, Zhang Y T, Liu L, et al. Chinese Journal of Chromatography (李娜, 张玉婷, 刘磊, 等. 色谱), 2014, 32(12): 1313
[16] Yun H, Cui F Y, Yan H, et al. Chinese Journal of Chromatography (云环, 崔凤云, 严华, 等. 色谱), 2013, 31(8): 724
[17] Chen H H, Wei M Y, Zhou W, et al. Journal of Chinese Mass Spectrometry Society (陈慧华, 韦敏珏, 周炜, 等. 质谱学报), 2013, 34(4): 226
[18] Yi X B, Qiu L Q, Liu S Q, et al. Journal of Instrumental Analysis (易锡斌, 裘立群, 刘世琦, 等. 分析测试学报), 2015, 34(3): 346
2016第十届中国科学仪器发展年会(ACCSI 2016)第一轮通知
“2016第十届中国科学仪器发展年会(Annual Conference of China Scientific Instruments 2016,简称ACCSI 2016)”,将于2016年4月22日在北京隆重召开。
第十届ACCSI 2016将继续秉承“科学仪器行业的达沃斯”论坛的高端定位,以研究和探讨科学仪器行业以及相关产业现状、追踪发展趋势、促进行业交流为宗旨。
在“新一代信息技术与制造业深度融合”的大趋势下,作为“立国之本、科技强国之基”的科学仪器行业有哪些新趋势、新热点、新应用,是业界管理者共同关心的问题。在国家十三五的开局之年,会议将邀请业内专家、行业领袖深度解读过去10年科学仪器行业发展的经验,与科学仪器制造企业管理者、研发者一起,从运营、技术、和市场角度,共同探讨科学仪器行业趋势、新机遇以及如何抓住机遇。
主办单位:
中国仪器仪表行业协会
中国仪器仪表学会
中国仪器仪表学会分析仪器分会
仪器信息网(www.instrument.com.cn)
协办单位:
首都科技条件平台
我要测网(www.woyaoce.cn)
年会网站:
http://accsi.instrument.com.cn
会务组联系方式:
电话:4000074077 传真:(010)82051730
会议赞助:(010)51654077-8044齐先生
报名参会:(010)51654077-8055杜女士
E-mail:accsi@instrument.com.cn
仪器信息网 供稿
Determination of amantadine and rimantadine residues in egg and chicken samples by dispersive solid phase extraction purification-ultra high performance liquid chromatography-tandem mass spectrometry
LIN Tao1,2, FAN Jianlin1, LIU Xingyong1, CHEN Xinglian1, LI Yangang1, LIU Hongcheng1,2*
(1.InstituteofQualityStandards&TestingTechnique,YunnanAcademyofAgriculturalScience,Kunming650223,China; 2.LaboratoryofQuality&SafetyRiskAssessmentforAgro-Products(Kunming),MinistryofAgriculture,Kunming650223,China)
A method was developed for the determination of residual amantadine and rimantadine in eggs and chickens by dispersive solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry. Egg and chicken samples were extracted with ammonia water-acetonitrile (2∶98, v/v). The extraction solution was dried to 1 mL under nitrogen, and then purified by dispersive solid phase extraction method with C18 and NH2sorbents. After purification, the extraction solution was filtered through a filter. The target compounds were analyzed by ultra high performance liquid chromatography-tandem mass spectrometry (UHPLC-MS/MS) on a ZORBAX C18 column using a mixture of 1 mmol/L ammonium acetate solution (containing 0.1% (v/v) formic acid) and methanol as mobile phases with gradient elution. The mass spectrometer was operated under multiple reaction monitoring (MRM) mode in positive mode. The good linearities were obtained for amantadine and rimantadine at a concentration range of 0.15-10.0 μg/L. The limits of detection for amantadine and rimantadine were all 0.05 μg/kg, and the limits of quantification were 0.20 μg/kg. The recoveries of amantadine and rimantadine in eggs and chickens at three spiked levels (0.2, 1.0 and 2.0 μg/kg) were in the range of 89%-108% with the relative standard deviations of 5.0%-8.6%. The results demonstrated that the method is suitable for the determination of amantadine and rimantadine in eggs and chickens.
dispersive solid phase extraction; ultra high performance liquid chromatography (UHPLC); tandem mass spectrometry (MS/MS); amantadine; rimantadine; eggs; chickens
10.3724/SP.J.1123.2015.08010
云南省社会发展科技计划项目(2013RA012);云南省应用基础研究计划青年项目(2013FD064);云南省科技创新平台建设计划项目(2014DA001).
2015-08-09
O658
:A
:1000-8713(2015)11-1169-06
*通讯联系人.E-mail:liuorg@163.com.