北黄海微表层细菌丰度与可培养细菌群落结构分析
樊景凤,明红霞,王小慧,李洪波,石峰,3,穆贵强,赵顺
(1.国家海洋环境监测中心,辽宁 大连 116023;2. 国家海洋局近岸海域生态环境重点实验室,辽宁 大连 116023;3. 南开大学 环境科学与工程学院,天津 300071)
北黄海微表层细菌丰度与可培养细菌群落结构分析
樊景凤1,2,明红霞1,2,王小慧1,2,李洪波1,2,石峰1,2,3,穆贵强1,2,赵顺1,2
(1.国家海洋环境监测中心,辽宁 大连 116023;2. 国家海洋局近岸海域生态环境重点实验室,辽宁 大连 116023;3. 南开大学 环境科学与工程学院,天津 300071)
为分析海洋微表层这一特殊生境中的细菌类群,于2010—2011年4个航次对北黄海微表层和次表层海水中的总菌丰度、可培养细菌丰度和群落结构进行了分析。采用流式细胞仪测定总菌丰度,平板计数法测定可培养细菌丰度,PCR-16S rDNA分析可培养细菌的群落结构。结果表明,调查海域微表层海水总菌均值为1.76×106cell/mL,次表层海水总菌均值为1.07×106cell/mL。可培养细菌丰度范围是1.00×102~1.70×106CFU/mL,微表层和次表层可培养细菌所占总菌数量的百分比分别为13.05%和0.45%。微表层对总菌的富集因子(EF)均值为2.02,可培养细菌的EF均值为74.16。PCR-16S rDNA序列分析结果表明,该海域可培养细菌分属变形菌门(Proteobacteria)(94.34%)、厚壁菌门(Firmicutes)(1.89%)、拟杆菌门(Bacteroidetes)(1.89%)和放线菌门(Actinobacteria)(1.89%)4个类群。本研究初步发现,微表层对细菌具有较强的聚集作用,尤其对可培养细菌聚集作用更为明显。微表层中可培养细菌的群落结构与次表层有所不同,其种类丰富,来源和功能多样。由此可见,微表层独特的生境成就了其独特的微生物类群,其生态功能有待于进一步研究。
微表层;次表层;总菌;可培养细菌;群落结构
1 引言
微表层(surface microlayer,SML)是指大气和水体之间位于水-气交换界面的厚度为1~1 000 μm的微生境,为加以区分,将微表层以下0.5 m内的水层定义为次表层(subsurface layer,Sub-)[1]。微表层被认为是大气沉降物的汇,相对于次表层,其物理、化学和生物过程明显不同[2]。栖息在微表层水中的微生物受到有利因素(如高浓度的无机和有机营养)和不利因素(强烈光照、高浓度的重金属、有机污染、温度和盐度波动较大)的双重作用,形成了一个含有独特微生物物种和种群的特殊类群[3]。因此,海洋微表层研究已成为众多化学家、物理学家和生物学家所瞩目的学科前沿,国际上有关海洋微表层的研究已较丰富,有关微表层化学元素的富集作用、群落结构、细菌活性等研究逐渐被重视,研究内容正由微表层的物理化学性质转向微生物生态学方向发展[4—7]。我国学者已经在厦门港、渤海、热带太平洋海域、珠江口、南沙群岛等多个海域开展了微表层营养盐、有机物、痕量金属、化学性质等方面的系统研究[8—11],然而,到目前为止,有关微表层微生物生态学的研究尚未见报道。
不同的营养体系微表层的性质差别很大,如贫营养水域较富营养水域微表层对有机物浓度、微生物及其活性有相当大的富集[12],而且,污染区环境中微表层的细菌丰度和种类不同于非污染区[13]。由于北黄海具有特殊的地理位置和独特的冷水团现象,其海洋生态系统中的生物组成和群落结构稳定特征受到人们的广泛关注。而微生物群落作为该海域生态系统的重要组成部分,其群落结构和分布特征等相关研究亟待开展。基于此,本研究选取北黄海8个站位,在分析其微表层和次表层海水总菌和可培养细菌分布特征的基础上,构建可培养细菌16S rDNA系统发育树,探讨其可培养细菌群落的结构和分布特征,该研究将从一个全新的视角深层次理解该水域的生态系统结构和功能,也可为我国近海微生物资源及生态环境的研究提供理论依据。
2 材料与方法
2.1 样品采集
分别于2010年6月、8月和2011年3月和7月采集北黄海8个站位(图1)的微表层和次表层海水,样品采集时晴天,风速小于3级。
微表层水样采用玻璃板法[13]收集:采样前用75%的乙醇(体积比)洗涤玻璃板(规格为30 cm×40 cm×5 cm)和橡胶棒,而后用蒸馏水冲洗干净。采样时将平板玻璃垂直浸入水中,然后以20 cm/s左右的速度提起,用硅橡胶刮片自板的两面将水膜刮下,将微表层水样收集到灭菌的水样瓶中,约50 mL。为减少由蒸发带来的误差,玻璃板暴露在空气的时间要少于10 s。
次表层水样使用采水器收集,用采水器在海平面下0.5 m处采集水样200 mL,保存于4℃,运回实验室分析。
2.2 总菌计数
总菌用流式细胞仪进行计数[14],样品室温融化后,用市售的GenefinderTM染料(10 000∶1)染色,室温下黑暗处理10~15 min。用流式细胞仪(BD Aria I),在蓝色激发光488 nm下(15 mW氩激光),用绿色滤光片[波长(530±15)nm]测量。阈值设在绿色荧光FITC上,加入1 μm 标准微球做内参。
2.3 可培养细菌计数及革兰氏染色
采用平板培养法计数微表层和次表层海水中的可培养细菌总数。在取样后的1 h内接种于海洋琼脂(Marine Agar)2216E(Difco)培养基,每个水样设2个稀释度,各3个重复,每个稀释度取100 μL样品均匀涂布,所有培养基于25℃倒置培养1~2周后记菌落数。
对纯化后的细菌进行革兰氏染色,并对所获得细菌进行初步筛选和鉴定。
2.4 可培养细菌的分子鉴定
2.4.1 模板制备
根据菌落形态、大小、颜色、透明度、边缘是否光滑和菌落是否湿润等特征挑选菌落,然后用TIANGEN细菌基因组提取试剂盒提取总DNA,作为聚合酶链反应(PCR)的模板。
2.4.2 细菌16S rDNA的PCR扩增
选择细菌16S rDNA通用引物27 F(5′-AGA GTT TGA TCC TGG CTC AG-3′)和1 492 R(5′-GGT TAC CTT GTT ACG ACT T-3′)进行序列扩增,扩增产物片段约1 460 bp。反应采用50 μL体系,同时设置阴性对照,反应条件参照前期研究[15]。电泳检测后,将PCR产物送宝生物工程(大连)有限公司进行序列测定。
2.5 数据处理与分析
2.5.1 流式数据处理
利用Win MDI 2.9软件对测定结果进行分析。以488 nm激光光源为激发光,以FITC、SSC、PerCP-Cy5-5-H和PE-H为坐标进行分析。FITC(异硫氰酸荧光素)被488 nm激发,在530 nm发出绿色荧光;SSC(Side light Scatter)为侧散射光,其强度与细胞的表面和内部结构及其大小和形状有关,有时专指粒度信号;PE(藻红蛋白)在575 nm激发呈现橙黄色,PerCP(多甲藻黄素叶绿素蛋白)在675 nm激发发出深红色光。
2.5.2 构建系统发育树
为进一步弄清北黄海可培养细菌的多样性和群落结构,将测序结果提交Genbank进行检索,利用BLAST功能(http://www.ncbi.nlm.nih.gov/BLAST/)进行DNA序列匹配,得到各序列与已知细菌序列同源性的比对结果,采用clustalx1.83和MEGA 3.1对测得的DNA序列进行聚类分析,用邻接法(Neighbor Joining,NJ)构建系统发生树,进行系统发育分析。
3 结果
3.1 北黄海表层和微表层海水中总菌数量分布
经流式细胞仪测得海水中总菌的数量,最小值出现在2010年6月份B1站位的次表层,为1.75×105cell/mL;最大值出现在2011年7月份BY5站位的微表层,为4.57×106cell/mL;各时段各站位微表层海水中的总菌数均高于翌表层海水中的总菌数。微表层总菌数量在2010年8月份达到最高值,翌年3月份降低,7月份又回升;次表层2010年6月、8月和来年3月总菌数量变化不大,翌年7月份升高,达到4个月份的最高值(图2)。
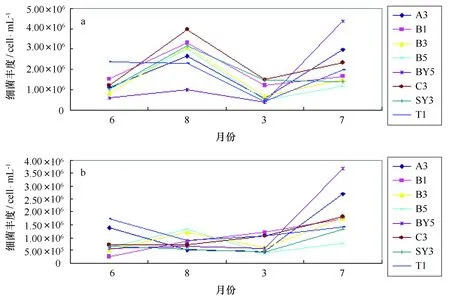
图2 微表层(a)和次表层(b)海水中总菌数量变化趋势Fig.2 The change trend of the total bacteria number in surface microlayer(a) and subsurface layer(b) seawater
3.2 北黄海微表层和次表层海水中可培养细菌的数量分布
各站位海水中可培养细菌的数量变化范围为1.00×102~1.70×106CFU/mL,最小值出现在2011年7月份B1站位的次表层,最大值出现在2010年8月份B3站位的微表层;微表层和次表层可培养细菌数最大值均出现在2010年8月份的航次中,微表层可培养细菌数量高于次表层2个数量级;除离岸最远的A3站位微表层外,其他站位可培养细菌数量在2010年8月份达到高峰后,在翌年3月份降低,继而7月份又有所回升(图3)。整体而言,微表层和次表层海水中可培养细菌的数量变化受温度影响较大。

图3 微表层(a)和次表层(b)可培养细菌数量变化趋势Fig.3 The change trend of the culturable bacteria number in surface microlayer(a) and subsurface layer(b) seawater
3.3 可培养百分比
本研究中,4个航次采集的海水可培养细菌占总菌数量的百分比(可培养百分比)范围为0.01%~86.79%,最小值出现在2011年7月份的B1站位的次表层,最大值出现在2011年3月份的A3站位的微表层;各时段各站位微表层海水中可培养细菌占总菌数量的百分比均高于次表层(表1)。

表1 微表层和次表层海水中可培养细菌占总菌数量的百分比Tab.1 The percentage of the number of culturable bacteria to total bacteria number in surface microlayer and subsurface layer seawater
3.4 富集因子变化
用富集因子(Enrichment Factor,EF)来评价微表层的富集作用。富集因子是指某一成分在微表层的浓度与它在次表层的浓度比值。在本研究中,微表层总菌的EF变化范围较小,为0.40~5.76,可培养细菌的EF变化范围较大,为0.59~500.00;2010年6月、2010年8月、2011年3月和2011年7月微表层可培养细菌的平均富集因子分别为43.41、139.54、91.02和22.67,其中2010年8月航次微表层可培养细菌的富集因子最高(表2)。

表2 微表层海水中总菌和可培养细菌的富集因子Tab.2 EF of the total bacteria and culturable bacteria in surface microlayer seawater
3.5 序列比对及系统发育分析
共分离出164株细菌,通过菌落形态、革兰氏染色、生理生化鉴定,最后确定53株细菌进行16S rDNA序列分析。53株细菌中,微表层中36株,次表层中17株。大部分细菌的16S rDNA序列与数据库中已知序列有较高相似性(不小于98%)(表3)。选取亲缘关系较近的菌种,采用NJ法构建系统发育树(见图4)。

表3 可培养细菌16S rDNA测序结果与GenBank中序列的比对结果Tab.3 The results of comparision between the culturable bacteria 16S rDNA sequences and the known sequences in Genbank

续表3

续表3
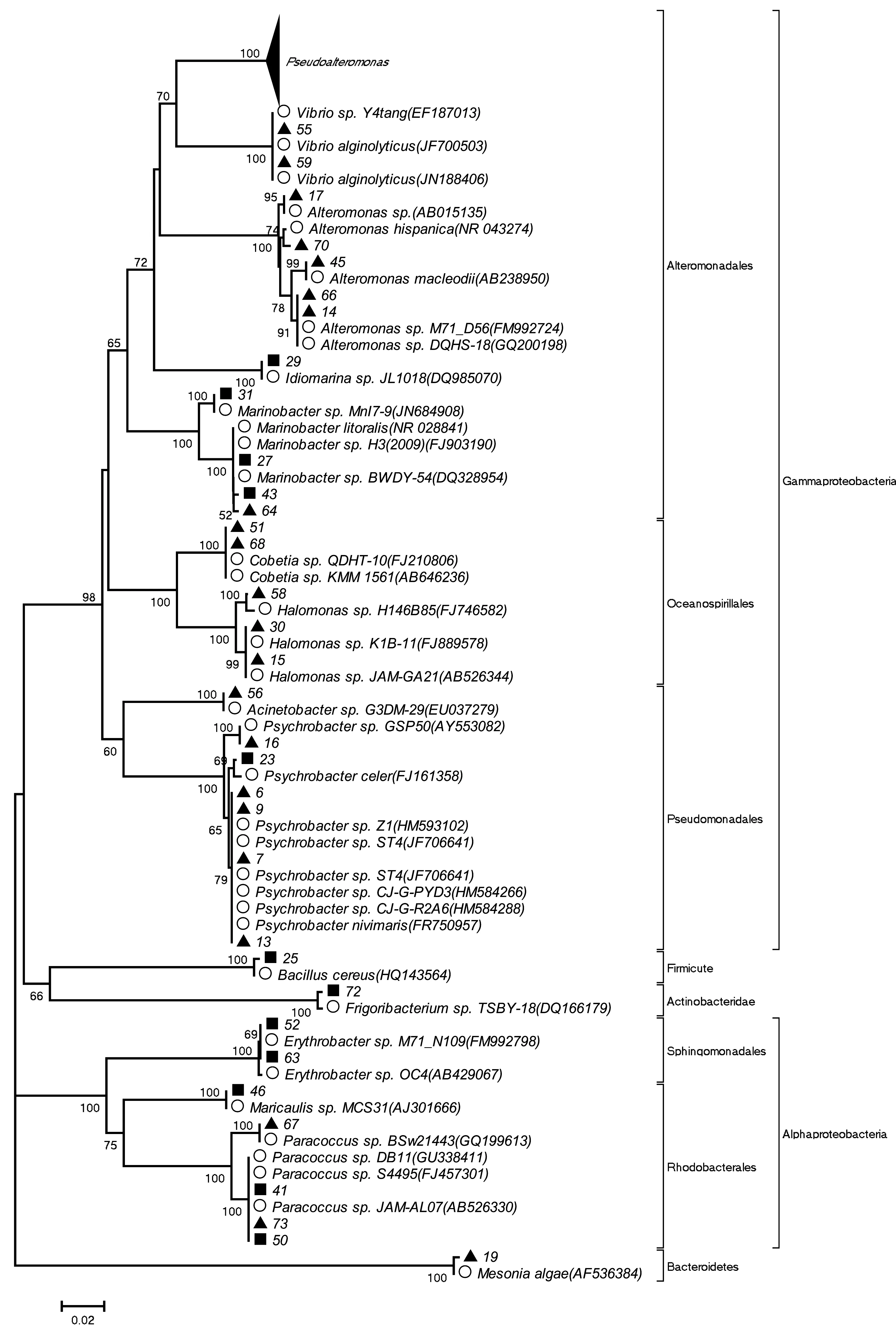
图4 可培养细菌系统发育树Fig.4 The phylogenetic tree of the culturable bacteria▲:微表层中分离到的细菌;■:次表层中分离到的细菌;○:数据库中已知序列▲:The isolated bacteria from surface microlayer;■:The isolated bacteria from subsurface layer;○:The known sequences in the Genbank
基于16S rDNA序列构建系统发育树,分析结果表明,53株细菌所测序列分属于变形菌门(Proteobacteria)(94.34%)、厚壁菌门(Firmicutes)(1.89%)、拟杆菌门(Bacteroidetes)(1.89%)和放线菌门(Actinobacteria)(1.89%)4个类群。在微表层中,变形菌门占97.2%(34/36),其中γ-变形菌纲(Gammaproteobacteria)占91.7%(33/36),α-变形菌纲(Alphaproteobacteria)占5.6%(2/36)。此外,拟杆菌门占2.8%(1/36);在次表层中,变形菌门占88.2%(15/17),其中γ-变形菌纲占58.9%(10/17),α-变形菌纲占29.4%(5/17),此外,厚壁菌门占5.9%(1/17),放线菌门占5.9%(1/17)。该海域所分离的53株菌中,γ-变形菌纲分属于9个属:5株属于交替单胞菌属(Alteromonas)、4株属于海杆菌属(Marinobacter)、1株属于Idiomarina、19株属于假交替单胞菌属(Pseudoalteromonas)、2株属于Cobetia、3株属于盐单胞菌属(Halomonas)、1株属于不动杆菌属(Acinetobacter)、6株属于冷杆菌属(Psychrobacter) 、2株属于弧菌属(Vibrio)。α-变形菌纲的细菌分属于3个属:4株分属于副球菌属(Paracoccus)、2株属于赤杆菌属(Erythrobacter)、1株属于Maricaulis。
4 讨论
比较微表层和次表层海水中总菌和可培养细菌数量可知,微表层对细菌具有一定的聚集作用。微表层海水中的总菌EF值较小,且变化范围较小,其原因可能是由于颗粒黏附细菌(particle-attached bacteria)无法被流式细胞仪识别并计数,但这类细菌在总细菌中占有相当大的比例[16]。与总菌相比,微表层海水中可培养细菌EF值较大,且变化范围也较大,其原因可能是在细菌培养计数前先进行细菌细胞分散,计数误差相对较小,从另一侧面也反映了微表层可能对可培养细菌具有很好的聚集作用,其独特的生境更利于其生存。微表层中可培养细菌富集的原因可以解释如下:(1)微表层中高浓度的溶解和胶体有机化合物为细菌的生长提供了能量与营养[14];(2)微表层中有“保护剂”来应对胁迫因子,如太阳辐射、高温或盐度变化、毒性有机物和重金属等胁迫[2,17]。
海洋微表层与大气直接接触,容易受到太阳辐射的影响,具备富集大量有机与无机物质等独特的自身条件,形成微表层独特的微生境,其细菌多样性较次表层更为丰富,并且有着更高的细菌活性[18]。在北黄海海域的微表层海水中发现某些菌株与硫酸盐还原菌、环硝铵降解菌、石油降解菌、抗紫外菌、烃降解菌、咔唑降解菌、反硝化细菌、多环芳烃降解菌、嗜冷菌、嗜盐菌等菌属有很高的相似性,且分离到与产胞外酶菌、产蛋白酶菌、产几丁质酶菌、产多饱和脂肪酸嗜盐菌等菌属相似性高的菌株,而这些细菌在次表层海水中没有被分离到,表明海洋微表层这一特殊生境中存在大量与生物地球化学循环相关的微生物。
在研究微表层海水细菌多样性的同时,可探讨其生物来源的问题,为微表层特殊细菌群落结构形成的原因提供一定的参考价值。本研究通过鉴定发现,微表层细菌来源多样化,相似性细菌分离于海洋、土壤、海底山、盐沼平原、海藻碎屑、红树林根部以及海产品等多种环境。目前有两种说法:一是认为微表层中生物体的源是由物理过程引起的生物体的向上传送而不是由原位发展起来的[19];另一种观点是微表层的微生物主要是外来的,微表层复杂多变的动态特征导致了外源生物的引入[5]。由本研究对可培养细菌的群落结构初步分析可知,北黄海微表层可培养细菌的来源更倾向于外源输入。整体而言,微表层中各种细菌的亲缘关系更为接近,次表层亦是,而微表层与次表层细菌总体的的亲缘关系要远一些。
5 结论
北黄海微表层对细菌具有较强的富集作用,微表层海水中的细菌群落结构独特;在微表层中,除1株细菌属于拟杆菌门外,分离得到的细菌都属于变形菌门,并且大部分属于变形菌门中的γ-变形菌纲;北黄海微表层中可培养细菌主要为外源输入。
[1] Liss P S,Duce R A. The sea surface and global change[M]. Cambridge: Cambridge University Press,1997: 10-35.
[2] Liss P S,Duce R A. The sea surface and global change[M]. Cambridge: Cambridge University Press,2005: 1-23.
[3] Maki J S. Neuston microbiology: life at the air-water interface[M]//Bitton G,Ed. Encyclopedia of Environmental Microbiology. New York: Wiley,2002: 2133-2144.
[4] Stolle C,Labrenz M,Meeske C,et al. Bacterioneuston community structure in the Southern Baltic Sea and its dependence on meteorological conditions[J]. Appl Environ Microb,2011,77(11): 3726-3733.
[5] Seliskar D M,Gallagher J L. Macrophyte disturbance alters aquatic surface microlayer structure, metabolism, and fate[J]. Oecologia,2014,174(3): 1007-1020.
[6] Sun Lu,Li Xin,Hede T,et al. Molecular dynamics simulations reveal the assembly mechanism of polysaccharides in marine aerosols[J]. Phys Chem Chem Phys,2014,16(47): 25935-25941.
[7] Taylor J D,Cottingham S D,Billinge J,et al. Seasonal microbial community dynamics correlate with phytoplankton-derived polysaccharides in surface coastal waters[J]. ISME J,2014,8(1): 245-248.
[8] Ya Miaolei,Wang Xinhong,Wu Yuling,et al. Enrichment and partitioning of polycyclic aromatic hydrocarbons in the sea surface microlayer and subsurface water along the coast of Xiamen Island, China[J]. Mar Pollut Bull,2014,78(1/2): 110-117.
[9] 王文涛,杨桂朋,于娟,等. 夏季黄海和渤海微表层和次表层海水中营养盐的分布特征[J]. 环境科学,2013,34(8): 2983-2991.
Wang Wentao,Yang Guipeng,Yu Juan,et al. Distributional characteristics of nutrients in the sea-surface microlayer and subsurface water of the Bohai and Yellow Sea in Summer[J]. Environmental Science,2013,34(8): 2983-2991.
[10] 陈金斯,李飞泳,朱卓洪. 珠江口水域微表层中的痕量金属[J]. 热带海洋,1994,13(3): 25-30.
Chen Jinsi,Li Feiyong,Zhu Zhuohong. Trace metals in the surface micro-layer of Zhujiang River Mouth[J]. Tropic Oceanology,1994,13(3): 25-30.
[11] 于志刚,张正斌,刘莲生. 海洋微表层化学研究进展[J]. 海洋环境科学,2000,19(3): 75-80.
Yu Zhigang,Zhang Zhengbin,Liu Liansheng. Study progresses on sea surface microlayer[J]. Marine Environmental Science,2000,19(3): 75-80.
[12] Vila-Costa M,Barberan A,Auguet J C,et al. Bacterial and archaeal community structure in the surface microlayer of high mountain lakes examined under two atmospheric aerosol loading scenarios[J]. FEMS Microbiol Ecol,2013,84(2): 387-397.
[13] Agogué H,Casamayor E O,Joux F,et al. Comparison of samplers for the biological characterization of the sea surface microlayer[J]. Limnol Oceanogr Meth,2004,2(7): 213-225.
[14] Marie D,Partensky F,Jacquet S,et al. Enumeration and cell cycle analysis of natural populations of marine picoplankton by flow cytometry using the nucleic acid stain SYBR Green I[J]. Appl Environ Microbiol,1997,63(1): 188-193.
[15] 樊景凤,张兰,明红霞,等. 北戴河近岸沉积物中微生物16S rDNA的PCR-RFLP分析[J]. 海洋环境科学,2008,27(5): 409-413.
Fan Jingfeng,Zhang Lan,Ming Hongxia,et al. PCR-RFLP analysis of bacteria 16S rDNA in marine sediment of Beidaihe[J]. Marine Environmental Science,2008,27(5): 409-413.
[16] Harvey R W,Young L Y. Enrichment and association of bacteria and particulates in salt marsh surface water[J]. Appl Environ Microbiol,1980,39(4): 894-899.
[17] Song Y K,Hong S H,Jang M,et al. Large accumulation of micro-sized synthetic polymer particles in the sea surface microlayer[J].Environ Sci Technol,2014,48(16): 9014-9021.
[18] Wurl O,Miller L,Röttgers R,et al. The distribution and fate of surface-active substances in the sea-surface microlayer and water column[J]. Mar Chem,2009,115(1/2): 1-9.
[19] Joux F,Agogué H,Obernosterer I,et al. Microbial community structure in the sea surface microlayer at two contrasting coastal sites in the northwestern mediterranean sea[J]. Aquat Microb Ecol,2006,42(1): 91-104.
Analysis on the bacterial abundance and community structure of culturable bacteria in the surface microlayer of the northern Yellow Sea
Fan Jingfeng1,2,Ming Hongxia1,2,Wang Xiaohui1,2,Li Hongbo1,2,Shi Feng1,2,Mu Guiqiang1,2,Zhao Shun1,2
(1.NationalMarineEnvironmentalMonitoringCenter,Dalian116023,China; 2.KeyLaboratoryofCoastalEcologyandEnvironmentofStateOceanicAdministration,Dalian116023,China; 3.CollegeofEnvironmentalScienceandEngineering,NankaiUniversity,Tianjin300071)
In order to learn the bacterial taxa in unique microhabitat of the surface microalyer,the total numbers of bacteria,culturable bacteria and its community structure were investigated from the surface microlayer and subsurface layer of the northern Yellow Sea. Seawater samples were collected from four sampling times,2010-2011. The total number of bacteria was determined by flow cytometry. The number of culturable bacteria was determined by the plate count method. PCR-16S rDNA and sequencing analysis were used to analyze the features of community structure. The results showed that the average numbers of total bacteria are 1.76×106CFU/mL in the surface microlayer and 1.07×106cell/mL in subsurface layer,respectively. The number of culturable bacteria ranged from 1.00×102CFU/mL to 1.70×106CFU/mL. The percentage that culturable bacteria occupies in total bacteria were 13.05% and 0.45% in the surface microlayer and subsurface layer,respectively. The enrich factor (EF) of total and cultural bacteria were 2.02 and 74.16 in the surface microlayer. The results showed that the culturable bacteria in this region was attached to four phylogenetic communities: Proteobacteria (94.34%)、Firmicutes (1.89%)、Bacteroidetes (1.89%) and Actinobacteria (1.89%). This research preliminary presented that the surface microlayer in seawater has an high enrichment effect on bacteria,especially for culturable bacteria. The bacterial communities in the surface microlayer and subsurface layer was different,which reflected in wide range of species,diversity of source and function. Therefore,the unique bacterial communities of the surface microlayer is generated towing to its special microhabitat. The ecological function of microorganisms in surface microlayer need to be further understood in the future.
surface microlayer; subsurface layer; total bacteria; culturable bacteria; community structure
2015-03-23;
2015-07-22。
海洋公益性行业科研专项(201105021,201305030,201405007);“全球变化与海气相互作用”专项(GASI-03-01-02-05)。
樊景凤(1972—),女,黑龙江省明水县人,博士,研究员,主要从事海洋微生物学与海洋生态学研究。E-mail:jffan@nmemc.org.cn
10.3969/j.issn.0253-4193.2015.10.012
Q938.8
A
0253-4193(2015)10-0123-10
樊景凤,明红霞,王小慧,等. 北黄海微表层细菌丰度与可培养细菌群落结构分析[J].海洋学报,2015,37(10):123—132,
Fan Jingfeng,Ming Hongxia,Wang Xiaohui,et al. Analysis on the bacterial abundance and community structure of culturable bacteria in the surface microlayer of the northern Yellow Sea[J]. Haiyang Xuebao,2015,37(10):123—132,doi:10.3969/j.issn.0253-4193.2015.10.012

