B7-H4对宫颈癌患者外周血活化T细胞增殖、凋亡和分泌细胞因子的影响*
张 燕,王婷婷,徐 曼△,黄文炼,罗 玮,肖 琳
(1.重庆医科大学病理教研室/重庆医科大学分子与肿瘤研究中心 400016;2.重庆医科大学第一附属医院妇产科,重庆 400016)
论著·临床研究
B7-H4对宫颈癌患者外周血活化T细胞增殖、凋亡和分泌细胞因子的影响*
张 燕1,王婷婷1,徐 曼1△,黄文炼1,罗 玮2,肖 琳2
(1.重庆医科大学病理教研室/重庆医科大学分子与肿瘤研究中心 400016;2.重庆医科大学第一附属医院妇产科,重庆 400016)
目的观察重组人B7-H4蛋白对宫颈癌患者外周血T细胞增殖周期、凋亡及分泌细胞因子的影响。方法B7-H4分别与15例宫颈癌患者外周血活化淋巴细胞混合培养48 h后,采用流式细胞术分析T细胞增殖、细胞周期、凋亡及各亚群T细胞的变化,酶联免疫吸附试验(ELISA)芯片检测培养上清液细胞因子含量。结果宫颈癌患者外周血T细胞与B7-H4混合培养48 h后,G1、G2和S期的T细胞分别占90.59%、8.55%和0.87%,空白对照组T细胞各期占92.83%、6.09%和1.13%;B7-H4组CD4+T和CD8+T细胞的Ki67阳性率分别为2.13%±0.13%和1.03%±1.33%,空白对照组为2.74%±0.98%和1.71%±1.32%。B7-H4组较空白对照组CD8+T和CD4+T细胞占T细胞的比例下降,但CD4+T/CD8+T比值增高,CD4+CD25+Foxp3+T细胞增多;B7-H4组混合培养上清液中TGF-β1含量为(259.25±32.78)pg/mL,空白对照组为(202.75±20.17)pg/mL。B7-H4对宫颈癌患者外周血活化T细胞凋亡无明显影响。结论B7-H4使宫颈癌患者外周血活化T细胞被阻滞于G2期,S期细胞明显减少;B7-H4抑制CD4+T和CD8+T细胞增殖,但对Foxp3+T细胞增殖和分泌TGF-β1可能有促进作用;B7-H4对T细胞凋亡无明显影响。B7-H4在抑制宫颈癌抗肿瘤细胞免疫中发挥作用,它可能成为宫颈癌免疫治疗的潜在靶点。
T细胞周期;宫颈肿瘤;Foxp3+;CD4+;CD8+
宫颈癌患者机体内免疫环境改变造成肿瘤细胞免疫逃逸是肿瘤发生发展的原因之一,近来研究发现一些共刺激分子参与了负性调控抗肿瘤免疫反应。B7-H4是共刺激分子B7家族成员之一,它可能与活化T细胞的未知受体结合,调控T细胞的增殖周期和功能[1-3]。B7-H4在人正常组织不表达或偶见表达,但在多种恶性肿瘤高表达。作者前期在回顾性研究中发现,人子宫颈癌高表达B7-H4与肿瘤内浸润的CD8+T细胞数量减少及分泌干扰素-γ(IFN-γ)下降有关,但与浸润的CD4+T和Treg细胞数量无关[4]。为了体外观察B7-H4对宫颈癌患者T细胞免疫的影响,本研究采用流式细胞术分析了B7-H4对外周血活化T细胞增殖、细胞周期、凋亡以及T细胞亚群的影响,用酶联免疫吸附试验(ELISA)芯片检测了B7-H4对T细胞分泌转化生长因子-β1(TGF-β1)的作用。
1 材料与方法
1.1 材料与试剂 收集15例宫颈癌患者的新鲜抗凝外周血用于体外实验。液态人重组B7-H4蛋白(6576-B7)购于美国RD公司;鼠抗人Foxp3(No.12-4771)、CD4-FITC (No.11-0049)、CD8-FITC (No.11-0086)、小鼠IgG1-PE(No.12-4714)和IgG1-FITC(No.11-4714)购自美国eBioscience公司,均是液态试剂;鼠抗Ki67(液态)购自美国BD公司;人淋巴细胞分离液购自天津灏洋生物公司;尼龙毛购自德国Kisker公司;RPMI1640培养液购自美国Gibco公司;小牛血清购自杭州四季青公司;PHA冻干粉购自美国Sigma公司;Annexin V-PE/7-AAD细胞凋亡检测试剂盒购自南京凯基生物公司;ELISA芯片购自Raybiotech公司。
1.2 外周血T细胞分离培养 宫颈癌患者抗凝外周血经Ficoll 密度梯度离心后,过尼龙毛柱获得T细胞并接种于24孔板,每孔T细胞500 μL(1×106/mL),加入PHA(10 μg/mL)刺激24 h。将T细胞分为两组,实验组加入终浓度为2 μg/mL 的重组人B7-H4,空白对照组加入等体积PBS共培养48 h。
1.3 T细胞细胞周期和增殖检测 收集T细胞经70%冰乙醇固定后加入RNA酶和PI染色,4 ℃避光孵育45 min,流式细胞术检测T细胞周期。T细胞分别与鼠抗人CD4-FITC、鼠抗人CD8-FITC和鼠抗Ki67-PE避光孵育15 min后,流式细胞术检测CD4+T和CD8+T细胞的Ki67阳性率。
1.4 T细胞凋亡检测 收集的T细胞经Annexin V-PE/7-AAD、鼠抗人CD4-FITC、鼠抗人CD8-FITC和鼠抗人CD3-PE避光孵育15 min后,流式细胞术检测细胞凋亡和CD4+、CD8+细胞亚群比例。
1.5 分析CD4+CD25+Foxp3+T细胞的比例 T细胞经鼠抗人CD4-FITC,鼠抗人CD25-TRITC,鼠抗人Foxp3-PE避光孵育15 min后,流式细胞术检测T淋巴细胞内CD4+CD25+T细胞及CD4+CD25+Foxp3+T细胞比例。
1.6 细胞因子含量检测 ELISA芯片室温充分复温后,将B7-H4与T细胞共培养48 h的上清液各200 μL分别加入芯片小孔内,室温摇床孵育2 h后弃孔内液体并充分清洗。再在各膜中依次加入生物素标记抗体和Cy3-链霉亲和素孵育2 h并清洗。将检测液C和检测液D等量混匀,在膜表面加500 μL检测混合液,反应完毕后放入芯片检测仪进行结果分析。
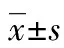
2 结 果
2.1 B7-H4对外周血活化T细胞周期和增殖的影响 B7-H4与宫颈癌患者外周血T细胞混合培养48 h后,G1期、G2期和S期的T细胞分别占90.59%、8.55%和0.87%,而空白对照组分别占92.83%、6.09%和1.13%,B7-H4组的G2期细胞较空白对照组多,而S期细胞明显少于空白对照组(图1)。
流式细胞术检测细胞增殖标志物Ki67结果显示,B7-H4组宫颈癌患者外周血处于增殖期的CD4+T和CD8+T细胞分别为2.13%±0.13%和1.03%±1.33%,低于空白对照组2.74%±0.98%和1.71%±1.32%(图2)。

图1 宫颈癌患者外周血T细胞增殖周期

图2 CD4+T和CD8+T细胞Ki67阳性率
2.2 B7-H4对外周血CD4+T、CD8+T和Foxp3+T细胞所占比例的影响 B7-H4与宫颈癌患者外周血活化T细胞混合培养48 h后,CD4+T和CD8+T细胞占CD3+T细胞的百分比分别为40.02%±2.70%和17.93%±1.90%;空白对照组则为46.75%±7.30%和25.98%±3.40%。B7-H4组CD4+T细胞和CD8+T细胞占CD3+T细胞百分比均明显低于空白对照(P<0.05),见图3。B7-H4组CD4+T /CD8+T比值为2.23,明显高于空白对照组的1.79(图3)。
本研究进一步分析 B7-H4对宫颈癌患者外周血T细胞CD4+CD25+Foxp3+T细胞的影响,结果发现与B7-H4共培养48 h后,CD4+CD25+Foxp3+T细胞占CD4+T细胞的55.2%±1.95%,而空白对照组CD4+CD25+Foxp3+T细胞占CD4+T细胞的46.4%±4.21%,两组间存在明显差异 (P<0.05),见图4。

图3 B7-H4对外周血T细胞亚群的影响

图4 B7-H4对外周血Foxp3+T细胞亚群的影响
2.3 B7-H4对外周血活化T细胞凋亡的影响 B7-H4蛋白与宫颈癌患者外周血活化混合培养48 h后,T细胞的平均凋亡率为36.2%±1.4%,空白对照组平均凋亡率34.5%±1.5%,两组间无明显差异(P>0.05),见图5。

图5 宫颈癌患者外周血T细胞凋亡比例
2.4 B7-H4对T细胞分泌TGF-β1的影响 ELISA芯片检测结果显示,B7-H4与活化T细胞共培养48 h后,上清液中TGF-β1含量为(259.25±32.78)pg/mL,空白对照组为(202.75±20.17)pg/mL,两组间差异有统计学意义(P<0.05)。
3 讨 论
本研究采用重组人B7-H4与子宫颈癌患者外周血活化T细胞混合培养48 h后,观察到B7-H4使T细胞周期阻滞于G2期,且S期细胞(DNA合成)明显减少,该结果与Park等[5]报道B7-H4表达于EBV+淋巴瘤细胞株,可使其细胞周期阻滞相似。本研究进一步检测CD4+T和CD8+T细胞增殖标记物Ki67的阳性率,发现B7-H4使活化T细胞中处于增殖状态的CD4+T和CD8+T细胞减少,但CD4+T/CD4+T比值高于空白对照组,提示B7-H4抑制CD8+T细胞增殖的作用强于CD4+T细胞。该结果与本课题组前期观察到子宫颈癌组织内B7-H4高表达与局部浸润的CD8+T细胞减少有关,与CD4+T细胞数量无明显关系相一致。
CD4+T细胞包括辅助T细胞和调节T细胞亚群,辅助T细胞不仅促进T细胞分化成熟并发挥细胞免疫功能、也促进B细胞产生抗体[6];调节T细胞则通过与靶细胞直接接触或分泌TGF-β1负性调节免疫反应,抑制抗肿瘤免疫[7]。文献报道Treg细胞在肿瘤局部浸润的淋巴细胞中比例增高,肿瘤患者外周血和局部淋巴结内Treg细胞数量也增多,且Treg细胞与肿瘤进展以及肿瘤治疗效果不佳有关[8-9]。因转录因子叉状头Foxp3是调节性T细胞最具特征性的标志物,本研究用Foxp3标记Treg细胞,发现B7-H4与宫颈癌患者外周血活化T细胞共培养48 h后,CD4+CD25+Foxp3+T细胞比例明显高于空白对照组,提示B7-H4可能对Foxp3+Treg细胞的增殖有促进作用,但该作用有待进一步实验证实。邓敏端[10]也发现宫颈鳞癌组织中Foxp3表达明显比正常宫颈上皮组织和CIN高;Zeng等[11]报道Foxp3+Treg细胞在宫颈癌细胞的发生和发展过程中起到重要作用;Tuve等[12]观察到宫颈癌患者外周血Treg/CD8+T细胞比值增高,小鼠的子宫颈癌模型也存在该现象。仅去除小鼠体内的Treg细胞不能抑制肿瘤生长,如果同时在肿瘤局部联合抑制细胞毒T细胞相关抗原4则能增强抗肿瘤免疫,抑制肿瘤生长。提示肿瘤局部CD8+T细胞减少和Treg细胞增多与子宫颈癌发生发展明显相关。陈春燕等[13]发现B7-H4和Foxp3在乳腺癌均高表达,并且与肿瘤临床分级和淋巴结转移相关,而且Treg细胞在肿瘤内浸润淋巴细胞中所占的比例越高,肿瘤患者的生存率就越低[14-15],因此作者推测B7-H4抑制CD8+T细胞增殖和免疫功能,可能促进Foxp3+T细胞增殖,从而使宫颈癌局部微环境的免疫水平低下,有利于癌细胞的免疫逃逸。
TGF-β1在肿瘤进展过程中具有双向调节作用,在肿瘤早期通过促进细胞凋亡和阻滞细胞增殖而抑制多种上皮性肿瘤细胞生长;但在肿瘤晚期能下调肿瘤微环境免疫水平、促进肿瘤血管形成和肿瘤进展。本实验观察到在与B7-H4共培养48 h后的T细胞上清液中TGF-β1的含量较空白对照组增高,流式细胞术检测到Foxp3+T细胞在CD4+T细胞中所占比例增高,提示B7-H4蛋白可能对Treg细胞增殖和分泌TGF-β1均有促进作用,从而使宫颈癌局部的抗肿瘤免疫水平下降,促进宫颈癌进展。由于收集宫颈癌患者外周血Foxp3+T细胞数量有限,本研究无法进一步观察B7-H4对Foxp3+T细胞的直接作用。
本研究还观察到B7-H4组与空白对照组间T细胞的凋亡率无显著差别,提示B7-H4对外周血活化T细胞凋亡无明显影响。虽然有研究者观察到恶性肿瘤细胞表达B7-H4基因影响瘤细胞凋亡,如朱森良等[16]发现沉默前列腺癌DU145细胞的B7-H4基因后,癌细胞增殖减弱而凋亡细胞增多;Salceda等[17]观察到敲除乳腺癌细胞的B7-H4基因可导致肿瘤细胞凋亡增多,但两位作者均观察到B7-H4表达于瘤细胞影响其增殖和凋亡,与本实验的研究方法完全不同。
综上所述,B7-H4抑制CD4+T细胞和CD8+T细胞增殖,但可能促进Foxp3+Treg细胞增殖,使宫颈癌微环境T细胞亚群分布发生改变,同时Foxp3+Treg分泌TGF-β1增多,导致宫颈局部微环境对癌细胞的免疫监视和清除能力下降,在子宫颈癌的发生发展中发挥重要作用。B7-H4有望作为临床宫颈癌诊断、判断预后及免疫治疗的潜在靶点。
[1]Park GB,Song H,Kim YS et al.Cell cycle arrest induced by engagement of B7-H4 on Epstein-Barrvirus-positive B-cell lymphoma cell lines[J].Immunology,2009,28(3):360-368.
[2]Caigan Du,Yuzhou Wang,et al.The immunoregulatory mechanisms of carcinoma for its survival and development[J].J Exp & Clin Cancer Res,2011,30:12.
[3]He C,Qiao H,Jiang H,et al.The inhibitory role of B7-H4 in antitumor immunity:association with cancer progression and survival[J].Clin Dev Immunol,2011,695834.doi:10.1155/2011/695834.
[4]王婷婷,徐曼,耿卫朴,等.B7-H4在人子宫颈癌的表达及其与肿瘤内浸润T细胞亚群的相关性研究[J].中国免疫学杂志,2012,9(28):812-816.
[5]Park GB,Song H,Kim YS,et al.Cell cycle arrest induced By engagement of B7-H4 on Epstein-Barr virus-positive B-cell lymphoma cell lines[J].Immunology,2009,128(3):360-368.
[6]Chen G,Emens LA.Chemoimmunotherapy:reengineering tumor immunity[J].Cancer Immunol Immunother,2013,62(2):203-216.
[7]Heiber JF,Geiger TL.Context and location dependence of adaptive Foxp3(+)regulatory T cell formation during immunopathological conditions[J].Cell Immunol,2012,279(1):60-65.
[8]KosmaczewskaA,CiszakL,PotoczekS,et al.The significance of Treg cells in defective tumor immunity[J].Arch Immunol Ther Exp,2008,56(3):181-191.
[9]陈欣然,王玲,共刺激分子B7-H4在小鼠食管癌前病变进展中脾淋巴细胞表面的表达[J],肿瘤,2014,34(11):1010-1015.
[10]邓敏端.宫颈癌前病变和宫颈鳞癌组织中Foxp3的表达及临床意义[J].中国妇产科临床杂志,2011,12(5):338-341.
[11]Zeng C,Yao Y,Jie W,et al.Up-regulation of Foxp3participates in progression of cervical cancer[J].Cancer Immunol Immunother,2013,62(3):481-487.
[12]Tuve S,Chen BM,Liu Y,et al.Combination of tumor site-located CTL-associated antigen-4 blockade and systemic regulatory T-cell depletion induces tumor-destructive immune responses[J].Cancer Res,2007,67(12):5929-5933.
[13]陈春燕,眭文妍,李维,等.B7-H4及Foxp3在乳腺癌中的表达及临床意义[J].现代生物医学进展,2009,19(22):4279-4285.
[14]Hiraoka N,Onozato K,Kosuge T,et al.Prevalence of Foxp3+regulatory T cells increases during the progression of pancreatic ductal adenocarcinoma and its premalignant lesions[J].Clin Cancer Res,2006,12(18):5423-5434.
[15]Kobayashi N,Hiraoka N,Yamagami W,et al.Foxp3+regulatory T cells affect the development and progression of hepatocarcinogenesis[J].Clin Cancer Res,2007,13(3):902-911.
[16]朱森良,孙晓青.siRNA靶向沉默B7-H4基因对人前列腺癌DU145细胞增殖和凋亡的影响[J].河南外科学杂志,2012,18(6):1-4.
[17]Salceda S,Tang T,Kmet M,et al.The immunomodulatory protein B7-H4 is overexpressed in breast and ovarian cancers and promotes epithelial cell transformation[J].Exp Cell Res,2005,306(1):128-141.
Influence of B7-H4 on cell proliferation,apoptosis and cytokine secretion of peripheral blood activated T cells in cervical cancer patients*
ZhangYan1,WangTingting1,XuMan1△,HuangWenlian1,LuoWei2,XiaoLin2
(1.DepartmentofPathology,MolecularMedicineandTumorResearchCenterofChongqingMedicalUniversity,Chongqing400016,China;2.DepartmentofObstetricsandGynecology,FirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China)
ObjectiveTo observe the in vitro influence of recombinant human B7-H4 protein on the cell proliferation cycle,apoptosis and cytokine secretion of peripheral blood activated T lymphocytes in cervical cancer patients.MethodsAfter 48 h co-culture of peripheral blood T lymphocytes in 15 cases of cervical cancer with B7-H4 48 h,T lymphocytes′ cell proliferation cycle,apoptosis and T lymphocytes subtypes changes were detected by FCM;the cytokines concentration in the culture supernatant was tested by ELISA array.ResultsAfter 48 h co-culture of peripheral blood T lymphocytes with B7-H4 48hs,G1,G2 and S phase of T cells accounted for 90.59%,8.55% and 0.87% respectively,which of the blank group were 92.83%,6.09% and 1.13% respectively;the Ki67 positive rates of CD4+T and CD8+T cells in the B7-H4 group were 2.13%±0.13% and 1.03%±1.33% respectively,which of the blank group were 2.74%±0.98% and 1.71%±1.32% respectively;the proportion of CD4+T and CD8+T cells accounting for T cells in the B7-H4 group was decreased compared with the blank group,but the ratio of CD4+T/ CD8+T and the proportion of CD4+CD25+Foxp3+T cells were increased,in addition,the TGF-β1 secretion; concentration in the co-culture supernatant in the B7-H4 group was (259.25±32.78)pg/mL,which was higher than (202.75±20.17)pg/mL in the blank group.B7-H4 had no significant influence on the peripheral blood activated T cells apoptosis.ConclusionB7-H4 block the peripheral blood activated T cells at G2 phase,the S phase cells are obviously decreased;B7-H4 inhibits the cellular proliferation of CD4+T and CD8+cells,but may have the promoting effect on Foxp3+T proliferation and TGF-β1 secretion;B7-H4 has no significant influence on T cell apoptosis.B7-H4 plays a role in depressing anti-tumor T cell immune response of cervical cancer and may become a potential target of cervical cancer immunotherapy.
cell cycle;cervical neoplasm;Foxp3+;CD4+;CD8+
10.3969/j.issn.1671-8348.2015.26.009
重庆市自然科学基金(CSTC2009BB5268)。
:张燕(1988-),硕士研究生,主要从事肿瘤与免疫方面的研究。△
,E-mail:349232467@qq.com。
R711.74
A
1671-8348(2015)26-3628-03
2015-04-08
2015-06-16)

