荷叶黄酮对乳酸杆菌和双歧杆菌抗氧化能力的协同作用研究
刘双环,李 欢,王 聪,梁 博,胡夏韵,韩 蓓,2*
1西安交通大学医学部;2 陕西省营养与食品安全工程研究中心,西安 710061
近年来,益生菌制品、肠道益生菌制剂等在日常生活及临床营养中发挥越来越积极的作用。益生菌不仅可以改善食品风味、提高营养价值,还具有特殊的应用价值,例如调整肠道菌群、增强肠道免疫力、抗氧化、调节血脂血糖等。目前国内外对益生菌的功能研究也日趋丰富,而对其作用机理的研究仍然是核心问题[1],其中抗氧化作用及机制仍在探索中[2,3]。已有的研究表明,益生菌的抗氧化作用主要集中在细胞内,依靠抗氧化成分和氧化还原调控系统起作用[4,5]。
荷叶属国家卫生部公布的既是食品又是药品的植物,具有抗氧化、降血脂、抑菌消炎等功效。其生物活性和生理功能主要与含有的生物碱、黄酮类等功能性成分有关[6]。黄酮类化合物是色原酮或色原烷的衍生物,属于植物次级代谢产物,也成植物化学物,是许多药食两用植物中的主要活性成分,具有显著的降血脂和减肥、抗氧化、抗病毒、抑菌等作用[7-9]。荷叶黄酮抗氧化作用集中报道在其具有体外清除自由基,抗脂质过氧化等作用,在动物实验中,可以提高衰老模型小鼠血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)活力[10,11]。
本实验在益生菌在体内抗氧化研究及荷叶黄酮体外抗氧化研究的基础上,研究荷叶黄酮对益生菌的生长促进作用,对益生菌体外抗氧化活性的协同促进作用。动物双歧杆菌、保加利亚乳杆菌分别在添加/无添加荷叶黄酮的培养基中进行培养,通过分别比较双歧乳杆菌、保加利亚乳杆菌的生长曲线、细胞裂解物的体外抗氧化能力(包括清除超氧阴离子能力、清除DPPH 自由基能力、对脂质过氧化抑制作用)以及细胞内GSH、SOD 活性,探究荷叶黄酮对两种益生菌抗氧化作用的协同影响[12,13]。
1 材料与方法
1.1 菌株、培养基及所用试剂
动物双歧杆菌(Bifidobacterium animalisB211)、保加利亚乳杆菌(Lactobacillus bulgaricusA105)为本实验室保存。使用前先用12%的脱脂乳培养基活化2~3 次,然后5%的接种量转接至MRS 培养基(10.0 g/L 蛋白胨、10.0 g/L 肉膏、5.0 g/L 酵母浸粉、20 g/L 葡萄糖、2.0 g/L 磷酸氢二钾、2.0 g/L 柠檬酸氢二铵、5.0 g/L 乙酸钠、0.58 g/L 硫酸镁、0.25 g/L 硫酸锰、0.5 g/L 半胱氨酸、1.0 g/L 吐温80,pH 6.2~6.4)中,置于厌氧手套培养箱(COY,US)中培养。
试剂:荷叶黄酮(纯度15%,干粉)、1,1-二苯基-2-三硝基苯肼(DPPH)、硫代巴比妥酸(TBA)、三氯乙酸(TCA)、FeSO4、H2O2、乙二胺四乙酸二钠(EDTA)、HCl、甲醇等试剂,均为国产分析纯试剂。SOD 和GSH 检测试剂盒(南京凯基生物有限公司)。
1.2 方法
1.2.1 菌株的培养和细胞破碎液的制备
动物双歧杆菌、保加利亚乳杆菌种在12%的脱脂乳粉培养基中活化三次,荷叶黄酮溶解于50%乙醇中,0.22 μm 的滤器过滤除菌,制备0.25 g/mL 的荷叶黄酮溶液(前期实验证实0.25 g/mL 的荷叶黄酮对动物双歧杆菌和保加利亚乳杆菌的生长具有最佳的促进作用)。将动物双歧杆菌、保加利亚乳杆菌分别以5%的转接量接种至MRS(含2.5 mg 荷叶黄酮)培养基、MRS 培养基中,保加利亚乳杆菌于42℃条件下培养20 h 左右,动物双歧杆菌于37 ℃条件下厌氧培养20 h 左右。
将菌培养液于4500 rpm 离心10 min,收集菌体,用PBS 缓冲液洗涤2 次,将菌体重悬于PBS 缓冲液中,调整细胞总数至相等(基于OD600值)。然后经超声波细胞粉碎机在冰浴条件下进行破碎(工作参数:功率400 W、全程时间10 min、工作5 s、间歇5 s),菌破碎裂解液于4 ℃,7500 rpm 离心10 min,收集上清液备用。样品组为经MRS 培养基、MRS+0.25 mg/mL 荷叶黄酮培养的动物双歧杆菌和保加利亚乳杆菌的菌体裂解液,对照组为MRS 空白培养基和添加0.25 mg/mL 荷叶黄酮的MRS 培养基。
采用邻苯三酚自氧化法测定其抗氧化能力。取4.5 mL 0.1 M Tris-HCl 缓冲液(pH 8.2)于试管中,依次加入1.0 mL 1.0 mM 乙二胺四乙酸(EDTA)、1.0 mL 样品组或对照组裂解液、2.4 mL 蒸馏水。于25 ℃水浴反应10 min,再加入2.0 mL 9.0 mM 邻苯三酚准确反应60 min 后,加入100 μL 12.0 M HCl 终止反应。在波长325 nm 处测定吸光度A325样品、A325对照。空白管以1.0 mL 蒸馏水代替样品,操作方法同样品管,每个样品设3 个重复,测得吸光度A325空白。

1.2.3 益生菌细胞裂解物清除DPPH 自由基能力的测定
细胞破碎液离心后取上清液1.0 mL,加入浓度为0.2 mM 的DPPH·甲醇溶液1 mL,混匀后在室温下避光反应30 min,离心后取实验组合对照组上清液在517 nm 下测定光密度值A517样品、A517对照,以PBS 缓冲液作空白对照,每个样品设3 个重复,操作方法同样品管,测得吸光度A517空白,按照下式计算菌株清除DPPH 自由基的能力。
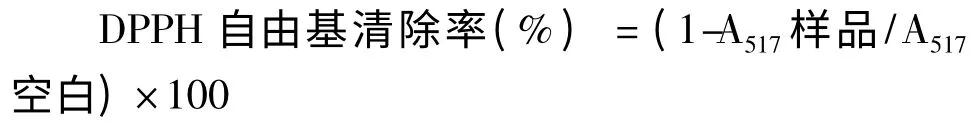
1.2.4 益生菌细胞裂解物对脂质过氧化抑制作用
以卵黄脂蛋白为底物的反应体系包括:1:40 稀释的卵黄悬液(卵黄用等体积的pH 7.45、0.1 M 的PBS 配成,用前先磁力搅拌10 min)0.2 mL、25 mM的FeSO4溶液0.2 mL、细胞破碎液100 μL,用PBS溶液补足2.0 mL。对照管除不加细胞破碎液其它试剂同前并提前加入20% TCA 溶液0.5 mL。试验开始将上述两种试管同时置37 ℃水浴中振荡15 min,取出后,样品试管加入20% TCA 溶液0.5 mL,静置10 min 后,与对照管于3500 rpm 离心10 min,取实验组和对照组上清液,分别加入硫代巴比妥酸(TBA,0.8%)溶液1.0 mL,加塞于100 ℃水浴15 min,取出冷却。每个样品设3 个重复,以空白管调零(空白以2.0 mL PBS 溶液代替),测定A532样品、A532对照和A532空白,细胞破碎液对卵黄脂蛋白LPO的抑制率(%)表示为:

1.2.5 益生菌细胞裂解物的GSH 和SOD 酶活测定
GSH 含量和SOD 活性测定均使用检测试剂盒测定,按说明书操作。每个样品设3 个重复。
1.3 数据处理
采用Excel 2003 和SPSS 13.0 数据统计软件处理实验数据。
2 实验结果
2.1 益生菌细胞裂解物体外抗氧化能力
在MRS+0.25 mg/mL 荷叶黄酮的空白培养基上清对的清除率为14.3%。在MRS 培养基和MRS+0.25 mg/mL 荷叶黄酮培养基中,动物双歧杆菌对的清除率分别为25.91%和40.14%,而保加利亚乳杆菌对的清除率分别为33.41%和38.36%。由本组实验可看出:荷叶黄酮、动物双歧杆菌、保加利亚乳杆菌单独均具有对的清除作用,而在MRS 培养基中添加0.25 mg/mL 荷叶黄酮的培养物中,动物双歧杆菌和保加利亚乳杆菌对的清除作用均有提高,分别提高了54.9% 和14.8%,动物双歧杆菌的清除作用提高更明显(图1)。
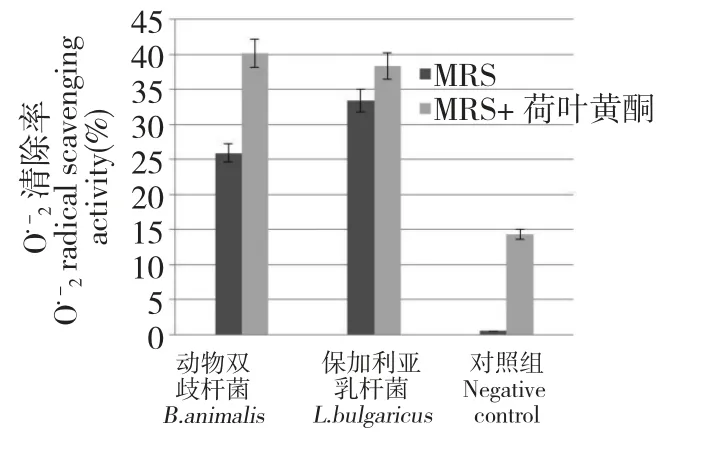
图1 有无添加荷叶黄酮至MRS 培养基对动物双歧杆菌和保加利亚乳杆菌细胞裂解液清除能力的影响Fig.1 The radical scavenging activity of B.animalis and L.bulgaricus cell lysate grown in the MRS medium supplied with and without lotus leaf flavonoids
2.1.2 清除DPPH 自由基的能力
在MRS+0.25 mg/mL 荷叶黄酮的空白培养基上清对DPPH 自由基的清除率为31.2%。在MRS培养基和MRS +0.25 mg/mL 荷叶黄酮培养基中,动物双歧杆菌对DPPH 自由基的清除率分别为79.59%和71.91%,而保加利亚乳杆菌对DPPH 自由基的清除率分别为73.21%和77.70%。由本组实验可看出:荷叶黄酮、动物双歧杆菌、保加利亚乳杆菌单独均具有DPPH 自由基的清除作用。而在MRS 培养基中添加0.25 mg/mL 荷叶黄酮液的培养物中,保加利亚乳杆菌对DPPH 自由基的清除作用有所提高,动物双歧杆菌对DPPH 自由基的清除作用稍有减低(图2)。
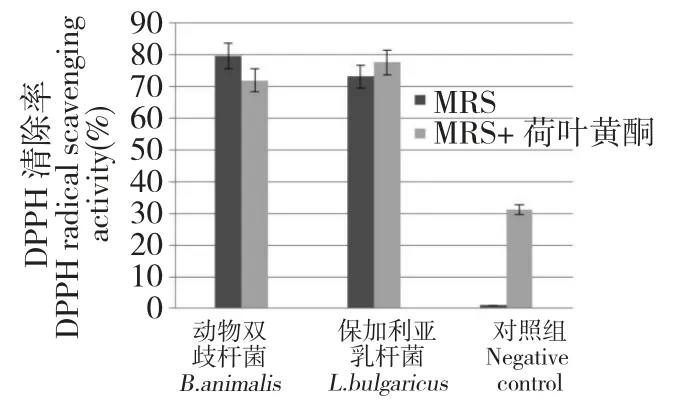
图2 有无添加荷叶黄酮至MRS 培养基对动物双歧杆菌和保加利亚乳杆菌细胞裂解液对DPPH 自由基清除能力的影响Fig.2 The DPPH radical scavenging activity of B.animalis and L.bulgaricus cell lysate grown in the MRS medium supplied with and without lotus leaf flavonoids
2.1.3 抗脂质过氧化的能力
在MRS+0.25 mg/mL 荷叶黄酮的空白培养基清除脂质过氧化率为11.8%。在MRS 培养基和MRS+0.25 mg/mL 荷叶黄酮培养基中,动物双歧杆菌清除脂质过氧化率分别为54.47%和48.53%,而保加利亚乳杆菌清除脂质过氧化率分别为8.93%和58.73%。由本组实验可看出:荷叶黄酮、动物双歧杆菌、保加利亚乳杆菌单独均具有清除脂质过氧化作用。而在MRS 培养基中添加了0.25 mg/mL 荷叶黄酮液后,动物双歧杆菌对脂质过氧化的清除作用稍有降低,而保加利亚乳杆菌对脂质过氧化的清除作用大幅提高,提高了557.6%(图3),荷叶黄酮对其的脂质过氧化清除能力呈现出显著的协同贡献作用。
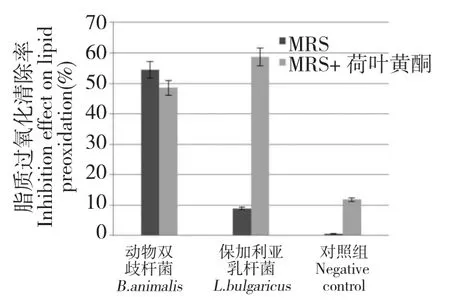
图3 有无添加荷叶黄酮至MRS 培养基对动物双歧杆菌和保加利亚乳杆菌细胞裂解液清除脂质过氧化能力的影响Fig.3 The inhibition effect on lipid preoxidation of B.animalis and L.bulgaricus cell lysate grown in the MRS medium supplied with and without lotus leaf flavonoids
2.2 益生菌细胞内的GSH 和SOD 测定
对在MRS 培养基和MRS+0.25 mg/mL 荷叶黄酮的培养基中培养的动物双歧杆菌和保加利亚乳杆菌进行了菌体内的SOD 酶活测定。SOD 活性的定义为每mg 细胞破碎液总蛋白在1 mL 反应体系内的SOD 抑制率达50%时所对应的SOD 量为1 个SOD 活力单位(U)。从图4 可以看出荷叶黄酮的添加对两种益生菌的胞内SOD 酶活均有所增加,动物双歧杆菌的SOD 酶活提高了11.9%,保加利亚乳杆菌的提高了82.4%。
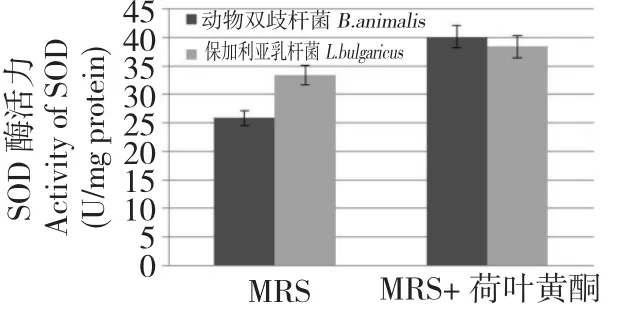
图4 有无添加荷叶黄酮至MRS 培养基对动物双歧杆菌和保加利亚乳杆菌的SOD 酶活的影响Fig.4 The SOD enzyme activities of B.animalis and L.bulgaricus cell grown in the MRS medium supplied with and without lotus leaf flavonoids
对在MRS 培养基和MRS+0.25 mg/mL 荷叶黄酮的培养基中培养的动物双歧杆菌和保加利亚乳杆菌进行了菌体内的GSH 含量测定(图5)。两种益生菌的胞内均检测到了GSH,而荷叶黄酮的添加可以提高两种益生菌的胞内GSH 含量,动物双歧杆菌的GSH 含量提高了50%,保加利亚乳杆菌的提高了76%。
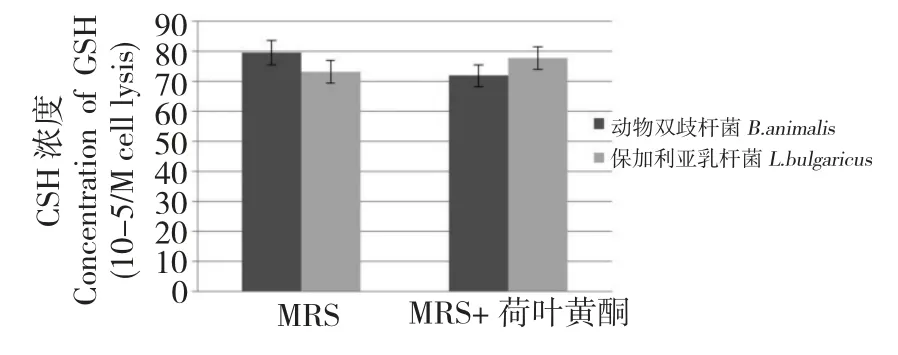
图5 有无添加荷叶黄酮至MRS 培养基对动物双歧杆菌和保加利亚乳杆菌的GSH 含量的影响Fig.5 The concentration of GSH in B.animalis and L.bulgaricus cell grown in the MRS medium supplied with and without lotus leaf flavonoids
3 讨论与结论
既往研究表明,益生菌体内抗氧化作用主要有以下四部分[14-16]:(1)自由基的清除能力,主要包括对、DPPH、羟自由基等的清除能力。(2)氧化应激的耐受能力,主要指菌体在含有一定浓度的O2或H2O2培养基中正常生长的耐受力。(3)抗脂质过氧化的能力,主要是通过对亚油酸过氧化抑制率或脂质过氧化产物丙二醛(MDA)的含量进行测定来反映。(4)产生抗氧化物质,某些益生菌能够产生如SOD、GSH-Px、CAT、NADH 氧化酶、金属硫蛋白等特殊的活性物质,可依据其活性评估其抗氧化特性。而植物黄酮类物质也具有显著的抗氧化能力,荷叶黄酮具有良好的清除DPPH 自由基的能力,且可以有效地抑制亚油酸氧化[17];白茶黄酮、款冬花黄酮、红花黄酮、旱莲草黄酮等均对H2O2均具有较强的清除能力,并具有较强的抗脂质过氧化活性[18]。
益生菌、植物黄酮已经被广泛应用于食品、医药、保健品等行业,而植物黄酮是否可促进益生菌的生长,是否对益生菌的抗氧化活性有协同增效作用,这方面的研究较少。本研究结果显示荷叶黄酮仅对保加利亚乳杆菌抗脂质过氧化作用有明显协同增效作用,而对自由基的清除能力上协同作用不明显;荷叶黄酮对动物双歧杆菌的抗脂质过氧化作用和DPPH 自由基的清除能力稍有降低,对自由基的清除能力上协同作用不明显。可能是黄酮与抗氧化活性之间存在的一一对应关系有关,有待于从其组成、结构上进行研究和证明。
通过测定菌株内GSH、SOD 酶活,直接反应益生菌的抗氧化活性[19-22]。动物双歧杆菌、保加利亚乳杆菌胞内均可产生SOD、GSH,而荷叶黄酮的添加可以提高两种益生菌的胞内SOD、GSH 酶活,而且保加利亚乳杆菌的SOD 酶活(提高了82.4%)和GSH 含量(提高了76%)增加远远大于动物双歧杆菌的SOD 酶活和GSH 含量的增加。这可能与荷叶黄酮对保加利亚乳杆菌抗脂质过氧化作用有明显协同增效作用有关,荷叶黄酮可以较为有效的提高保加利亚乳杆菌胞内SOD、GSH 酶活,从而提高其抗氧化及清除自由基的生物效应。
本研究结果提示我们可以考虑在益生菌发酵中添加荷叶粉/荷叶黄酮来提高其功能食品、保健食品的价值,但作为实际应用还有待于进一步研究。
1 Yuan TZ(袁铁铮),Yao B(姚斌).Probiotics research progress on the molecular level.China Bio-technol(中国生物工程杂志),2004,24:27-33.
2 Sah BN,Vasiljevic T,McKechnie S,et al.Effect of probiotics on antioxidant and antimutagenic activities of crude peptide extract from yogurt.Food Chem,2014,156:264-270.
3 Chen XL,Gong LZ,Xu JX.Antioxidative activity and protective effect of probiotics against high-fat diet-induced sperm damage in rats.Animal,2013,7:287-292.
4 Ghoneim MA,Moselhy SS.Antioxidant status and hormonal profile reflected by experimental feeding of probiotics.Toxicol Ind Health,2013,11:1-10.
5 Mishra V,Shah C,Mokashe N,et al.Probiotics as potential antioxidants:a systematic review.J Agric Food Chem,2015,63:3615-3626.
6 Ghazghazi H,Aouadhi C,Riahi L,et al.Fatty acids composition ofTunisian ziziphuslotus L.(Desf.)fruits and variation in biological activities between leaf and fruit extracts.Nat Pro Res,2014,28:1106-1110.
7 Zhang L(张蕾),Qiao XG(乔旭光).The study of Lotus leaf flavonoid on oil antioxidant effect.Mod Food Sci Technol(现代食品科技),2009,25:1180-1182.
8 Wang Y,Hua W,Wang J,et al.Deep sequencing ofLotus corniculatusL.reveals key enzymes and potential transcription factors related to the flavonoid biosynthesis pathway.Mol Genet Genomics,2013,288:131-139.
9 Chen S,Fang L,Xi H,et al.Simultaneous qualitative assessment and quantitative analysis of flavonoids in various tissues of lotus (Nelumbo nucifera)using high performance liquid chromatography coupled with triple quad mass spectrometry.Anal Chim Acta,2012,724:127-135.
10 Liu TY(刘天祎),Pan DD(潘道东).The influence of antiaging function in mice ofLactobacillus caseifermentation yogurt.J Chin Food(中国食品杂志),2013,13:21-25.
11 Huo SX(霍世欣),Zhou TY(周陶忆),Si XJ(司晓晶),et al.Inhibitory effect on pancreatic lipase of flavonoids derived from lotus leaf.Nat Prod Res Dev(天然产物研究与开发),2008,20:328-331.
12 Zhou MJ(周梦佳),Ni XQ(倪学勤),Zeng D(曾东),et al.The impact of probiotics on serum oxidation resistance and the intestinal flora of mice with alcohol lavage.Food Sci(食品科学),2013,34:309-312.
13 Davari S,Talaei SA,Alaei H,et al.Probiotics treatment improves diabetes-induced impairment of synaptic activity and cognitive function:behavioral and electrophysiological proofs for microbiome-gut-brain axis.Neuroscience,2013,14:287-296.
14 Bai M(白明),Meng XC(孟祥晨).The analysis of probiotics antioxidant activity and bacteria oxidation relevant component.Food Ferment Ind(食品与发酵工业),2009,135:6-11.
15 Wang H(王豪),Guo BH(郭本恒),Wang YY(王荫榆),et al.The potential anti-aging effect of probiotic.Chin J Microecol(中国微生态学杂志),2009,21:374-379.
16 Ito M,Ohishi K,Yoshida Y,et al.Antioxidative effects of lactic acid bacteria on the colonic mucosa of iron-overloaded mice.J Agric Food Chem,2003,51:4456-4460.
17 Deng SG(邓胜国),Deng ZY (邓泽元),Huang L(黄丽).Study on the antioxidative activity of flavonoids extracted from lotus leavesin vitro.Food Sci Technol(食品科技),2006,7:274-276.
18 Liu CH (刘彩虹),Zhang Y (张莹),Li YQ (李玉琴),et al.Determination of antioxidation of flavonoids inTussilago farfara.Chin Hosp Pharm J(中国医院药学杂志),2010,30:1628-1630.
19 Peluso I,Romanelli L,Palmery M.Interactions between prebiotics,probiotics,polyunsaturated fatty acids and polyphenols:diet or supplementation for metabolic syndrome preventionInt J Food Sci Nutr,2014,65:259-267.
20 Mukherjee PK,Mukherjee D,Maji AK,et al.The sacred lotus(Nelumbo nucifera)-phytochemical and therapeutic profile.J Pharm Pharmacol,2009,61:407-422.
21 Ji L,Wu J,Gao W,et al.Antioxidant capacity of different fractions of vegetables and correlation with the contents of ascorbic acid,phenolics,and flavonoids.J Food Sci,2011,76:1257-1261.
22 Mössner J.Nutrition,probiotics,antibiotics,antioxidative therapy,endoscopy in chronic pancreatitis.Praxis,2006,95:1627-1635.

