补骨脂二氢黄酮甲醚对A375 细胞黑素合成及ER/MAPK 信号通路的影响
刘国良 于英君 姚 远 姜 颖 张 宁 张明磊 高海娜 李建民
黑龙江中医药大学,黑龙江哈尔滨 150040
黄褐斑俗称蝴蝶斑,是黑素细胞(melanocytes,MC)合成黑素量过多蓄积于皮肤而形成的,研究发现机体内雌激素水平与黄褐斑的发病关系密切,雌激素与雌激素受体结合可影响黑素细胞增殖、黑素合成关键酶酪氨酸酶(TYR)的活性及数量,从而影响黑素合成,是导致色素沉着的主要因素[1-4]。在天然植物中发现许多有弱雌激素样作用化合物, 可与雌激素受体(ER)相结合发挥雌激素样作用, 用于治疗激素相关疾病。植物雌激素又被称为选择性雌激素受体调节剂,其雌激素活性较雌二醇低,表现出具有类雌激素或抗雌激素效应,故而在体内具有较温和的双向调节作用[5-7]。植物雌激素与ER 结合后,刺激性激素结合球蛋白的产生,并抑制TYR 和雌激素合成酶的活性,从而减轻雌激素促细胞增殖的作用,而植物雌激素在黑素合成过程中发挥怎样的作用,以及其是如何通过ER 信号通路进行调控的还不得而知。本研究选用补骨脂中的植物雌激素成分补骨脂二氢黄酮甲醚作用于人黑素瘤细胞(A375 细胞),研究其对ER、MAPK 信号通路蛋白激酶表达的影响,阐明植物雌激素成分干预黑素合成的作用机制,为合理利用中药植物雌激素防治黄褐斑等皮肤色素沉着类疾病提供理论依据。
1 材料与方法
1.1 试剂
补骨脂二氢黄酮甲醚(南京泽朗科技有限公司,批号:20130821);HRP 标记羊抗小鼠IgG(武汉博士德生物工程有限公司,生产批号:BST08k13B);小鼠抗人JNK 单克隆抗体(生产批号:#G0913);ER 阻断剂(ICI182780)(TOCRIS 公司,批号:20A/129473);JNK 抑制剂(SP600125)(美国Selleck 公司,批号:S110202)。
1.2 细胞分组
将对数期生长的A375 细胞,以105每孔接种到6 孔板中,37℃、5%CO2培养。 实验分为空白组(加入2 mL DMEM 完全培养液,培养72 h)、雌二醇组(A375 细胞培养24 h 后,加入雌二醇浓度为10-3μmol/L 的2 mL DMEM 完全培养液,继续培养48 h)、补骨脂二氢黄酮甲醚组(A375 细胞培养24 h 后,加入不同浓度的补骨脂二氢黄酮甲醚2 mL 的DMEM 完全培养液,继续培养48 h)、ICI182780+补骨脂二氢黄酮甲醚组(先加2 mL 的ICI182780培养2 h 后, 再加1 mL 补骨脂二氢黄酮甲醚,继续培养48 h)、SP600125+补骨脂二氢黄酮甲醚组 (先加2 mL 的SP600125 培养2 h 后,再加1 mL 补骨脂二氢黄酮甲醚,继续培养48 h)。
1.3 MTT 检测
细胞培养72 h 至结束前4 h,每孔加入20 μL 浓度为5 g/L 的MTT,继续培养4 h 后,除去上清液,每孔加入150 μL DMSO,将96 孔板置于37℃恒温震荡培养器内震荡10 min,使紫色结晶完全溶解。 酶标仪490 nm 波长处测定吸光度。
1.4 黑素含量
将对数期A375 细胞以细胞浓度105个/孔接种于6 孔板,各组细胞均设5 个复孔,按分组给药。酶标仪490 nm 波长处测定吸光度。
1.5 TYR 活性
将对数期A375 细胞以细胞浓度5000 个/孔接种于96 孔板,每孔200 μL DMEM 完全培养液,各组细胞均设5 个复孔。酶标仪490 nm 波长处测定吸光度。
1.6 逆转录-聚合酶链式反应
1.6.1 总RNA 提取 细胞总RNA 的提取按照试剂盒说明操作。 引物设计:引物的设计与合成由上海生工生物工程技术服务有限公司提供, 以β-actin 为内参照,引物序列见表1。1.6.2 PCR 扩增 在冰水浴上的PCR 管中依次加入16.1 μL ddH2O、1.5 μL cDNA、2.5 μL 10×PCR Buffer、2.5 μL dNTP、1.3 μL MgCl2,最后加入0.1 μL Taq 酶,上游引物和下游引物各0.5 μL, 使PCR 管内终体积达到25 μL。将PCR 管放入PCR 扩增仪上,PCR 扩增程序见表2。

表1 引物序列
1.7 Western blot 实验
蛋白样品制备: 当细胞呈80%以上融合时,WIP组织细胞裂解液裂解提取总蛋白。 SDS-PAGE 电泳:按照BIO-RAD 公司说明书安装SDS 聚丙烯酰胺凝胶玻璃板,分别灌制分离胶和浓缩胶。加样:各40 μL 蛋白样品。电泳:起始电压为100 V,电泳10~20 min 后,蓝色染料进入分离胶,则电压升高到120 V,电泳至指示染料到距分离胶底部缘时1.0~0.5 cm 处时,停止电泳。 转膜:湿转,150 V 转移130 min。 封闭:将转膜后的PVDF 膜浸入盛有封闭液密闭小盒中,室温封闭1 h。 一抗孵育稀释比例均为1∶300,4℃过夜。 二抗孵育:二抗(二抗稀释比例为1∶3500),室温1 h。 显影:ECL 显影液显影。

表2 扩增程序
1.8 统计学方法
实验数据用SPSS 20.0 软件进行单因素方差分析(ANOVA),用Tamhane 法进行方差齐检验,LSD 法和SNK 法对数据进行两两比较,以P <0.05 为差异有统计学意义。
2 结果
2.1 补骨脂二氢黄酮甲醚对A375 细胞活性的影响
与空白组比较,10-3μmol/L 的雌二醇组对细胞活性的作用无显著性差异(P >0.05);10、100 μmol/L 补骨脂二氢黄酮甲醚组对细胞的活性有显著的抑制作用(P <0.01),1、10-1、10-2、10-3μmol/L 的补骨脂二氢黄酮甲醚组对A375 细胞活性均无显著作用(P >0.05)。见表3。
表3 补骨脂二氢黄酮甲醚对A375 细胞活性的影响(±s,n = 6)

表3 补骨脂二氢黄酮甲醚对A375 细胞活性的影响(±s,n = 6)
注:与空白组比较,**P <0.01;“-”表示无数据
组别 浓度(μmol/L) 吸光度空白组雌二醇组补骨脂二氢黄酮甲醚组-10-3 10-3 10-2 10-1 1 10 100 0.368±0.021 0.366±0.023 0.368±0.026 0.365±0.025 0.363±0.024 0.356±0.024 0.314±0.020**0.108±0.028**
2.2 ICI182780/SP600125 +补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞黑素合成的影响
与空白组比较,雌二醇组对黑素合成有显著的促进作用,差异有高度统计学意义(P <0.01);补骨脂二氢黄酮甲醚组、ICI182780+补骨脂二氢黄酮甲醚组和SP600125+补骨脂二氢黄酮甲醚组对黑素合成有显著的抑制作用,差异有高度统计学意义(P <0.01)。与补骨脂二氢黄酮甲醚组比较,ICI182780+补骨脂二氢黄酮甲醚组和SP600125+补骨脂二氢黄酮甲醚组对黑素合成有上调作用,差异有统计学意义(P <0.05)。见表4。
表4 ICI182780/SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞黑素合成的影响(±s,n = 5)

表4 ICI182780/SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞黑素合成的影响(±s,n = 5)
注:与空白组比较,**P <0.01;与补骨脂二氢黄酮甲醚组比较,#P <0.05;“-”表示无数据
组别 浓度(mol/L) 吸光度空白组雌二醇组补骨脂二氢黄酮甲醚组ICI182780 +补骨脂二氢黄酮甲醚组SP600125 +补骨脂二氢黄酮甲醚组-10-3 10-6 10-6 10-6 0.079±0.004 0.108±0.014**0.039±0.002**0.051±0.001**#0.048±0.006**#
2.3 ICI182780/SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞TYR 活性的影响
与空白组比较,雌二醇组能显著提高TYR 活性,差异有统计学意义(P <0.05);补骨脂二氢黄酮甲醚组、ICI182780+补骨脂二氢黄酮甲醚组、SP600125+补骨脂二氢黄酮甲醚组对TYR 活性有显著的抑制作用(P <0.01)。 与 补 骨 脂 二 氢 黄 酮 甲 醚 组 比 较,ICI182780+补骨脂二氢黄酮甲醚组、SP600125+补骨脂二氢黄酮甲醚组均能显著提高TYR 活性, 差异有高度统计学意义(P <0.01)。 见表5。
表5 ICI182780/SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞TYR 活性的影响(±s,n = 5)

表5 ICI182780/SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞TYR 活性的影响(±s,n = 5)
注:与空白组比较,*P <0.05,**P <0.01;与补骨脂二氢黄酮甲醚组比较,##P <0.01;“-”表示无数据;TYR:酪氨酸酶
组别 浓度(mol/L) 吸光度空白组雌二醇组补骨脂二氢黄酮甲醚组ICI182780+补骨脂二氢黄酮甲醚组SP600125+补骨脂二氢黄酮甲醚组-10-3 10-6 10-6 10-6 0.078±0.003 0.112±0.014*0.041±0.002**0.059±0.004**##0.056±0.004**##
2.4 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 的影响
与空白组比较, 雌二醇组各指标mRNA 表达增强,差异有高度统计学意义(P <0.01);补骨脂二氢黄酮甲醚组下调TYR、TRP-1/2、ERK1/2、JNK2 mRNA 表达,差异有高度统计学意义(P <0.01)。 与补骨脂二氢黄酮甲醚组比较,ICI182780+补骨脂二氢黄酮甲醚组减弱了补骨脂二氢黄酮甲醚下调mRNA 表达的作用,且差异有统计学意义(P <0.05 或P <0.01)。见表6。
2.5 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 表达的影响
与空白组比较,雌二醇组各指标mRNA 表达增强,差异有统计学意义(P <0.05 或P <0.01);补骨脂二氢黄酮甲醚组能明显降低TYR、TRP-1/2、ERK1/2、JNK2 mRNA 的表达, 差异有高度统计学意义 (P <0.01); 与补骨脂二氢黄酮甲醚组比较,SP600125+补骨脂二氢黄酮甲醚组下调TYR、TRP-1、TRP-2 mRNA 表达的作用均被减弱,且差异有统计学意义(P <0.05)。 见表7。
表6 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 的影响(±s,n = 4)

表6 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 的影响(±s,n = 4)
注:与空白组比较,**P <0.01;与补骨脂二氢黄酮甲醚组比较,#P <0.05,##P <0.01;“-”表示无数据
组别 浓度(mol/L) TYR/β-actin TRP-1/β-actin TRP-2/β-actin ERK1/β-actin ERK2/β-actin JNK2/β-actin空白组雌二醇组补骨脂二氢黄酮甲醚组ICI182780+补骨脂二氢黄酮甲醚组-10-3 10-6 10-6 0.490±0.026 0.546±0.022**0.254±0.023**0.282±0.002##0.405±0.018 0.485±0.017**0.069±0.005**0.187±0.018##0.453±0.027 0.544±0.023**0.207±0.028**0.374±0.002##0.496±0.017 0.674±0.021**0.312±0.029**0.534±0.024##0.564±0.033 0.770±0.022**0.344±0.028**0.397±0.018#0.444±0.013 0.565±0.025**0.228±0.023**0.034±0.019##
表7 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 表达的影响(±s,n = 4)
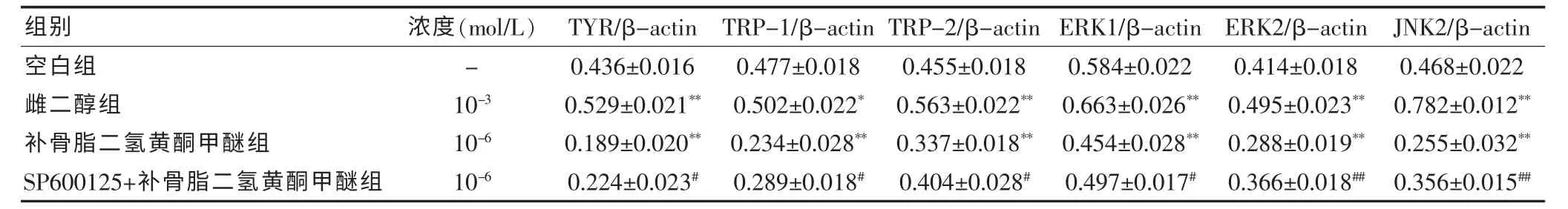
表7 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对A375 细胞mRNA 表达的影响(±s,n = 4)
注:与空白组比较,*P <0.05,**P <0.01;与补骨脂二氢黄酮甲醚组比较,#P <0.05,##P <0.01;“-”表示无数据
组别 浓度(mol/L) TYR/β-actin TRP-1/β-actin TRP-2/β-actin ERK1/β-actin ERK2/β-actin JNK2/β-actin空白组雌二醇组补骨脂二氢黄酮甲醚组SP600125+补骨脂二氢黄酮甲醚组-10-3 10-6 10-6 0.436±0.016 0.529±0.021**0.189±0.020**0.224±0.023#0.477±0.018 0.502±0.022*0.234±0.028**0.289±0.018#0.455±0.018 0.563±0.022**0.337±0.018**0.404±0.028#0.584±0.022 0.663±0.026**0.454±0.028**0.497±0.017#0.414±0.018 0.495±0.023**0.288±0.019**0.366±0.018##0.468±0.022 0.782±0.012**0.255±0.032**0.356±0.015##
2.6 ICI182780+补骨脂二氢黄酮甲醚、 补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响
与空白组比较, 雌二醇组能显著增强TYR、JNK蛋白的表达 (P <0.01); 补骨脂二氢黄酮甲醚组、ICI182780+补骨脂二氢黄酮甲醚组极显著下调TYR、JNK 蛋白表达(P <0.01)。 与补骨脂二氢黄酮甲醚组比较,ICI182780+补骨脂二氢黄酮甲醚组减弱了补骨脂二氢黄酮甲醚下调TYR、JNK 蛋白表达的作用(P <0.01)。 见表8、图1。
2.7 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响
与空白组比较,雌二醇组TYR、JNK 蛋白表达增强(P <0.01);补骨脂二氢黄酮甲醚组、SP600125+补骨脂二氢黄酮甲醚组极显著下调TYR、JNK 蛋白表达(P <0.01)。 与补骨脂二氢黄酮甲醚组比较,SP600125+补骨脂二氢黄酮甲醚组减弱补骨脂二氢黄酮甲醚下调TYR、JNK2 蛋白表达作用(P <0.01)。 见表9、图2。
3 讨论
在人皮肤黑素合成过程中不仅受TYR 及其相关蛋白调控,还受ER 信号通路以及细胞应激和损伤反应的主要信号通路ER-MAPKs 的调控[8-10]。 在黄褐斑患者的皮肤中发现,ER 的表达与色斑的严重程度有着密切的关系[11-13]。
表8 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响(±s,n = 4)
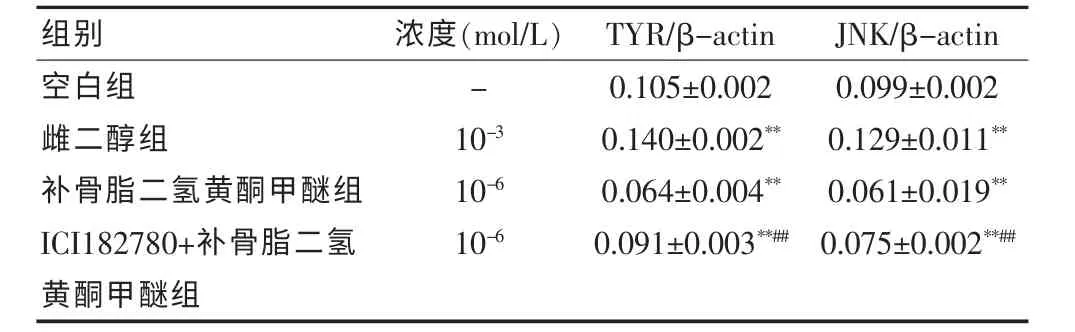
表8 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响(±s,n = 4)
注:与空白组比较,**P <0.01;与补骨脂二氢黄酮甲醚组比较,##P <0.01;“-”表示无数据;TYR:酪氨酸酶
组别 浓度(mol/L) TYR/β-actin JNK/β-actin空白组雌二醇组补骨脂二氢黄酮甲醚组ICI182780+补骨脂二氢黄酮甲醚组-10-3 10-6 10-6 0.105±0.002 0.140±0.002**0.064±0.004**0.091±0.003**##0.099±0.002 0.129±0.011**0.061±0.019**0.075±0.002**##

图1 ICI182780+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响
ER 是存在于靶器官细胞内的一种蛋白质分子,可与雌激素发生特异性结合而形成雌激素-受体复合物,使雌激素发挥其生物学效应。 丝裂原活化蛋白激酶(MAPK)通路在炎症信号转导、细胞凋亡、肿瘤细胞增殖以及参与调控体内多种物质代谢过程中起重要作用。目前已确定在真核细胞中有4 条信号转导通路:ERK 通 路、JNK 通 路、p38 通 路 和ERK5 通 路。ERK、JNK、P38MAPK 均由相邻的苏氨酸 (THR)和TYR 残基双磷酸化而激活,介导细胞生长、发育、分化及死亡全过程。激活细胞增殖及分化的信号调控因子ERK,可引起MITF 磷酸化降解,TYR 活性降低,导致黑素合成减少。JNK 通路可以通过降低cAMP 应答原件结合蛋白 (CREB) 的磷酸化水平, 抑制MITF 和TYR 的表达,实现抑制黑素生成的作用。p38MAPK 信号通路参与了黑素的合成过程,它通过上调酪氨酸酶基因的表达来发挥促进黑素合成的作用[14-16]。 骨脂素可增加T47D 细胞雌激素效应基因PR mRNA 的表达,且促增殖和诱导PR 表达增强的效应均可被雌激素受体拮抗剂ICI182780 所拮抗[17-20]。
表9 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响(±s,n = 4)

表9 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响(±s,n = 4)
注:与空白组比较,**P <0.01;与补骨脂二氢黄酮甲醚组比较,##P <0.01;“-”表示无数据
?
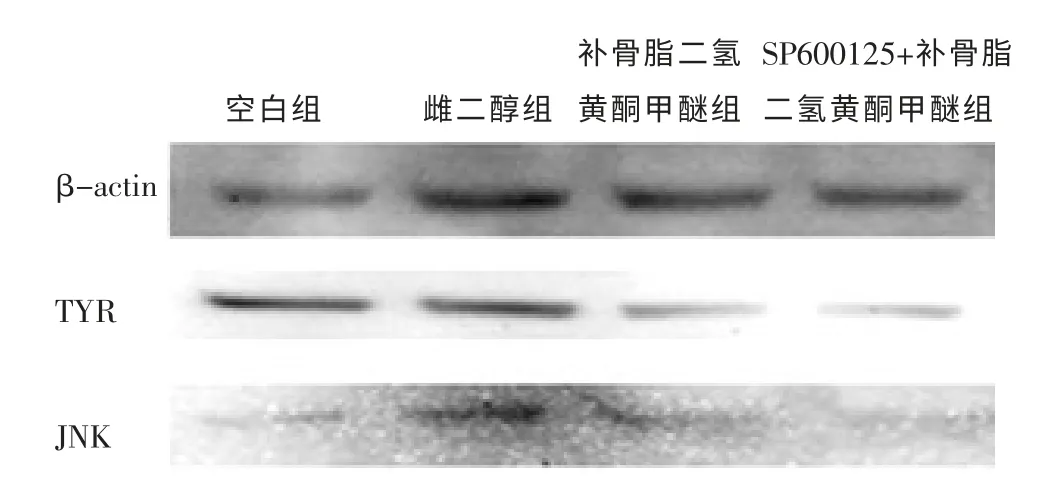
图2 SP600125+补骨脂二氢黄酮甲醚、补骨脂二氢黄酮甲醚对TYR、JNK 蛋白表达的影响
本研究结果显示,补骨脂二氢黄酮甲醚均能显著抑制黑素合成和TYR 活性,而这种抑制作用可被经典ER 受体阻断剂及JNK 受体阻断剂所逆转。 补骨脂二氢 黄 酮 甲 醚 能 显 著 下 调TYR、TRP-1、TRP-2 及ERK1/2、JNK2 mRNA 的表达;TYR、JNK 的蛋白表达也明显下降;基因表达和蛋白表达的下调同样被经典ER 受体阻断剂和JNK 受体阻断剂所削弱。
综上实验结果可推测植物雌激素补骨脂二氢黄酮甲醚下调黑素合成的机制,可能是植物雌激素与雌激素膜受体结合启动第二信使系统, 激活了ERMAPK 关键蛋白激酶ERK、JNK 信号通路而发挥了间接的转录调控作用,使TYR 活性、TYR 及相关蛋白酶表达降低来达到抑制黑素合成的作用。 因此,本实验表明植物雌激素补骨脂二氢黄酮甲醚具有抑制黑素合成的作用,为黄褐斑的治疗提供了一种新的药物开发可能性, 而其治疗黄褐斑的药物机制可能是通过ER-MAPK 信号通路起作用,也为植物雌激素药物的开发奠定了一定的基础。
[1] 周春英,马秋华,徐逢春.黄褐斑的研究进展[J].青岛医药卫生,2009,41(6):431-435.
[2] Shu YY,Maibach HI. Estrogen and skin:therapeutic options [J]. Am J Clin Dermatol,2011,12(5):297-311.
[3] Emmerson E,Hardman MJ. The role of estrogen deficiency in skin ageing and wound healing [J]. Biogerontology,2011,3(4):352-361.
[4] Gold SM,Voskuhl RR. Estrogen and testosterone therapies in multiple sclerosis [J]. Prog Brain Res,2009,175:239-251.
[5] de Giorgi V,Mavilia C,Massi D,et al. The role of estrogens in melanoma and skin cancer [J]. Carcinogenesis,2009,30(4):720.
[6] Mancuso M,Gallo D,Leonardi S,et al. Modulation of basal and squamous cell carcinoma by endogenous estrogen in mouse models of skin cancer [J]. Carcinogenesis,2009,30(2):340-347.
[7] Ng LT,Lin LT,Chen CL,et al. Anti-melanogenic effects of δ-tocotrienol are associated with tyrosinase-related proteins and MAPK signaling pathway in B16 melanoma cells [J].Phytomedicine,2014,21(3):978-983.
[8] 姜泽群.几种中药有效成分促黑色素生成的机制研究[D].武汉:华中科技大学,2009.
[9] Bu J,Ma PC,Chen ZQ,et al.Inhibition of MITF and tyrosinase by paeonol-stimulated JNK/SAPK to reduction of phosphorylated CREB[J].Am J Chin Med,2008,36(2):245-263.
[10] Lim SH,Ha TY,Ahn J,et al. Estrogenic activities of Psoralea corylifolia L.seed extracts and main constituents[J].Phytomedicine,2011,18(5):425-430.
[11] Xin D,Wang H,Yang J,et al. Phytoestrogens from Psoralea corylifolia reveal estrogen receptor-subtype selectivity [J]. Phytomedicine,2010,17(2):126-131.
[12] ZhaoE,MuQ.Phytoestrogenbiologicalactionsonmammalian reproductive system and cancer growth [J]. Sci Pharm,2011,79(1):1-20.
[13] 肖艳,刘祯,邓燕.复方中药治疗黄褐斑的实验研究[J].现代中西医结合杂志,2009,18(9):1056-1058.
[14] Xu Y,Zhang Z,Geng F,et al.Treatment with qing'e,a kidney invigorating Chinese herbal formula,antagonizes the estrogen decline in ovariectomized mice[J].Mary Ann Liebert,2010,13(4):497-488.
[15] Jang JY,Kim HN,Kim YR,et al. Partially purified components of Nardostachys chinensis suppress melanin synthesis through ERK and Akt signaling pathway with cAMP down-regulation in B16F10 cells [J]. J Ethnopharmacol,2011,137(3):1207-1214.
[16] 赵丕文,牛见昭,王继峰,等.补骨脂素的植物雌激素作用及其机制探讨[J].中国中药杂志,2008,33(1):59-62.
[17] Tang JY,Spaunhurst KM,Chlebowski RT,et al.Menopausal hormone therapy and risks of melanoma and nonmelanoma skin cancers:women's health initiative randomized trials[J].Natl Cancer Inst,2011,103(19):1469-1475.
[18] 张宁,刘慧,张明磊,等.逍遥散有效部位对A375 与HacaT 细胞共培养模型的TYR 及其相关蛋白mRNA表达的影响[J].中药材,2014,37(6):1039-1043.
[19] 简丹.己烯雌酚对黑素合成的影响及机制研究[D].长沙:中南大学,2011.
[20] 赵玲玲,张理平.抑制酪氨酸酶药物研究新进展[J].海峡药学,2009,21(12):124-126.

