真性红细胞增多症患者骨髓间充质干细胞体外造血支持功能研究
孙 仪 段永娟 李 芳,2 吕军强 白 洁 刘汉芝 胡 晓
1.中国医学科学院北京协和医学院血液病医院 血液学研究所实验血液学国家重点实验室,天津 300020;2.山东大学附属济南市中心医院医学实验诊断中心,山东济南 250013
真性红细胞增多症(polycythemia vera,PV)是一种起源于克隆性造血干细胞的骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)[1], 其临床表现除红系增多外,通常也伴随粒系和血小板异常升高。 临床上将PV 分为增殖期(多血期)和消耗期(多血后期)。疾病进展至消耗期的患者红细胞生成逐渐减少,骨髓发生无效造血导致贫血,常伴随骨髓纤维化。 少部分患者进一步转化为预后不良的骨髓增生异常综合征(myelodysplastic syndromes,MDS)或白血病[2]。
骨髓间充质干细胞 (bone marrow stem cell,BMSC)是骨髓造血微环境的重要组成部分, 参与多种血液系统疾病的发生和发展。 近年来研究发现,在MDS及多种白血病中均存在BMSC 功能或细胞遗传学的改变,这种改变对造血干细胞功能异常重要[3-4]。 对MPN 患者骨髓微环境的研究尚在起步阶段[5-6]。 本研究分离初诊PV 患者的BMSC 并对其造血支持功能进行分析,为进一步研究骨髓微环境在PV 疾病进展过程中的作用提供一定依据。
1 资料与方法
1.1 一般资料
2011 年5 月~2012 年7 月在中国医学科学院血液病医院(以下简称“我院”)就诊的9 例初诊PV 患者,诊断标准参照WHO 规定的PV 诊断标准[7],其中男4 例,女5 例;年龄29~83 岁,中位年龄61 岁;其中7 例JAK2 V617F 突变阳性,2 例突变阴性;3 例与患者无血缘关系的健康志愿者。在患者及健康志愿者知情同意下获得其样本,实验方案获得我院伦理委员会审核通过。
1.2 BMSC 分离培养
各取PV 患者和健康志愿者骨髓5 mL, 肝素抗凝,用Ficoll 法分离单个核细胞,在含有2 ng/mL 碱性成纤维细胞生长因子 (bFGF)、10 ng/mL 表皮生长因子(EGF)(均购自Peprotech 公司)、1%青霉素/链霉素和10%胎牛血清的DMEM-F12 培养基(均购自GIBCO 公司)中培养,培养48 h 后换液除去未贴壁细胞,此后每隔3 d 换液1 次。 当细胞达到90%融合时,按1∶2 传代。 取第3 代至第6 代细胞用于后续实验。
1.3 细胞免疫表型鉴定
制备PV-BMSC 的单细胞悬液, 分别加入1 μL下 述 鼠 抗 人 荧 光 抗 体CD29、CD31、CD34、CD44、CD45、CD49e、CD73、CD90、CD105 (均为PE 标记)、CD14(APC 标记)和相应荧光素标记的鼠同型对照抗体(均为eBioscience 公司产品),避光孵育30 min 后,离心洗涤未结合抗体,流式细胞仪检测。 使用Diva 软件(购自BD Biosciences 公司)进行数据分析。
1.4 BMSC 的诱导分化
真性红细胞增多症患者来源的骨髓间充质干细胞 (PV-BMSC) 和正常人来源的骨髓间充质干细胞(NM-BMSC)按1×104/cm2分别接种于6 孔板内,融合度达80%时,将培养基更换为成脂或成骨分化诱导培养基。成骨和成脂分化诱导培养基配方及实验方法参考文献[8]。
1.5 BMSC 的体外造血支持功能检测
PV-BMSC 和NM-BMSC 按4×104/孔 接 种 于24孔板;在含2 ng/mL bFGF、10 ng/mL EGF、1%青霉素/链霉素和10%胎牛血清的DMEM-F12 培养基中培养24 h 后,按1×104/孔加入脐带血来源的CD34+造血干祖细胞(HSPC)(CD34 阳性率大于90%),用无血清造血干细胞培养基StemspanTMSFEM(购自Stemcell Techologies 公司)培养7 d 后,收集悬浮细胞,细胞计数、 检测CD34+细胞比例并计算共培养后总细胞及CD34+HSPC 的扩增倍数。
2 结果
2.1 PV-BMSC 的细胞形态
从PV 患者和健康志愿者骨髓中分离的单个核细胞培养24 h 后可见贴壁细胞。 培养3~4 d 后集落增大,2~3 周后细胞融合度达到80%~90%。 光镜下观察,贴壁细胞呈梭形或多角形;传至第3 代后,细胞形态较为均一,成涡旋状排列。PV-BMSC 和NM-BMSC的生长速度和细胞形态无明显差异。 见图1。
图1 PV-BMSC 和NM-BMSC 的形态比较
2.2 PV-BMSC 的细胞表面标记
采用流式细胞术分析细胞表面标记。 9 株PV-BMSC 细胞均高表达CD73、CD90、CD105 和CD44 等间充质干细胞相关分子 (>90%), 不表达CD14、CD31、CD34 和CD45 等造血和内皮细胞相关的分子(<0.1%)。
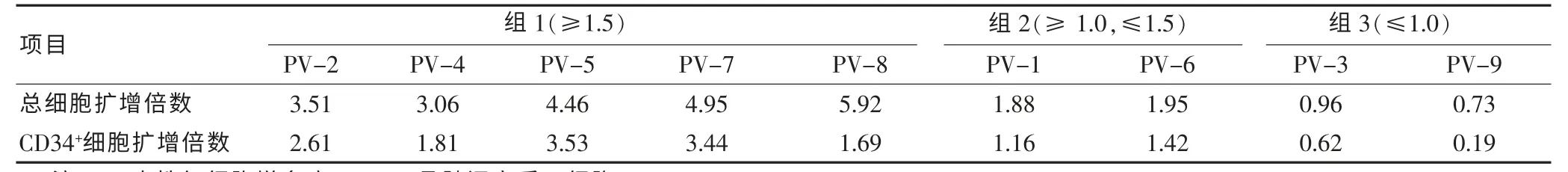
表1 PV-BMSC 体外造血支持功能
2.3 PV-BMSC 的成骨和成脂分化潜能
对本研究中分离的9 株PV-BMSC 分别进行成骨和成脂分化诱导实验,以NM-BMSC 作为对照。 经油红O 和Von Kossa 染色法证明PV-BMSC 具有与NM-BMSC 相似的多向分化潜能(图2,封三)。

图2 PV-BMSC 和NM-BMSC 的成脂及成骨分化(见内文第11 页)
2.4 PV-BMSC 的体外造血支持功能
在无血清和外源造血细胞因子支持的条件下,将上述分离的9 株PV-BMSC 分别与人脐带血来源的CD34+HSPC 用StemspanTMSFEM 共培养7 d,细胞计数,分析CD34+HSPC 细胞比例并计算总细胞及CD34+HSPC 细胞扩增倍数,结果见表1。 按照细胞扩增结果, 将9 株PV-BMSC 分为三组: 第一组5 株PV-BMSC 细胞(55%)总细胞和CD34+HSPC 扩增均大于1.5 倍, 第二组PV-BMSC 细胞PV-1 和PV-9(22%)CD34+HSPC 扩增小于1.5 倍, 第三组PVBMSC 细胞PV-3 和PV-9 (22%) 总细胞和CD34+HSPC 均未增加(小于1 倍)。
3 讨论
PV 是携带JAK2 等基因突变的恶性造血干细胞的克隆性增殖引起的一类恶性血液病[9],但靶向JAK2的抑制剂及其他骨髓抑制类药物未能完全治愈该类疾病[10-11]。 造血微环境对造血干细胞的增殖和分化有重要的调节作用,BMSC 是造血微环境的重要组成细胞, 因此研究MPN 患者的骨髓微环境可能为疾病治疗提供新方案。 本研究以初诊PV 患者骨髓中分离的BMSC 作为研究对象,分析了患者BMSC 的造血支持功能,以期为PV 病程的进展和转归提供更多的临床预后标志。
本研究分离培养了9 株PV-BMSC, 分离所得细胞在生长速度、细胞形态、免疫表型及成骨和成脂分化能力等方面均与NM-BMSC 没有明显差异。选取的PV 患者中7 例携带JAK2 V617 基因突变,其余2 例不携带该突变, 但RT-PCR 方法检测后未发现PVBMSC 中存在JAK2 V617 基因突变(未发表数据),与田竑等[12]和段丽敏[13]早前的研究结果一致,提示JAK2基因突变仅存在于造血干祖细胞。
MSC 可以通过分泌细胞因子和细胞间直接接触发挥造血支持功能[14-15]。 2014 年,Schneider 等[5]发现PV-BMSC 培养上清对人HSPC 的体外造血集落(CFU)支持能力低于正常对照,提示PV-BMSC 的造血支持功能发生改变。 本研究发现, 初诊PV 患者BMSC 的造血支持功能呈现出明显的个体差异性。 只有半数左右患者(约占55%)的BMSC 仍具有支持HSPC 增殖的功能,大约有22%的患者(PV-3 和PV-9)的BMSC 发生HSPC 扩增支持功能的显著缺失。 利用造血集落形成实验也验证了造血支持功能低下的PV-BMSC 对造血集落及各系分化的影响与对细胞扩增的结果一致 (未发表数据)。 通过对比病例资料发现,PV-BMSC 造血支持功能改变与患者的年龄、性别及JAK2 基因突变均无明确相关性。
Schneider 等[5]的工作仅比较了5 例JAK2 突变阳性的男性患者的BMSC 上清与正常BMSC 上清造血支持功能。 本研究则对比了4 例男性及5 例女性(其中7 例JAK2 V617 突变阳性和2 例阴性)PV 患者的BMSC 细胞共培养后的造血支持功能。
骨髓纤维化、MDS 或急性髓系白血病等几类疾病的患者中均可检测到BMSC 失去部分造血支持功能[16-17]。 初诊PV 患者的BMSC 的造血支持功能改变是否与PV 疾病进展有关尚未见相关报道。 本研究发现PV-BMSC 的造血支持功能具有显著的个体差异性将为回答这一问题提供一定的实验依据。 由于PV进展的病程较长[18]以及BMSC 存在异质性,下一步笔者将在条件许可的情况下扩大研究的患者数,进行列队分析和长期追踪。
MSC 可通过多种机制发挥造血支持功能。已有报道显示,PV 患者的血清中,多种细胞因子水平(如白细胞介素-6、白细胞介素-11、白血病抑制因子、巨噬细胞集落刺激因子和干细胞因子等)异常[19-20]。在本研究结果的基础上,笔者将通过细胞因子芯片、二代测序等技术,进一步发掘新的调控造血支持功能的细胞因子和基因,以期揭示影响个体PV 患者BMSC 造血支持功能的分子机制。
[1] Jaffe ES,Harris NL,Stein H,et al. Pathology & genetics of tumors of haematopoietic and lymphoid tissues [M].IARC,WHO,2001.
[2] 张之南.血液病学[M].北京:人民卫生出版社,2011:936-938.
[3] Zhao ZG,Xu W,Yu HP,et al. Functional characteristics of mesenchymal stem cells derived from bone marrow of patients with myelodysplastic syndromes [J]. Cancer Letters,2012,317(2):136-143.
[4] Pavlaki K,Pontikoglou CG,Demetriadou A,et al. Impaired proliferative potential of bone marrow mesenchymal stromal cells in patients with myelodysplastic syndromes is associated with abnormal wnt signaling pathway [J]. Stem Cells Dev,2014,23(14):1568-1581.
[5] Schneider RK,Ziegler S,Leisten I,et al. Activated fibronectin -secretory phenotype of mesenchymal stromal cells in pre-fibrotic myeloproliferative neoplasma [J]. J Hematol Oncol,2014,7(1):1-4.
[6] Arranz L,Sanchez-Aguilera A,Martin-Perez D,et al. Neuropathy of haematopoietic stem cell niche is essential for myeloproliferative neoplasma[J].Nature,2014,512(7512):78-81.
[7] Ayalew T,Juergen T,Attilio O,et al. Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera,essential thrombocythemia,and primary myelofibrosis:recommendation from an ad hoc international expert panel [J]. Blood,2007,4(110):1092-1097.
[8] Zheng C,Yang S,Guo Z,et al. Human multipotent mesenchymal stem cells from fetal lung expressing pluripotent markers and differentiating into cell types of three germ layers [J]. Cell Transplant,2009,18(8):1093-1109.
[9] James C,Ugo V,Couedic JP,et al. A unique clonal Jak2 mutation leading to constitutive signaling causes polycythaemia vera [J]. Nature,2005,434(7037):1144-1148.
[10] Kiladigian JJ,Winton EF,Talpaz M,et al. Ruxolitinib for the treatment of patients with polycythemia vera [J]. Exper Rev Hematol,2015,8(4):391-401.
[11] Debeume F,Lacout C,Moratal C,et al. JAK2 inhibition has different therapeutic effects according to myloproliferative neoplasm development in mice [J]. J Cell Mol Med,2015,19(11):2564-2574.
[12] 田竑,陈广华,徐杨,等.骨髓增殖性肿瘤患者骨髓间充质干细胞生物学特性极其JAK2 突变的研究[J].中华血液学,2012,33(9):701-704.
[13] 段丽敏.真性红细胞增多症的细胞遗传学极其骨髓间充质干细胞功能特性的研究[D].南京:南京医科大学,2007.
[14] Khoury M,Drake A,Chen Q,et al. Mesenchymal stem cells secreting angiopoietin-like-5 support efficient expansion of human hematopoietic stem cells without compromising their repopulating potential [J]. Stem Cells Dev,2011,20(8):1371-1381.
[15] Gottschling S,Saffrich R,Seckinger A,et al. Human mesenchymal stromal cells regulate initial self-renewing divisions of hematopoietic progenitor cells by a β1-integrin-dependent mechanism [J]. Stem Cells,2007,25(5):798-806.
[16] Johnson RC,Kurzer JH,Greenberg PL,et al. Mesenchymal stromal cell density is increased in higher grade myelodysplastic syndromes and independently predicts survival [J]. Am J Clin Pathol,2014,142(6):796-802.
[17] Kim JA,Shim JS,Lee GY,et al. Microenvironmental remodeling as a parameter and prognostic factor of heterogenous leukemogenesis in acute myelogenous leukemia [J]. Cancer Res,2015,75(11):2222-2231.
[18] Passamonti F,Malabarba L,Orlandi E,et al. Polycythemia vera in young patients:a study on the long-term risk of thrombosis,myelofibrosis and leukemia [J]. Haematologica,2003,88(1):13-18.
[19] Pourcelot E,Trocme C,Mondet J,et al. Cytokine profiles in polycythemia vera and essential thrombocythemia patients:clinical implications [J]. Exp Hematol,2014,42(5):360-368.
[20] Boissinot M,Cleyrat C,Vilaine M,et al. Anti-inflammatory cytokines hepatocyte growth factor and interleukin-11 are over-expressed in Polycythemia vera and contribute to the growth of clonal erythroblasts independently of JAK2V617F [J]. Oncogene,2011,30(8):990-1001.

