新疆北部棉铃虫寄主来源与转基因棉区庇护所评估
李 娜, 张 娟, 刘永健, 张 豹, 熊建喜, 王佩玲,*, 吕昭智
1 石河子大学农学院植保系, 石河子 832003 2 147团农业科植保站, 石河子 832045 3 121团农机推广站, 石河子 832066 4 中国科学院新疆生态与地理研究所, 中国科学院干旱区生物地理与生物资源重点实验室, 乌鲁木齐 830011
新疆北部棉铃虫寄主来源与转基因棉区庇护所评估
李 娜1, 张 娟4, 刘永健2, 张 豹3, 熊建喜3, 王佩玲1,*, 吕昭智4
1 石河子大学农学院植保系, 石河子 832003 2 147团农业科植保站, 石河子 832045 3 121团农机推广站, 石河子 832066 4 中国科学院新疆生态与地理研究所, 中国科学院干旱区生物地理与生物资源重点实验室, 乌鲁木齐 830011
转Bt基因抗虫棉长期大规模种植后,棉铃虫对其存在抗性风险,庇护所是延缓抗性上升的策略之一。但在新疆北部转基因棉区,庇护所提供敏感棉铃虫的生态功能尚未见评估。2013年5—9月期间在新疆北部石河子地区147团、121团利用棉田边缘的智能测报灯收集棉铃虫成虫,应用碳稳定同位素技术从群体水平(混合翅膀)分析虫源性质,从个体水平(雌蛾翅膀和对应精包)确定交配类型;同时通过解剖雌性棉铃虫体内的精包数量评估交配频率。结果表明:来源于C4植物的棉铃虫主要出现在5月下旬和8—9月期间,比例占到50%左右;6—7月接近100%的棉铃虫来自于C3植物上;经测定不同寄主来源棉铃虫的有效交配比例为10%左右;两个地方的棉铃虫交配频率一般在0.9—2.1 次,但121团的第一代和第二代均高于147团。玉米是新疆北部地区重要的庇护所,但C3和C4来源棉铃虫同存的时间比较短,有效交配比例相对比较低,影响了庇护所的抗性稀释能力。在转基因棉区的抗性管理中不仅要考虑庇护所提供敏感棉铃虫数量大小,同时需要考虑有效交配比率,这将有利深刻理解庇护所生态功能。
碳稳定同位素技术; 棉铃虫; 害虫抗性管理; 庇护所
转Bt(Bacillusthuringiensis)抗虫棉自1997年在我国商业化种植以来,对我国棉区棉铃虫(Helicoverpaarmigera)种群数量和危害有显著的抑制作用[1-3],但在转Bt抗虫棉大面积使用推广过程中,存在着一系列潜在的环境安全问题,尤其是害虫对Bt毒蛋白的抗性风险[4-7]。为了有效地延缓Bt抗性上升,Bt毒蛋白在转基因作物中高效表达、双价基因及庇护所等技术和策略已经在生产中实施与推广[8]。
庇护所是在田间应用比较成功的的抗性治理策略之一[9-11]。美国、澳大利亚等国家普遍采用庇护所的方法进行抗性治理[9],种植户必须种植一定比例的非转基因抗虫棉或其它作物作为棉铃虫的庇护所:(1)在转基因棉田中设立4%面积的常规棉且不使用杀虫剂;(2)80%的转Bt抗虫棉与20%的使用农药的常规棉[9, 12-14]。在我国黄河流域和长江流域抗虫棉区,实施的“零庇护所策略”[15],农田结构多样地种植玉米、小麦、大豆和花生等寄主作物可培育敏感的棉铃虫,从而起到天然庇护所作用[16-18]。
如何在农田景观尺度上分辨不同比例虫源(特别是来源于抗虫棉与庇护所)是评估和设计庇护所的核心。稳定同位素技术为农田系统中多食性害虫虫源分析提供了有效的途径,特别是幼虫期的寄主来源不同。棉铃虫成虫的碳稳定性同位素数据可以反映棉铃虫幼虫取食寄主类型:取食C3植物(棉花)与C4植物(常见为玉米)的棉铃虫翅具有不同范围的δ13C值,两者之间并无重叠区域[19]。Baker[20]采用碳稳定性同位素证实了澳大利亚来自于C4植物的棉铃虫达到50%以上,同时也证明了来自于棉花和庇护所的棉铃虫之间的交配是随机的。叶乐夫[21-22]通过碳稳定同位素技术分析了河北棉区第三代棉铃虫来源于C4植物(玉米)的比例为40.5%—56.8%,但是来自于C4植物的棉铃虫与来自于C3植物的在时间上存在着交配非同步性[21];越冬代棉铃虫来自于C3和C4植物的比例也是接近的,但实验中测定棉铃虫的数量是比较有限的[22]。新疆绿洲岛屿化分布、作物景观均质(很多区域70%以上是棉花)、耕作制度单一,在一定程度上决定了抗性风险高于内地以小农户种植为主的抗虫棉地区,已有研究表明了新疆部分区域棉铃虫的抗性基因频率呈上升趋势[23],可见庇护所评估问题对该地区抗性治理尤为迫切。
转基因抗虫棉在新疆种植已有10余年,国内对新疆地区棉铃虫抗性监测、潜在庇护所评估等研究相对较少[24-27]。本试验以棉铃虫抗性管理的生态学措施为背景,以棉铃虫寄主来源和交配选择为研究主线,评估新疆北部农田系统对棉铃虫抗性管理。
1 材料与方法
1.1 试验地点
选择新疆北部石河子地区的147团和121团两个试验点,两地点相距60 km。147团(86°6′E,44°35′N)棉花占总耕地面积的80%,玉米多以10—20 hm2为种植单元,占总耕地面积的5%;121团(85°35′E,44°49′N)棉花占耕地面积的90%,玉米主要以条带方式在棉田边缘种植(宽度为1.5 m),占耕地面积的2%。
1.2 试验方法
1.2.1 收集方法
采用频振式杀虫灯(PS-15-2,佳多科工贸有限责任公司)诱集棉铃虫成虫。于2013年5月—9月在越冬代、第一代、第二代棉铃虫成虫发生期分别收集147团棉铃虫成虫,每代棉铃虫各收集7 次,每隔2d采集1次,每个收集日内诱集到的棉铃虫成虫浸泡在95%酒精里,贴好标签带回实验室进行分析。121团没有收集越冬代棉铃虫,在第一代、第二代棉铃虫发生期每天都进行收集。棉铃虫动态监测数据来自147团测报站。
1.2.2 棉铃虫雌性生殖系统解剖及测试样品准备
随机挑取每代棉铃虫每个收集日期内的雌蛾30 头,解剖生殖系统,拨出交配囊,挑出精包,再将每个雌蛾的左前翅和精包一一对应,放入1.5 mL的离心管中,在95%的酒精里进行保存,做好标记备用。
随机挑取每代棉铃虫每个收集日期内的雄蛾,每个日期内均取50 头雄蛾的左前翅混合成1个样品放入5 mL的离心管中,在95%的酒精里进行保存备用。
1.2.3 碳稳定同位素检测
(1) 测定仪器
本实验所测定的样品统一编号送北京巴斯特防治荒漠化科技研究所进行碳稳定同位素测定。
碳稳定同位素比值测定仪器:主机型号:DELTA V Advantage 同位素比率质谱仪(Isotope Ratio Mass Spectrometer)元素分析仪(Thermo Fisher Scientific, Inc., USA.)
研磨样品使其均匀,样品在元素分析仪中高温燃烧后生成CO2,质谱仪通过检测CO2的13C与12C比率,并与国际标准物(Pee Dee Beleminite或PDB)比对后计算出样品的δ13C比率值。测定精度:δ13C ± <0.1%。
(2) 棉铃虫虫源性质测定
单个测样的样本较多,测试费用昂贵,因此采用群体测样的方法对所取的每个收集日期的雄蛾混合翅做为一个样本进行碳稳定同位素分析。147团共23个样,121团共25个样。
(3) 标准曲线的制作方法
将初孵化的棉铃虫幼虫分别移入常规棉花(C3作物)和玉米(C4作物)上,在这些植物上饲养并得到蛹,将蛹分别收集并等待羽化为蛾,在两种植物上各取250 头成虫,分别取左前翅,按照C3∶(C3+C4)=0%;25%;50%;75%;100%的比例混合,分析这5 个混合样的碳稳定性同位素值,绘制棉铃虫翅的碳稳定性同位素校准曲线。来自于不同寄主的棉铃虫翅的混合比例如下:
1)比例0% 来自于C3植物的棉铃虫翅0 只,来自于C4植物的棉铃虫翅100 只;
2)比例25% 来自于C3植物的棉铃虫翅25 只,来自于C4植物的棉铃虫翅75 只;
3)比例50% 来自于C3植物的棉铃虫翅50 只,来自于C4植物的棉铃虫翅50 只;
4)比例75% 来自于C3植物的棉铃虫翅75 只,来自于C4植物的棉铃虫翅25 只;
5)比例100% 来自于C3植物的棉铃虫翅100 只,来自于C4植物的棉铃虫0 只。
(4) 不同植物来源棉铃虫交配
根据1.2.3(2)所群体所测定的棉铃虫的虫源性质,选择147团C4来源比例大的5月20日、7月30日、8月5日的雌蛾,再分别单个测定已经解剖好的(见1.2.2)30头棉铃虫雌蛾左前翅和对应精包的δ13C值,明确雌蛾和与其交配雄蛾的寄主来源,即可得棉铃虫的不同交配类型比例,类型分为C3(雌)×C3(雄);C3(雌)×C4(雄);C4(雌)×C3(雄);C4(雌)×C4(雄),测定方法见1.2.3.1,测试结果参考Gould[19]以及叶乐夫[21-22]等对棉铃虫成虫翅的测定数据,来自C4植物寄主(如玉米、高粱等)的稳定同位素比值位于(-17.013)—(-12.382)范围,来自于C3植物(如棉花、小麦等)稳定同位素比值位于(-31.061)—(-22.759)范围。
(5) 棉铃虫交配频率监测
棉铃虫交配囊内精包柄有几根表明交配几次[28],如果精包柄在解剖中被拉断,即可撕开交配囊体,检查精包残体数,记录棉铃虫交配次数。
1.3 数据处理
应用Microsoft Office Excel2003、Origin8.5处理图形和回归方程;交配频率=雌成虫总交配次数/雌成虫总量。
2 结果与分析
2.1 棉铃虫田间动态
棉铃虫在新疆北部每年发生3 代。147团2006—2012年灯下蛾量的平均值表明:越冬代成虫发生期为5月6日—6月10日,高峰期在5月23日左右;第一代成虫发生期为6月15日—7月15日,高峰期在6月28日左右;第二代成虫发生期为7月20日—9月10日,高峰期在8月5日左右。2013年智能测报灯下棉铃虫成虫,高峰期分别为:越冬代在5月20日,第一代在6月30日,第二代在8月6日(图1)。
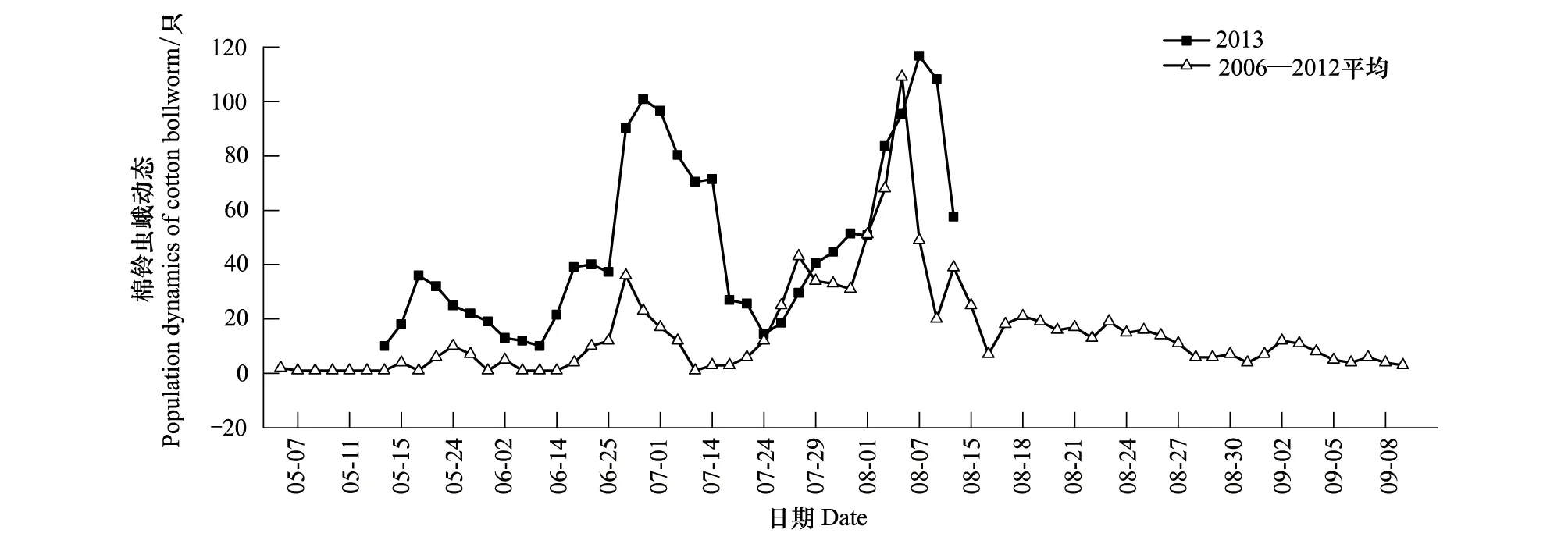
图1 147团棉铃虫成虫种群动态图Fig.1 Population dynamics of H.armigera in 147th regiment in Northern Xinjiang
2.2 棉铃虫虫源分析
2.2.1 标准曲线的计算结果
所建立的标准曲线为:y=-11.04-0.13x(R2=0.9824,P<0.0001),式中,y是每个日期内群体样所测定δ13C值,x是C3所占的比例(图2)。将群体所测定的值(y)代入此方程,便能计算出来源C3植物棉铃虫的比例(x)。
2.2.2 棉铃虫的虫源性质
2013年在6月1日—7月26日之间147团和121团棉铃虫均为C3来源比例高(达95%),C4比例较少(5%),但147团6月16日的棉铃虫C4来源比例为54.46%。5月下旬,147团棉铃虫C4来源比例为46.29%,C3来源比例为53.71%;8月上旬,147团C4来源的比例58.10%,C3比例41.90% 9月份C4来源比例53.74%,C3比例46.26%,均是C3和C4比例相当,而121团C3来源比例为95.69%,C4比例为4.31%(图3)。
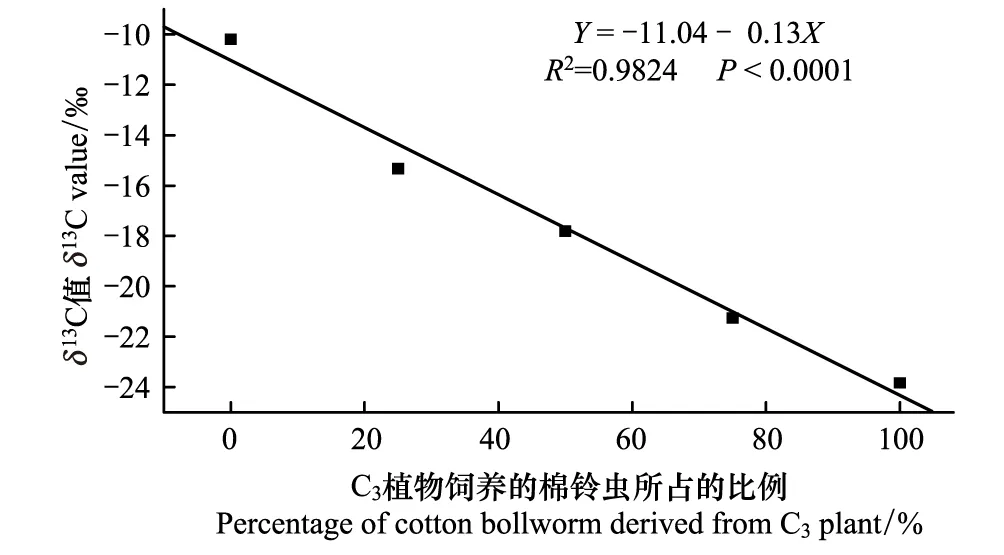
图2 棉铃虫翅的碳稳定性同位素校准曲线 Fig.2 Calibration curves for the percentage of C3 vs.C4-derived H.armigera moths
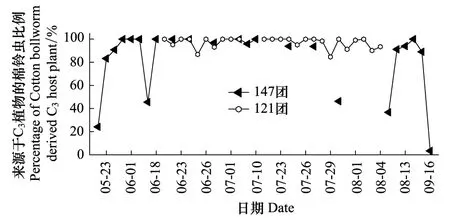
图3 2013年新疆北部地区田间棉铃虫成虫C3比例 Fig.3 Percentage of H.armigera adults derived C3 hosts in the fields in Northern Xinjiang in 2013
2.3 棉铃虫交配选择
2.3.1 不同寄主来源棉铃虫交配选择
147团棉铃虫交配情况如图4所示,2013年5月20日C3来源比例为75.8%,C4来源比例为24.2%,(C3∶C4比例接近3∶1);而棉铃虫C4来源和C3来源的交配比例为8.89%,C4和C4来源交配比例为2.22%,同为C3来源的交配比例为88.89%。7月30日棉铃虫C3来源比例为46.33%,C4来源比例为53.67%,C3∶C4比例接近1∶1;而棉铃虫C4来源和C3来源的交配比例为13.33%,C4和C4来源交配比例为6.67%,同为C3来源的交配比例为80.00%;8月5日棉铃虫,C3来源比例为36.74%,C4来源比例为63.26%,C3∶C4比例接近1∶1.5;而棉铃虫C4来源和C3来源的交配比例为8.33%,同为C3来源的交配比例为是91.66%(图4)。
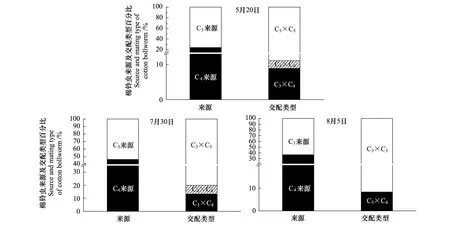
图4 田间不同来源棉铃虫的交配情况Fig.4 Mating of H.armigera from different host plant in the fields
2.3.2 棉铃虫交配频率
2013年新疆北部石河子地区两试验点棉铃虫交配频率如下:121团第一代棉铃虫平均交配频率为(1.43±0.40) 次/头,147团棉铃虫平均交配频率为(1.0±0.56)次/头;第二代棉铃虫121团棉铃虫平均交配频率为(2.13±0.31) 次/头,147团棉铃虫平均交配频率为(0.93±0.21) 次/头(表1)。 121团棉铃虫交配频率在第一代和第二代均高于147团。
两地棉铃虫在高峰期交配频率一般可达到最大,但147团第二代高峰期8月5日例外,147团越冬代高峰期5月23日为2.8 次/头;第一代高峰期7月3日为2 次/头;第二代7月24日最大为2.2 次/头,高峰期8月5日为1.1 次/头。121团第一代雌蛾有两个高峰期为6月26日为1.9 次/头和7月2日为2.3 次/头,第二代棉铃虫的交配最高可达2.8 次/头(图5)。
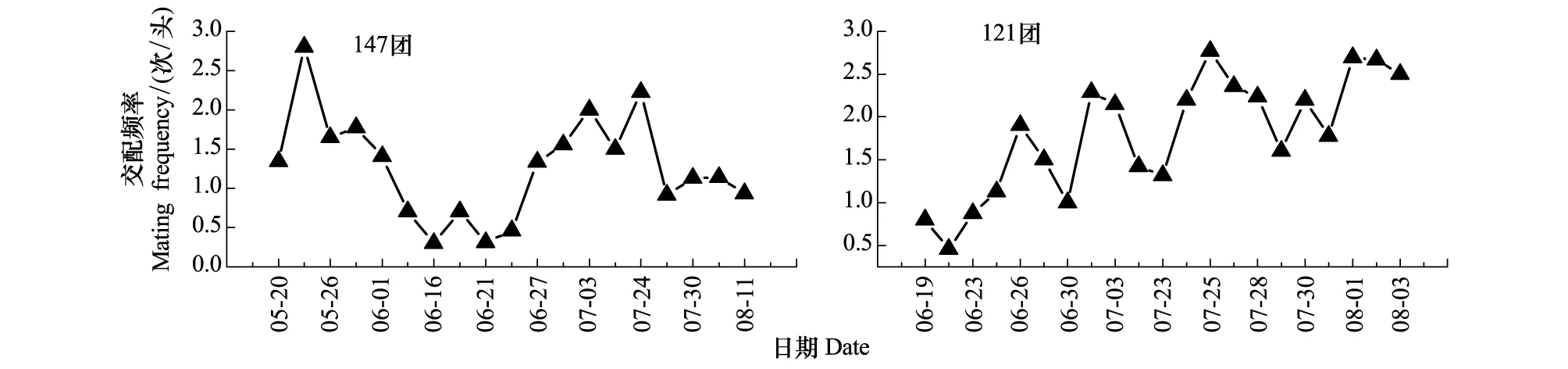
图5 棉铃虫交配频率动态图Fig.5 Dynamics of mating frequency of H.armigera
3 讨论
(1) 棉铃虫迁飞性与其虫源性质
Head研究表明:在美国棉区5个州阿肯色州、密西西比、格鲁吉亚、北卡罗莱纳州、路易斯安那州来源于C4植物的棉铃虫主要出现在6月中旬到7月中旬[29],Gould研究结果表明:在路易斯安那州棉铃虫来源于C4植物主要出现在5月、8月和9月[19],结果不同可能与当年棉铃虫存在迁飞有关。本试验结果表明:在2013年新疆北部棉区147团来源C4植物的棉铃虫主要出现在5月、8月和9月,尽管121团没有越冬代的数据,但在6—7月期间,棉铃虫寄主来源与147团相似,C4的比例很少,小于5%。在新疆北部棉区玉米主要在次年5月和当年8、9月为棉铃虫提供庇护所,在6—7月间玉米庇护所对敏感性棉铃虫贡献很小,Lü的研究也表明在新疆玉米是第二代棉铃虫的主要寄主[30],与本研究结果一致。147团6月16日出现了大量C4植物来源的棉铃虫,可能是迁飞而来,而7月30日的棉铃虫可能是近距离扩散而来。在2013年的连续动态解剖棉铃虫卵巢也表明了棉铃虫在新疆1—2代中存在大量的迁入种群(未发表),张娟的研究也表明了棉铃虫在新疆北部地区存在迁飞性[31]。
(2) 交配频率与有效交配
121团和147团棉铃虫交配情况不同(图4和表1)。121团第一、二代棉铃虫交配频率高于147团,这可能与同一寄主上棉铃虫发育比较整齐有关,因为147团种植5%饲料或者食用玉米,均为结构性庇护所种植,并且在玉米上化学杀虫剂使用较少,该区域棉铃虫主要来源于玉米和棉花;而121团玉米种植比例<2%,采用诱集带种植模式,多采用化学方法防治玉米上的螨类,棉铃虫主要来源于棉花,发育相对比较整齐。张娟[31]2010和2012年的数据也表明棉铃虫交配率在作物相对复杂的农田比较低,与本研究结果是一致的。玉米上棉铃虫的发育历期、成虫羽化期比棉花上的长2d左右[32],因此本实验结果中147团交配频率低可能是来自棉花和玉米上的棉铃虫发育不同步,交配时间不能完全配合造成的。本研究中没有测定121团越冬代棉铃虫来源的差异及其交配情况,有待于进一步研究。
(3) 提高庇护所功能的措施
转基因抗虫棉在新疆大规模种植,可制定法规强制农户和企业种植一定面积的玉米,为抗虫棉区域提供足够数量的敏感棉铃虫,延缓抗性产生;另外可种植其它种类的植物如鹰嘴豆等非转基因植物作为棉铃虫的寄主,增加一定数量的敏感品系棉铃虫数量[27],应进一步研究作物结构复杂性对棉铃虫发育同步性的影响,优化设计新疆庇护所种植模式,实现棉铃虫对转基因棉花抗性的持续治理。
[1] Gao Y L, Wu K M, Gould F. Frequency of Bt resistance alleles inH.armigeraduring 2006—2008 in northern China. Environmental Entomology, 2009, 38(4): 1336-1342.
[2] Wu K M, Lu Y H, Feng H Q, Jiang Y Y, Zhao J Z. Suppression of cotton bollworm in multiple crops in China in areas with Bt toxin-containing cotton. Science, 2008, 321(5896): 1676-1678.
[3] Ma J, Lü Z, Gao G. Population patterns ofHelicoverpaarmigera(Hb.) onBacillusthuringiensistransgenic cotton in Xinjiang, China. Egyptian Journal of Biological Pest Control, 2012, 22(2): 131-139.
[4] Gassmann A J, Carrière Y, Tabashnik B E. Fitness costs of insect resistance toBacillusthuringiensis. Annual Review of Entomology, 2009, 54(1): 147-163.
[5] Bates S L, Zhao J Z, Roush R T, Shelton A M. Insect resistance management in GM crops: past, present and future. Nature Biotechnology, 2005, 23(1): 57-62.
[6] Wu K M, Mu W, Liang G M, Guo Y Y. Regional reversion of insecticide resistance inHelicoverpaarmigera(Lepidoptera: Noctuidae) is associated with the use of Bt cotton in northern China. Pest Management Science, 2005, 61(5): 491-498.
[7] 吕昭智, 潘卫林, 张鑫, 李贤超, 张娟. 新疆北部棉区作物景观多样性对棉铃虫种群的影响. 生态学报, 2012, 32(24): 7925-7931.
[8] Shelton A M, Roush R T, Wang P, Zhao J Z. Resistance to insect pathogens and strategies to manage resistance: an update // Field Manual of Techniques in Invertebrate Pathology. Netherlands: Springer, 2007: 793-811.
[9] Gould F. Sustainability of transgenic insecticidal cultivars: integrating pest genetics and ecology. Annual Review of Entomology, 1998, 43(1): 701-726.
[10] Tabashnik B E, Dennehy T J, Carriere Y. Delayed resistance to transgenic cotton in pink bollworm. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(43): 15389-15393.
[11] Shelton A M, Zhao J Z, Roush R T. Economic, ecological, food safety, and social consequences of the deployment of Bt transgenic plants. Annual Review of Entomology, 2002, 47(1): 845-881.
[12] Williams S, Friedrich L, Dincher S, Carozzi N, Kessmann H, Ward E, Rylas J. Chemical regulation ofBacillusthuringiensis-Endotoxin expression in transgenic plants. Nature Biotechnology, 1992, 10(5): 540-543.
[13] Gujar G T, Kalia V, Kumari A, Singh B P, Mittal A, Nair R, Mohan M.Helicoverpaarmigerabaseline susceptibility toBacillusthuringiensiscry toxins and resistance management for Bt cotton in India. Journal of Invertebrate Pathology, 2007, 95(3): 214-219.
[14] McGaughey W H, Gould F, Gelernter W. Bt resistance management: a plan for reconciling the needs of the many stakeholders in Bt-based Products. Nature Biotechnology, 1998, 16(2): 144-146.
[15] 乔方彬, 黄季焜, Rozelle S, Wilen J. 棉铃虫的自然庇护所、抗性发展以及中国的零庇护所政策. 中国科学: 生命科学, 2010, 40(11): 1074-1086.
[16] Wu K M, Feng H Q, Guo Y Y. Evaluation of maize as a refuge for management of resistance to Bt cotton byHelicoverpaarmigera(Hübner) in the Yellow River cotton-farming region of China. Crop Protection, 2004, 23(6): 523-530.
[17] Wu K M. Monitoring and management strategy forHelicoverpaarmigeraresistance to Bt cotton in China. Journal of Invertebrate Pathology, 2007, 95(3): 220-223.
[18] Wu K M, Guo Y Y. The evolution of cotton pest management practices in China. Annual Review of Entomology, 2005, 50(1): 31-52.
[19] Gould F, Blair N, Reid M, Rennie T L, Lopez J, Micinski S.Bacillusthuringiensis-toxin resistance management: stable isotope assessment of alternate host use byHelicoverpazea. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(26): 16581-16586.
[20] Baker G H, Tann C R. Mating ofHelicoverpaarmigera(Lepidoptera: Noctuidae) moths and their host plant origins as larvae within Australian cotton farming systems. Bulletin of Entomological Research, 2013, 103(2): 171-181.
[21] 叶乐夫, 付雪, 谢宝瑜, 戈峰. 应用稳定同位素技术分析华北部分地区第三代棉铃虫虫源性质. 生态学报, 2011, 31(6): 1714-1719.
[22] 叶乐夫, 付雪, 戈峰. C3和C4植物寄主对华北地区棉铃虫越冬代和第一代的影响. 生态学报, 2011, 31(2): 449-454.
[23] Li G P, Feng H Q, Gao Y L, Wyckhuys K A C, Wu K M. Frequency of Bt resistance alleles inHelicoverpaarmigerain the Xinjiang cotton-planting region of China. Environmental Entomology, 2010, 39(5): 1698-1704.
[24] 李号宾, 吴孔明, 杨秀荣, 徐遥, 姚举, 汪飞, 马祁. 新疆南部棉区棉铃虫发生趋势及Bt棉花的控制效率. 中国农业科学, 2006, 39(1): 199-205.
[25] 孟凤霞, 沈晋良, 褚姝频. Bt棉叶对棉铃虫抗虫性的时空变化及气象因素的影响. 昆虫学报, 2003, 46(3): 299-304.
[26] 徐遥, 吴孔明, 李号宾, 汪飞, 孙世龙, 李祥烨. 转基因抗虫棉对新疆棉田主要害虫及天敌群落的影响. 新疆农业科学, 2004, 41(5): 345-347.
[27] Lü Z Z, Zalucki M P, Perkins L E, Wang D Y, Wu L L. Towards a resistance management strategy forHelicoverpaarmigerain Bt-cotton in northwestern China: an assessment of potential refuge crops. Journal of Pest Science, 2013, 86(4): 695-703.
[28] Khalifa A. The mechanism of insemination and the mode of action of the spermatophore inGryllusdomesticus. Quarterly Journal of Microscopical Science, 1949, 90(S3): 281-292.
[29] Head G, Jackson R E, Adamczyk J, Bradley J R, Van Duyn J, Gore J. Spatial and temporal variability in host use byHelicoverpazeaas measured by analyses of stable carbon isotope ratios and gossypol residues. Journal of Applied Ecology, 2010, 47(3): 583-592.
[30] Lü Z Z, Baker G. Spatial and temporal dynamics ofHelicoverpaarmigera(Lepidoptera, Noctuidae) in contrasting agricultural landscapes in northwestern China. International Journal of Pest Management, 2013, 59(1): 25-34.
[31] 张娟, 马吉宏, 徐养诚, 王鑫, 王佩玲, 古孜力努尔﹒乌麦尔, 吕昭智. 从卵巢发育特点揭示新疆地区棉铃虫迁飞习性. 生态学杂志, 2013, 32(6): 1428-1432.
[32] 褚茗莉, 许国庆, 田本志, 赵琦, 张一兵, 顾兰君, 赵季秋, 安国香. 不同寄主对棉铃虫发育的影响. 辽宁农业科学, 1997, (3): 35-38.
Analysis of Larval host types of Cotton Bollworm (Helicoverpaarmigera) Populations for Evaluation of Bt Refuges in Northern Xinjiang
LI Na1, ZHANG Juan4, LIU Yongjian2, ZHANG Bao3, XIONG Jianxi3, WANG Peiling1,*, LÜ Zhaozhi4
1DepartmentofPlantProtection,CollegeofAgriculture,ShiheziUniversity,Shihezi832003,China2The147thplantprotectionstationofAgricultrationDepartment,Shihezi832045,China3The121thProductionandConstructionCropsAgriculturalTechnologyExtensionStation,Shihezi832066,China4XinjiangInstituteofEcologyandGeography,ChineseAcademyofSciences,KeyLaboratoryofBiogeographyandBioresourceinAridLand,ChineseAcademyofSciences,Urumqi830011,China
Transgenic cotton, expressing an insecticidal toxin fromBacillusthuringiensis(Bt cotton), has been widely cultivated for a long period in some areas of China. Therefore, there is the potential for the cotton bollworm,Helicoverpaarmigera, to develop resistance to Bt cotton toxins. The United States Environmental Protection Agency (US EPA) is rethinking the requirement for some regions to delay developing natural refuge crops where Bt cotton growth has been highly successful. The policy of establishing refuges was intended to delay pest population development of Bt-toxin resistance. Bt cotton is widely grown in Xinjiang Province, which is the largest cotton-producing area in China, but no studies have been conducted on potential refuges in this region of China. In recent years, stable carbon isotope techniques (δ13C) have been used to identify the larval host-types (i.e., whether the hosts are C3or C4plants) of cotton bollworm. These methods have been used to evaluate the Bt refuge function of non-cotton crops.In this study, intelligent forecast light traps were established to collect adult cotton bollworms from May to September 2013, from the 147thand 121stregiments of the Shihezi reclamation area located in northern Xinjiang. The captured moths were placed into bottles and preserved in 95% alcohol until analysis. At each of the sites, 50 males and 30 females moths were selected on the day of capture, their wings combined into two bulked samples respectively to analyze their host type (C3or C4) using δ13C analysis. At the same time, 30 female′s wings and corresponding spermatophore were separated to one single sample to analyze the mating type and percentage of mating frequency between C3and C4host. A total of 23 bulked samples from the 147thregiment and 25 bulked samples from the 121stregiment were tested. The proportions of C3and C4hosts were calculated according to a standard curve constructed in 2012. Approximately 50% of cotton bollworms were derived from C4hosts, and approximately 50% from C3hosts in late May and from early August to September. From June to July, 100% of cotton bollworms were derived from C4hosts. To evaluate the mating frequency of cotton bollworms at the two sites, we selected 210 anatomically adult females in the 1stand 2ndgenerations from the 147thand 121stregiments. The percentage of effective mating between the two larval host-types (C3and C4) was approximately 10%. Mating frequency ranged from 0.9 to 2.1 per adult female at the two sites, and was higher at the 121stregiment site than at the 147thregiment site. Maize is considered to be the most important natural refuge for Bt-susceptible cotton bollworms in northern Xinjiang, since maize is the main C4host plant in this area. Thus, maize may provide refuges for susceptible cotton bollworms in the autumn of one year and the spring of the following year. There is a short period in which cotton bollworms derived from C3and C4hosts simultaneously co-exist, and there is a very small percentage of effective mating between cotton bollworms derived from C3and C4hosts. This will affect the capacity to dilute the Bt-resistance in cotton bollworms, and may be related to the non-synchronization of C3and C4crops and male and female cotton bollworms.
carbon stable isotope;Helicoverpaarmigera; insect resistance management; refuge
国家国际科技合作专项(2011DFA33170); 中国科学院院地合作专项(XBXJ-2011-029)
2014-02-16; < class="emphasis_bold">网络出版日期:
日期:2014-12-04
10.5846/stxb201402160266
*通讯作者Corresponding author.E-mail: wangpl69@126.com
李娜, 张娟, 刘永健, 张豹, 熊建喜, 王佩玲, 吕昭智.新疆北部棉铃虫寄主来源与转基因棉区庇护所评估.生态学报,2015,35(19):6280-6287.
Li N, Zhang J, Liu Y J, Zhang B, Xiong J X, Wang P L, Lü Z Z.Analysis of Larval host types of Cotton Bollworm (Helicoverpaarmigera) Populations for Evaluation of Bt Refuges in Northern Xinjiang.Acta Ecologica Sinica,2015,35(19):6280-6287.

