蕾期土壤盐度降低后棉花叶片的生理功能恢复
郭文琦, 张培通, 李春宏, 殷剑美, 韩晓勇
江苏省农业科学院经济作物研究所/农业部长江下游棉花和油菜重点实验室, 南京 210014
蕾期土壤盐度降低后棉花叶片的生理功能恢复
郭文琦, 张培通*, 李春宏, 殷剑美, 韩晓勇
江苏省农业科学院经济作物研究所/农业部长江下游棉花和油菜重点实验室, 南京 210014
试验于2011—2012年在江苏南京江苏省农业科学院经济作物研究所试验田进行,采用盆栽方法,以鲁棉研37号和苏棉22号为供试材料,设置土壤盐度降低试验(初始土壤含盐量为0.2%,棉花进入二叶期后每7d加入混合盐1次,每次增加0.1%,使土壤含盐量逐渐达到0.5%,蕾期进行盐度降低处理,使土壤含盐量降低到0.2%左右),研究蕾期土壤盐度降低后棉花叶片的生理代谢动态特征。结果表明:土壤盐度降低后,棉花叶片叶绿素(Chl)、类胡萝卜素(Car)含量和Chl/ Car升高;净光合速率和气孔导度升高,且分别在土壤盐度降低后第14天和7天接近于低盐对照;土壤盐度降低后棉花叶片超氧化物歧化酶(SOD)和过氧化物酶(POD)活性升高,过氧化氢酶(CAT)活性和丙二醛(MDA)含量降低,MDA含量在土壤盐度降低后第14天接近于低盐对照;土壤盐度降低后棉花叶片中可溶性糖、游离氨基酸和脯氨酸含量降低,且接近于低盐对照。上述结果表明土壤盐度降低后,棉花叶片生理功能逐渐恢复,进而实现棉花生长发育的恢复补偿。棉花叶片生理功能在土壤盐度降低后的恢复能力存在品种间差异,鲁棉研37号较苏棉22号叶片生理功能表现出更强的恢复能力。
土壤盐度降低; 棉花; 叶片; 生理功能恢复
中国有盐渍土面积约3700万hm2,随着耕地资源的愈趋缺乏,盐渍土的改良利用成为农业生产发展的重要任务[1]。受季风气候影响我国盐渍土盐分具有季节性变化特点,夏季降雨集中,土壤季节性脱盐,春秋季降水量减少引起土壤积盐,土壤脱盐和积盐的程度也因气候不同存在较大的地区间差异,对于降雨充足地区,尤其东部滨海盐土和滩涂地区进入雨季后土壤盐分降低明显,为作物的高产高效提供了重要空间。
棉花耐盐能力较强,是盐渍土种植改良过程中的先锋作物[2],同时为缓减粮棉争地矛盾,棉花种植面积也逐渐向生产能力低下的盐渍土地区集中[3]。盐胁迫下,由于离子毒害和渗透胁迫等的影响,叶片光合性能下降,棉花生长发育受阻[4-8]。研究表明,盐胁迫促使植物体内活性氧自由基大量形成,活性氧代谢失衡,膜脂过氧化程度加重,膜结构和功能破坏,蛋白质和叶绿素降解,从而导致植物光合性能下降[9-11];而植物体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等能有效地清除活性氧自由基[12-13]。此外,盐胁迫下,植物体内合成累积一些小分子有机物质如氨基酸、可溶性糖和脯氨酸等以减轻盐胁迫对植物的伤害[14-15]。综观前人研究,主要集中在盐胁迫影响棉花生长发育的生理机理方面[3-8],缺乏针对土壤盐分降低对棉花生长发育影响的生理机理研究。
研究表明,逆境条件下,植物光合性能受到抑制,但胁迫减轻后植物叶片光合性能和生理代谢活性可以逐渐恢复,以补偿逆境所带来的不利影响[16-19]。叶片作为植物光合生产的源器官,其光合性能及相关生理代谢过程对土壤盐度降低的响应机制是阐明土壤盐度降低后棉花补偿生长生理机理的关键。本研究基于盐碱地土壤盐分不断变化的客观实际,研究土壤盐度降低后棉花叶片光合作用、抗氧化代谢等动态变化特征及其对生长发育的影响,以丰富棉花抗盐栽培理论,并为探索提高盐碱棉田棉花产量的合理调控途径提供理论依据。
1 材料与方法
1.1 试验设计
试验于2011年和2012年在江苏省农业科学院经济作物研究所防雨棚中进行,采用盆栽方法。供试土壤为黄棕壤土,2011、2012供试土壤有机质含量为15.65、14.71g/kg,全氮含量为0.98、0.84g/kg,速效磷为34.53、32.14mg/kg,速效钾为196.11、178.56mg/kg。试验所用盆为直径40cm,高40cm,盆底有洞,并且在盆底配有托盘防止盐分流失。土壤经风干过筛去杂后装盆,每盆装土20kg,然后每盆土壤在初始盐分基础上,按盐土比将混合盐(NaCl 77.7%、MgCl27.3%、MgSO49.6%、CaCl23.3%、KCl 2.1%)混入土壤中至0.2%左右。供试材料为耐盐性存在差异的两个棉花品种(苏棉22号和鲁棉研37号),2011和2012年分别于5月8日和5月6日播种,采用直播方式,三叶期时每盆选择保留生长一致的壮苗1株。
试验设置3个处理:低盐对照CK,土壤含盐量一直维持在0.2%左右;土壤盐度降低处理SD,土壤含盐量为0.2%,进入二叶期后每隔7d加入混合盐1次,使土壤含盐量每次增加0.1%,通过3次加混合盐使土壤含盐量达到0.5%左右,然后维持30d,在蕾期(2011年在播种后65d、2012年在播种后57d)进行土壤盐度降低处理,用灌水冲盐的方式,降低土壤含盐量到0.2%左右;高盐处理S,土壤初始含盐量为0.2%,进入二叶期后每隔7d加入混合盐使土壤含盐量增加0.1%,通过3次加混合盐后最终土壤含盐量达到0.5%,之后一直维持土壤含盐量在0.5%左右,每处理种植60盆,共计360盆。试验前以及试验处理后定期用取土器在盆中从上到下取土壤混合样品测定土壤含盐量(图1)。全生育期用称重法调节土壤含水量,低盐对照和高盐处理土壤相对含水量始终维持在70%—80%,土壤盐度降低处理仅在灌水冲盐时土壤含水量增加,其它时期土壤相对含水量均维持在70%—80%。全生育期每盆施尿素4 g,播种前施1.5 g,灌水冲盐后施2.5 g。
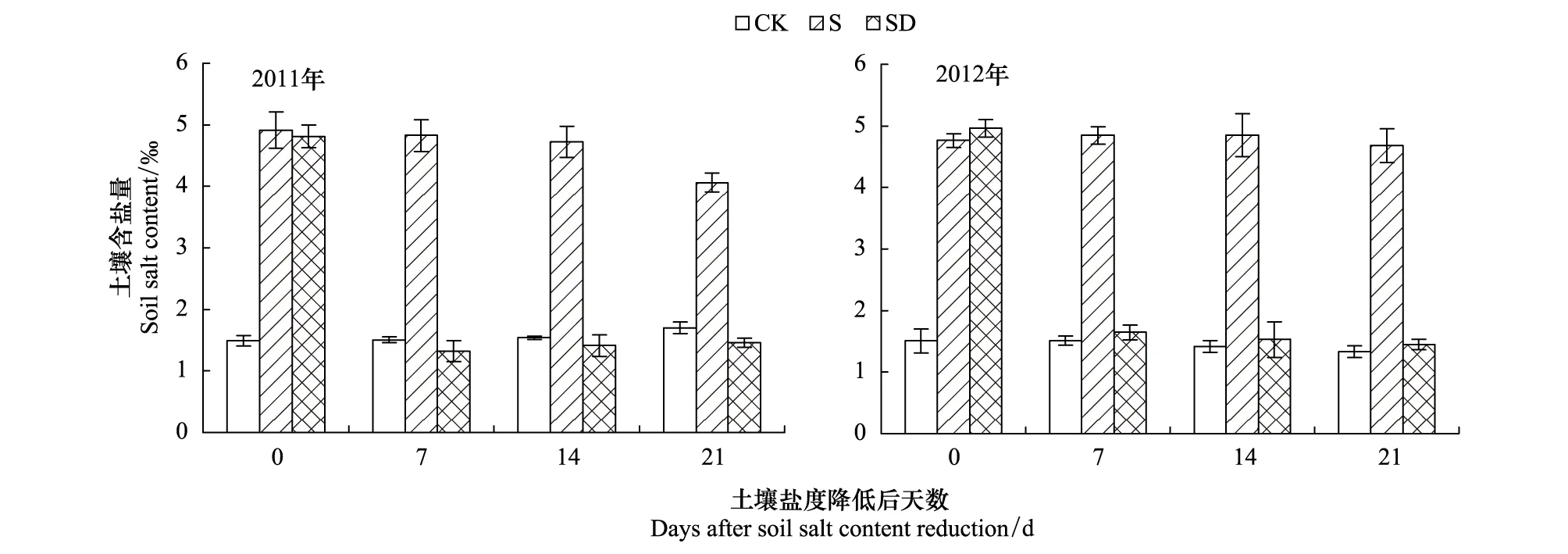
图1 土壤含盐量动态变化Fig.1 Dynamic changes of soil salt contentCK: 低盐对照Control, S: 高盐处理Salt-stress treatment, SD: 土壤盐度降低处理Salt-recovered treatment
1.2 测定项目与方法
1.2.1 光合作用
于土壤盐度降低后的第0、7、14、21天,每处理选择生长均匀一致的棉株在9:00—11:00用美国产LI-6400型光合仪测定棉株功能叶(倒四主茎叶)的净光合速率(Pn)和气孔导度(Gs),每处理重复5株。测定时仪器使用开放式气路,CO2浓度为380 μmol/L左右;选择红蓝光源叶室,设定光量子密度(PAR)为1500 μmol s-1m-2。
1.2.2 丙二醛(MDA)含量与抗氧化酶活性
在1.2.1中的Pn测定后,立即将叶片取回,液氮速冻后存于-40℃冰箱中用于抗氧化酶活性和MDA含量的分析。用考马斯亮蓝法测定可溶性蛋白含量,氮蓝四唑(NBT)法测定SOD活性、高锰酸钾滴定法测定CAT活性、愈创木酚法测定POD活性、硫代巴比妥酸比色法测定MDA含量[20]。
1.2.3 可溶性糖、游离氨基酸和脯氨酸含量
用蒽酮比色法测定叶片可溶性糖含量,用茚三酮溶液显色法测定游离氨基酸含量,用酸性茚三酮法测定脯氨酸含量[20]。
1.2.4 光合色素含量
参照李合生的方法测定叶片叶绿素和类胡萝卜素含量[20]。
1.3 统计分析方法
采用Excel软件进行数据处理和作图,用SPSS11.0软件进行数据统计分析,采用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同处理间的差异。
2 结果与分析
2.1 土壤盐度降低后棉花叶片光合色素含量的变化特征
由表1 可见,与低盐对照相比,高盐处理棉花叶片叶绿素(Chl)含量、类胡萝卜素(Car)含量及叶绿素与类胡萝卜素之比(Chl/Car)均显著降低。土壤盐度降低后,棉花叶片Chl和Car含量及Chl/Car升高。土壤盐度降低后第21天,与高盐处理相比,鲁棉研37号叶片Chl含量增加20.0%(2011)和22.8%(2012),苏棉22号增加18.6%(2011)和15.0%(2012),鲁棉研37号叶片Car含量增加13.6%(2011)和18.0%(2012),苏棉22号增加8.4%(2011)和7.1%(2012),且叶片中Chl和Car含量与低盐对照相比已无显著差异。
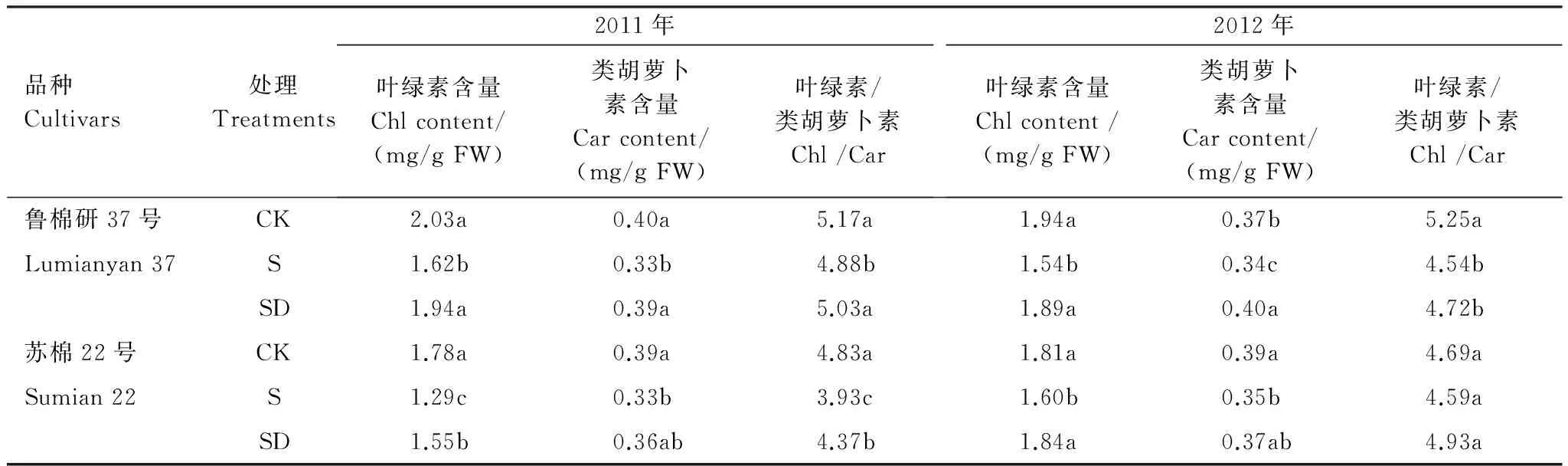
表1 土壤盐度降低后棉花叶片光合色素含量变化特征
2.2 土壤盐度降低后棉花叶片净光合速率和气孔导度的变化特征
由图2可见,与低盐对照相比,高盐处理显著降低了棉花叶片净光合速率和气孔导度。土壤盐度降低后,净光合速率和气孔导度快速升高,净光合速率在土壤盐度降低后的第14天(鲁棉研37号)和21天(苏棉22号)接近于低盐对照,表明叶片光合性能恢复到低盐对照水平,气孔导度则在土壤盐度降低后的第7天接近于低盐对照。土壤盐度降低后第21天,与高盐处理相比,鲁棉研37号叶片净光合速率增加65.8%(2011)和35.6%(2012),苏棉22号增加40.9%(2011)和28.2%(2012)。
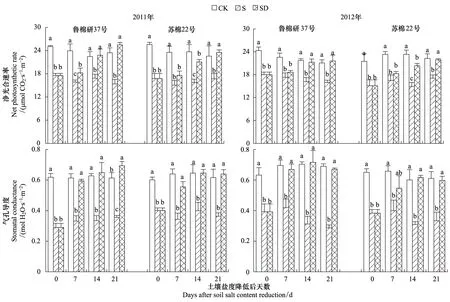
图2 土壤盐度降低后棉花叶片净光合速率和气孔导度的动态变化Fig.2 Dynamic changes of net photosynthetic rate and stomatal conductance of cotton leaves after relief from salt stressCK: 低盐对照Control, S: 高盐处理Salt-stress treatment, SD: 土壤盐度降低处理Salt-recovered treatment
2.3 土壤盐度降低后棉花叶片MDA含量的变化特征
由图3可见,与低盐对照相比,高盐处理棉花叶片中MDA含量升高。土壤盐度降低后,叶片中MDA含量降低,并于土壤盐度降低后的第14天接近于低盐对照。土壤盐度降低后第21天,与高盐处理相比,鲁棉研37号叶片中MDA含量降低31.9%(2011)和32.6%(2012),苏棉22号降低21.4%(2011)和29.5%(2012)。
2.4 土壤盐度降低后棉花叶片抗氧化酶活性的变化特征
由图4可见,与低盐对照相比,高盐处理棉花叶片中SOD和POD活性降低,CAT活性升高。土壤盐度降低后,叶片中SOD和POD活性升高,CAT活性降低,SOD活性于土壤盐度降低后的第7天(鲁棉研37号)和14天(苏棉22号)接近于低盐对照,POD活性于土壤盐度降低后的第14天(鲁棉研37号)和21天(苏棉22号)接近于低盐对照,CAT活性于土壤盐度降低后的第21天天接近于低盐对照。对于土壤盐度降低处理和高盐处理,鲁棉研37号叶片中SOD、POD和CAT活性均高于苏棉22号。
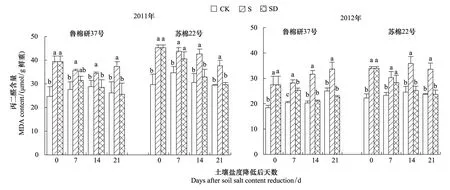
图3 土壤盐度降低后棉花叶片MDA含量动态变化Fig.3 Dynamic changes of MDA content of cotton leaves after relief from salt stressCK: 低盐对照Control, S: 高盐处理Salt-stress treatment, SD: 土壤盐度降低处理Salt-recovered treatment
2.5 土壤盐度降低后棉花叶片游离氨基酸、可溶性糖和脯氨酸含量的变化特征
由表2可见,与低盐对照相比,高盐处理棉花叶片中可溶性糖、游离氨基酸和脯氨酸含量均显著升高。土壤盐度降低后,叶片中可溶性糖、游离氨基酸和脯氨酸含量降低。土壤盐度降低后第21天,与高盐处理相比,叶片中可溶性糖含量鲁棉研37号降低35.1%(2011)和30.7%(2012),苏棉22号降低27.8%(2011)和22.4%(2012);游离氨基酸含量鲁棉研37号降低18.7%(2011)和17.2%(2012),苏棉22号降低13.3%(2011)和11.6%(2012)。
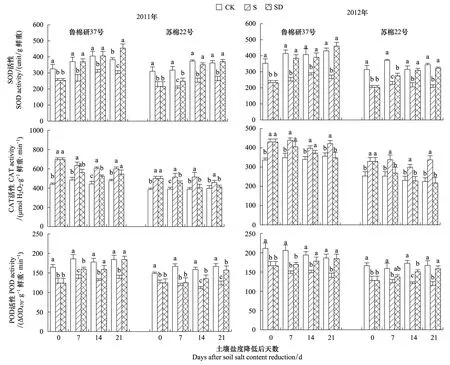
图4 土壤盐度降低后棉花叶片抗氧化酶活性动态变化Fig.4 Dynamic changes of antioxidant enzyme activities of cotton leaves after relief from salt stressCK: 低盐对照Control, S: 高盐处理Salt-stress treatment, SD: 土壤盐度降低处理Salt-recovered treatment
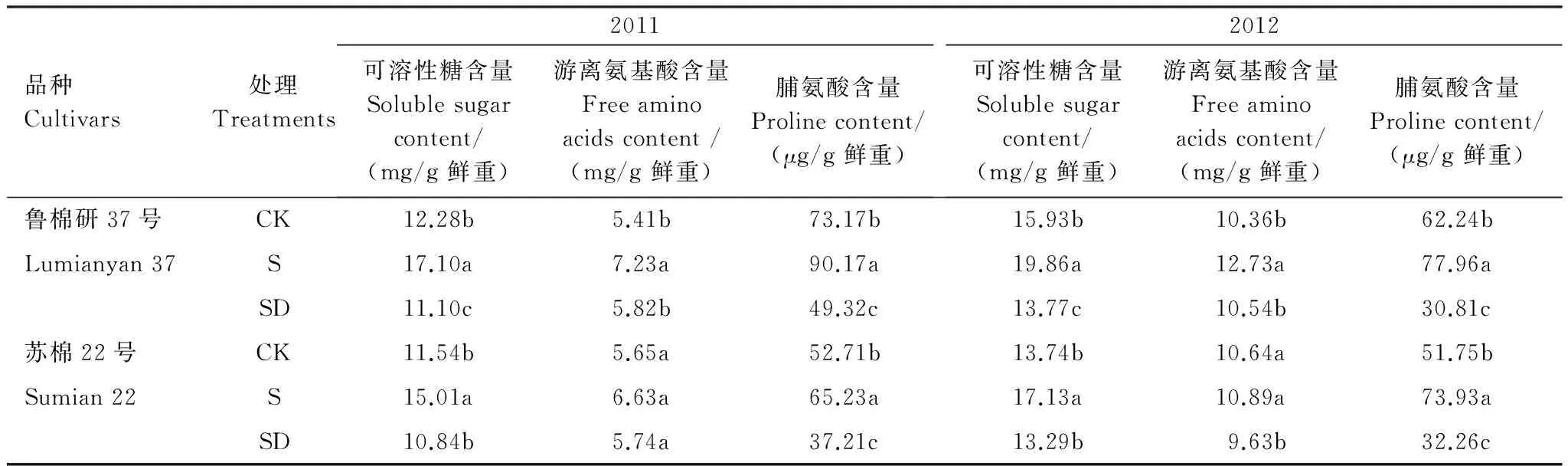
表2 土壤盐度降低后棉花叶片中游离氨基酸、可溶性糖和脯氨酸含量变化特征
3 讨论与结论
盐碱地土壤盐分受气候的影响在种植季节内不断变化,因此盐碱地作物生长发育和产量形成不仅取决于作物的耐盐能力,而且取决于土壤盐分降低后的恢复能力。前期研究结果表明[21],土壤盐分维持在0.5%盐分水平时,棉花生长发育受到较大抑制,而土壤盐度降低到0.2%后,棉花生长快速恢复,在土壤盐度降低后21d左右,棉株干物质累积速率就接近于对照棉花(土壤盐分始终维持在0.2%左右),说明尽管前期受较重的盐分胁迫棉花生长发育受到严重抑制,但土壤盐度降低后棉花生长发育逐渐恢复,以补偿盐胁迫对其的不利影响。
光合性能下降是盐胁迫导致作物生长发育受到抑制的主要生理过程[6-8]。盐胁迫下,受离子毒害和渗透胁迫的影响,棉花叶片净光合速率下降,气孔导度降低,作物光合机构受损,光合色素降解;土壤盐度降低后,叶片光合性能逐渐恢复,进而促进棉花生长发育的恢复。本试验结果表明,土壤盐度降低后初期叶片气孔导度快速恢复促进了叶片光合速率的提高,但由于光合机构以及光合代谢相关酶活性等非气孔因素的恢复较慢,导致叶片净光合速率的恢复明显晚于气孔导度;而随着恢复时间的延长,非气孔因素逐步恢复进而促进了叶片光合性能的全面恢复。土壤盐度降低后初期叶片气孔导度的快速恢复可能是由于土壤盐度降低后,根系渗透胁迫减轻,增强了根系水分的供应能力;同时内源激素的变化也可能是促使叶片气孔导度快速恢复的重要原因。土壤盐度降低后棉花叶片光合性能的恢复能力存在品种间差异,本试验中鲁棉研37号较苏棉22号叶片光合性能表现出更强的恢复能力。
盐胁迫引起植物体内活性氧自由基累积,细胞膜受到伤害,植物生理代谢过程受到抑制[8]。本试验中,盐胁迫下棉花叶片中MDA含量升高,细胞膜脂过氧化程度加重;土壤盐度降低后,叶片受伤害程度减轻,MDA含量显著降低。抗氧化酶SOD、CAT、POD等的协调作用可有效清除活性氧自由基[8-10],关于盐胁迫对棉花体内抗氧化酶活性的影响,因品种、盐胁迫程度和盐胁迫时间的不同研究结果存在差异[7-8]。本试验中,盐胁迫使棉花叶片中SOD和POD活性降低,CAT活性升高;土壤盐度降低后,棉花叶片中SOD和POD活性升高,CAT活性降低,说明土壤盐度降低后棉花叶片主要依靠提高SOD和POD活性减轻细胞膜伤害,进而促进棉花叶片生理功能的恢复。鲁棉研37号叶片中SOD、CAT和POD活性高于苏棉22号,这也可能是鲁棉研37号叶片光合性能恢复能力较强的重要原因。
盐胁迫下,植物为减轻渗透胁迫,细胞内合成和积累一些小分子有机物质,以降低细胞内渗透势,维持细胞膜稳定性。本试验中,盐胁迫使棉花叶片中游离氨基酸、可溶性糖和脯氨酸含量均升高,这与前人研究结果一致[14-15]。土壤盐度降低后,叶片中游离氨基酸、可溶性糖和脯氨酸含量显著降低,可能是土壤盐度降低后,作为合成其它物质的重要组分和能量供应者,氨基酸和糖类等有机物质的利用被增加,进而促进叶片生理代谢的恢复[22-23]。此外,土壤盐度降低后,鲁棉研37号叶片中游离氨基酸和可溶性糖含量较大的降低幅度可能更利于叶片生理功能的恢复。
综上所述,土壤盐度降低后,棉花叶片光合性能逐渐恢复,促进棉花生长,补偿前期盐胁迫对棉花生长发育的不利影响。土壤盐度降低后,棉花叶片抗氧化酶SOD和POD活性增加,减轻了细胞膜脂过氧化程度,从而有利于叶片光合性能的恢复;可溶性糖和游离氨基酸等有机渗透调节物质作为合成其它物质的重要组分和能量供应者,在土壤盐度降低后其利用的增加,将促进叶片生理功能的恢复。
[1] 杨劲松. 中国盐渍土研究的发展历程与展望. 土壤学报, 2008, 45(5): 837-845.
[2] 蒋玉蓉, 吕有军, 祝水金. 棉花耐盐机理与盐害控制研究进展. 棉花学报, 2006, 18(4): 248-254.
[3] 张国伟, 路海玲, 张雷, 陈兵林, 周治国. 棉花萌发期和苗期耐盐性评价及耐盐指标筛选. 应用生态学报, 2011, 22(8): 2045-2053.
[4] 辛承松, 董合忠, 唐薇, 温四民. 棉花盐害与耐盐性的生理和分子机理研究进展. 棉花学报, 2005, 17(5): 309-313.
[5] Ashraf M, Ahmad S. Influence of sodium chloride on ion accumulation, yield components and fibre characteristics in salt-tolerant and salt-sensitive lines of cotton (GossypiumhirsutumL.). Field Crops Research, 2000, 66(2): 115-127.
[6] 张国伟, 张雷, 唐明星, 周玲玲, 陈兵林, 周治国. 土壤盐分对棉花功能叶气体交换参数和叶绿素荧光参数日变化的影响. 应用生态学报, 2011, 22(7): 1771-1781.
[7] Meloni D A, Oliva M A, Martinez C A, Cambraia J. Photosynthesis and activity of superoxide dismutase, peroxidase and glutathione reductase in cotton under salt stress. Environmental and Experimental Botany, 2003, 49(1): 69-76.
[8] Gossett D R, Millhollon E P, Lucas M C. Antioxidant response to NaCl stress in salt-tolerant and salt-sensitive cultivars of cotton. Crop Science, 1994, 34(3): 706-714.
[9] 孙璐, 周宇飞, 李丰先, 肖木辑, 陶冶, 许文娟, 黄瑞冬. 盐胁迫对高梁幼苗光合作用和荧光特性的影响. 中国农业科学, 2012, 45(16): 3265-3272.
[10] Parida A K, Das A B, Mohanty P. Defense potentials to NaCl in a mangrove,Bruguieraparviflora: differential changes of isoforms of some antioxidative enzymes. Journal of Plant Physiology, 2004, 161(5): 531-542.
[11] 武玉妹, 周强, 於丙军. 大豆异黄酮浸种对盐胁迫大豆幼苗的生理效应. 生态学报, 2011, 31(22): 6669-6676.
[12] 尤佳, 王文瑞, 卢金, 贾鹏翔, 缪建顺, 杨颖丽. 盐胁迫对盐生植物黄花补血草种子萌发和幼苗生长的影响. 生态学报, 2012, 32(12): 3825-3833.
[13] Ahmed S, Nawata E, Hosokawa M, Domae Y, Sakuratani T. Alterations in photosynthesis and some antioxidant enzymatic activities of mungbean subjected to waterlogging. Plant Science, 2002, 163(1): 117-123.
[14] Feng G, Zhang F S, Li X L, Tian C Y, Tang C, Rengel Z. Improved tolerance of maize plants to salt stress by arbuscular mycorrhiza is related to higher accumulation of soluble sugars in roots. Mycorrhiza, 2002, 12(4): 185-190.
[15] Hu Y C, Schmidhalter U. Spatial distributions of inorganic ions and sugars contributing to osmotic adjustment in the elongating wheat leaf under saline soil conditions. Australian Journal of Plant Physiology, 1998, 25(5): 591-597.
[16] 赵明, 李建国, 张宾, 董志强, 王美云. 论作物高产挖潜的补偿机制. 作物学报, 2006, 32(10): 1566-1573.
[17] 施积炎, 袁小凤, 丁贵杰. 作物水分亏缺补偿与超补偿效应的研究现状. 山地农业生物学报, 2000, 19(3): 226-233.
[18] 郭贤仕. 谷子旱后的补偿效应研究. 应用生态学报, 1999, 10(5): 563-566.
[19] 卜令铎, 张仁和, 韩苗苗, 薛吉全, 常宇. 干旱复水激发玉米叶片补偿效应的生理机制. 西北农业学报, 2009, 18(2): 88-92.
[20] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 134-260.
[21] 郭文琦, 张培通, 李春宏, 殷剑美, 韩晓勇. 蕾期土壤盐度降低后棉花生长发育的补偿效应. 应用生态学报, 2014, 25(1): 162-168.
[22] Pardossi A, Malorgio F, Oriolo D, Gucci R, Serra G, Tognoni F. Water relations and osmotic adjustment inApiumgraveolensduring long-term NaCl stress and subsequent relief. Physiologia Plantarum, 1998, 102(3): 369-376.
[23] de Lacerda C F, Cambraia J, Oliva M A, Ruiz H A. Changes in growth and in solute concentrations in sorghum leaves and roots during salt stress recovery. Environmental and Experimental Botany, 2005, 54(1): 69-76.
Recovery of physiological functions of cotton leaves after relief from salt stress at the bud stage
GUO Wenqi, ZHANG Peitong*, LI Chunhong, YIN Jianmei, HAN Xiaoyong
InstituteofIndustrialCrops,JiangsuAcademyofAgriculturalSciences,KeyLaboratoryofCottonandRapeseedintheLowerReachesoftheYangtzeRiver,MinistryofAgriculture,Nanjing210014,China
Soil salinity is considered a major limiting factor on crop productivity worldwide. Soil salt accumulation is affected throughout the year by weather conditions, which can enhance or reduce the effects of on the physiological functions of plants, in turn affecting plant growth and development. Thus, crop productivity in saline environments depends on not only on tolerance to salt stress but also on capacity to recover from salt stress. The objective of this study was to elucidate the physiological mechanisms of recovery in cotton leaves after salt stress. Changes in photosynthetic pigments, photosynthesis, lipid peroxidation, antioxidant enzyme activity, and soluble sugar, free amino acid and proline content in leaves after relief from salt stress were studied in two cotton cultivars (Lumianyan 37 and Sumian 22) grown under control (soil salt concentration 0.2%), salt-stressed (soil salt concentration 0.5%) and salt-recovered (soil salt content decreased from 0.5% to 0.2%) conditions. After soil salt content was reduced, chlorophyll and carotenoid content, and chlorophyll/carotenoid ratio, increased compared to those in salt-stressed cotton plants, and the increases were more pronounced in Lumianyan 37 than Sumian 22. Net photosynthetic rate (Pn) and stomatal conductance (Gs) values increased in salt-relieved plants compared with those in the salt-stressed cotton plants and exceeded those in control (CK) cotton plants at 7 d and 14 d after reducing soil salt concentration. The increase inPnfor Lumianyan 37 was higher than that of Sumian 22. The malondialdehyde (MDA) content of salt-relieved cotton leaves decreased compared with those of salt-stressed cotton plants and approximated that of the CKs at 14 d after reducing soil salt concentration. Additionally, superoxide dismutase (SOD) and peroxidase (POD) activity in salt-relieved cotton leaves increased, but catalase (CAT) activity decreased after reducing soil salt concentration. The reduction of MDA content in leaves of Lumianyan 37 was greater than that in Sumian 22, as were SOD, CAT, and POD activity. After reducing soil salt concentration, cotton leaves showed decreases in soluble sugar, free amino acid, and proline content, especially Lumianyan 37. In summation, the metabolic activity of cotton leaves gradually recovered after reducing soil salt concentration, resulting in gradual compensation in growth. The two cotton cultivars differed in the ability of their leaves to recover from salt stress. Lumianyan 37 was better able to recover than Sumian 22. Cotton has indeterminate growth characteristics. Although salt stress restricts the growth of cotton plants, after relief from salt stress fruit branches and fruit nodes, as well as buds and bolls, can grow and develop again, partly compensating for the potential yield losses caused by the salt stress. Understanding the physiological mechanisms of cotton recovery from salt stress will aid in breeding new cotton cultivars and in developing new agronomic solutions to enhance recovery after relief from salt stress.
salt stress relief; cotton; leaf; recovery of physiological function
国家自然科学基金(31201139); 江苏省自然科学基金(BK2011669); 江苏省农业自主创新资金项目(CX(11)4010)
2014-02-16; < class="emphasis_bold">网络出版日期:
日期:2014-12-04
10.5846/stxb201402160267
*通讯作者Corresponding author.E-mail: ptzhang1965@163.com
郭文琦, 张培通, 李春宏, 殷剑美, 韩晓勇.蕾期土壤盐度降低后棉花叶片的生理功能恢复.生态学报,2015,35(19):6298-6305.
Guo W Q, Zhang P T, Li C H, Yin J M, Han X Y.Recovery of physiological functions of cotton leaves after relief from salt stress at the bud stage.Acta Ecologica Sinica,2015,35(19):6298-6305.

