高效液相色谱—质谱联用技术同时测定人体尿液中11种代谢物
王磊君+李钢+郑赛晶+费婷+刘鸿+戚大伟
摘 要 采用高效液相色谱-质谱联用技术定量检测人体尿样中丙烯醛、苯、1,3-丁二烯、苯乙烯、巴豆醛的巯基尿酸类代谢物及氰化氢代谢物。将解冻后的尿样经高速离心后,取100 μL上清液,加入50 μL内标溶液及850 μL水后上样分析。色谱分析采用XSELECT HSS T3 C18色谱柱(150 mm×2.1 mm i.d,2.5 μm),以乙腈-15 mmol醋酸铵溶液梯度洗脱,流速250 μL/min,柱温40 ℃,在多反应监测模式(MRM)下采用负离子扫描模式进行定量分析。本方法共检测了16名吸烟者和6名非吸烟者的尿样,发现日吸烟量大于25支的吸烟者尿样中的烟气成分代谢物浓度高于非吸烟者。
关键词 高效液相色谱-质谱联用技术; 尿液; 代谢物
1 引 言
卷烟燃烧会产生大量的挥发性有机化合物(VOCs),其中就包括丙烯醛、苯、1,3-丁二烯、氰化氢、苯乙烯、巴豆醛等,这些挥发性有机物具有较强的致癌或致突变作用[1~3],吸入后会对人体的代谢物产生影响。有些代谢物是吸入卷烟烟气后由烟气成分代谢产生的,称为外源性代谢物;有些则是人体本来就存在的代谢物,只是因为吸烟导致其含量变化,称为内源性代谢物。随着吸烟与健康这一话题的日渐升温,急需建立一种方便可靠的VOCs暴露量评价方法,直接针对代谢物进行分析。
目前, 通常采取检测呼出气体、血液及尿液中VOCs代谢物的含量评价VOCs的接触水平。其中检测尿样中VOCs的代谢物对人体的侵入性低,且取样方便,同时尿液中的代谢物相对于血液中母体化合物生物半衰期更长、更稳定,所以目前检测尿液中的代谢物逐渐代替了其它评价方法。已有一些文献报道测定这些有害气体在尿液中的代谢物,包括苯的代谢物苯巯基尿酸(S-PMA)、1,3-丁二烯的代谢物 N-乙酰基-S-(3,4-二羟基丁基)-L-半胱氨酸(DHBMA)等[4~8],主要是针对一些特定的职业环境进行的研究,只能评价个别VOCs的影响,而对于烟气这种含有多种VOCs的复杂体系,同时测定多种VOCs代谢物的分析方法鲜有报道。本研究建立了同时测定11种代谢物的分析方法,评价烟气中氰化氢、苯乙烯、巴豆醛、苯、1,3-丁二烯对于人体的接触水平。本方法前处理简单,适合高通量分析,特别适合烟气中VOCs代谢物研究。
2 实验部分
2.1 仪器与试剂
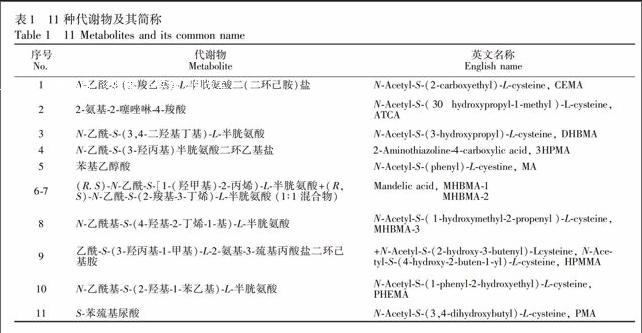
1200液相色谱仪,配有G1329A自动进样器、G1311A四元混合泵以及G1316A柱温箱(美国安捷伦公司);Eppendorf 5810R 高速离心机(德国Eppendorf公司); API4000三重四级杆串联质谱仪,配电喷雾离子源(ESI)和Analyst1.6软件数据处理系统(美国应用生物系统公司)。乙腈、甲醇(质谱级,德国默克公司);醋酸铵(色谱纯,德国默克公司);代谢物标样及其内标(详见表1),其中MHBMA-1和MHBMA-2为1∶1混合物,实验结果以两种物质的总量计(纯度均>99%,加拿大多伦多化学试剂公司);Milli-Q Intergral纯水/超纯水一体化系统(德国Merck Millipore 公司)。
2.2 标样与尿样样品准备
用甲醇将各同位素内标配制成1 g/L的工作液。采用流动相将11种待测物的标准品配制成质量
2.3 液相色谱及质谱条件
液相色谱条件:色谱柱 XSELECT HSS T3 C18色谱柱(150 mm×2.1 mm i.d,2.5 μm,美国Waters公司); 流动相: A为15 mmol/L醋酸铵溶液,B为乙腈; 流速: 0.25 mL/min; 梯度洗脱程序: 0~2 min, 97% A; 2~4 min,97%~5% A; 4~10 min, 5%~10% A; 10~10.5 min, 10%~50% A; 10.5~12.5 min, 50% A; 12.5~13 min, 50%~3% A; 13~20 min, 3% A。
质谱条件: 电喷雾离子源(ESI),负离子扫描方式,多反应检测(MRM)模式; 喷雾(IS)电压为: Symbolm@@ 4500 V; 雾化气(Gas1,氮气): 为344.5 kPa; 气帘气(Curtain Gas,氮气):压力为: 206.7 kPa; 辅助雾化气(Gas2,氮气)压力为310.0 kPa; 离子源温度(TEM)为: 600 ℃。
2.4 数据分析
为研究吸烟组与非吸烟组尿液代谢物之间的相关性,依据卷烟抽吸量不同,采用两样本双向t检验计算p值,来评估两组间的统计学差异。当p<0.05时,认为统计学上有显著差异。
3 结果与讨论
3.1 分析条件的优化
采用针泵注射的方式扫描标准溶液并得到相应的多反应监测(MRM)离子对,并优化各质谱参数(见表2)。考察了Agilent Porshell SB、Waters XSELECT HSS T3、Waters XBridge等色谱柱,最后选择了分离度更好的XSELECT HSS T3柱,在乙腈-醋酸铵水溶液流动相体系下,可以实现MHBMA的3种同分异构体的分离,11种目标物的分离效果见图1。
3.2 质谱断裂机理研究
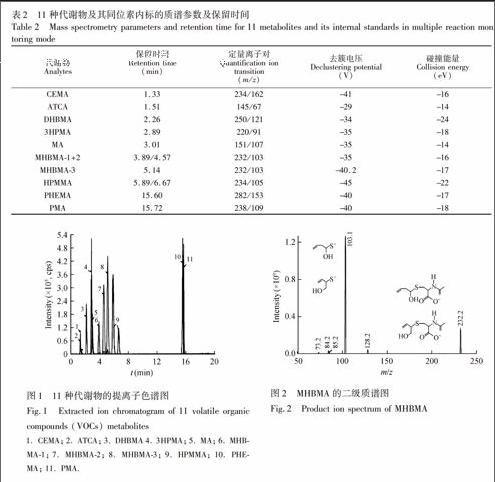
研究表明,疏基尿酸类物质在负离子模式下易丢失m/z 129中性分子[9],这一特性可以证实疏基尿酸的存在。例如MHBMA主要以[M-H] Symbolm@@ 离子形式存在,图2为MHBMA [M-H] Symbolm@@ 离子m/z 232的二级串联质谱图及其碎片离子示意图。质谱数据表明,m/z 232离子在二级质谱中发生断裂,生成主要特征离子为m/z 103。这个特征离子的产生有m/z 232离子及其半胱氨酸主链上键断裂,失去m/z 129(C5H7O3N)而得。endprint
3.3 分析方法验证
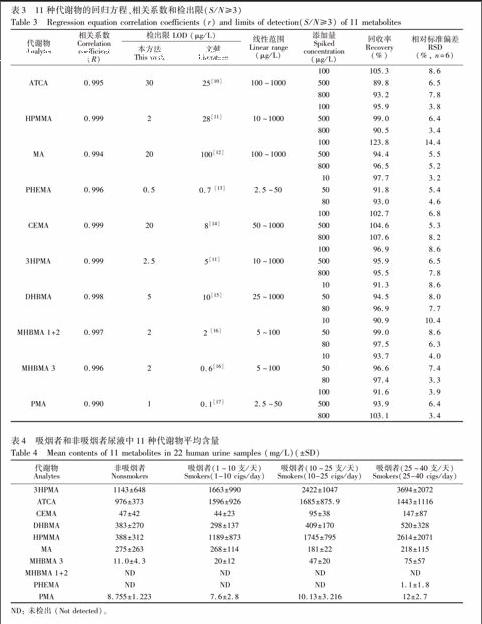
以11种代谢物与相应内标定量离子的峰面积比(Y)为纵坐标,质量浓度为横坐标X(μg/L)进行回归运算,得到相应的线性回归方程。11种代谢物的相关系数在0.990~0.999之间,表明待测物有良好的线性关系。以信噪比(S/N)不低于3时的进样浓度为检测限(LOD),结果表明,本方法11种代谢物的检测限在0.5~30 μg/L之间(表3),除MHBMA3与PMA外,检出限均优于文献值。
在经过处理的空白尿液样本中添加低、中、高3种不同浓度的样品,每个浓度6份样品,分别计算回收率与相对标准偏差(RSD)。结果表明,方法平均回收率为89.8%~123.8%,RSD值在3.1%~14.4%之间(见表3), 表明本方法结果准确,可以满足定量要求。
3.4 吸烟和非吸烟者尿液样本的测定
采用LC-MS/MS法测试了6名非吸烟者与16名吸烟者24 h尿液中11种代谢物的浓度。从表4可见,吸烟者尿液中几种代谢物平均值如3HPMA、CEMA、HPMMA等的含量明显高于非吸烟者,以CEMA为例,日吸烟量高于25支的样本的平均浓度达142.8 ng/mL,与非吸烟组对照计算得p=0.05(图3a),说明吸烟能显著影响丙烯醛在尿液中的排出量。1,3-丁二烯的代谢物MHBMA1-3也表现出相同规律。另外一些巯基尿酸物质及氰化氢代谢物ATCA在吸烟者和非吸烟者尿液中含量差异不明显。以ATCA〖为例(图3b),日吸烟量高于25支的样本的p=0.37,并无明显相关性,可能是氢氰酸的代谢也可能来
自食品或者氨基酸的生物分解[18],吸烟者的整体平均值仍高于非吸烟者。同样,苯的代谢物PMA与DHBMA也可能源于山梨酸,而这是一种食品中常见的防腐剂[19]。一些代谢物的不相关性的问
题的主要原因可能是:①当地空气质量对实验结果产生明显影响,有些挥发性有机物如氰化物和苯乙烯并非全部来自于烟气,在食品和环境大气中也广泛存在;②不同受试者代谢能力及饮食习惯有所不同,这些挥发性有机物进入体内的途径也更多,需要进一步研究。
4 结 论
建立了同时测定尿液中氰化氢、苯乙烯、巴豆醛、丙烯醛、苯、1,3丁二烯的相应11种代谢物ATCA, PHEMA, MA, HPMMA, CEMA, 3HPMA, PMA, MHBMA1-3和DHBMA的LC-MS/MS方法。该方法操作简单选择性好,灵敏度高,适合于分析吸烟者尿液中相关代谢物。通过实验分析,可以发现吸烟者尿液中11种代谢物的平均水平高于非吸烟者,但不同样本间差异性较大,这应该与个体的代谢能力、饮食习惯以及当地的空气质量有较大关系,这些差异仍需要深入研究。
References
1 Uchiyama S, Tomizawa T, Inaba Y, Kunugita N. J. Chromatogr. A , 2013, 1314: 31-37
2 WANG Chun-Lan, WANG Jun-Xia, HU Jing, HU Yu-Ling, LI Gong-Ke. Chinese J. Anal. Chem., 2013, 41(7): 1069-1073
王春兰, 汪军霞, 胡 静, 胡玉玲, 李攻科. 分析化学, 2013, 41(7): 1069-1073
3 PENG Hui-Min, WU Ming-Jian, REN Feng-Lian, HE Zhi-Hui, LIAN Wen-Liu. Chinese J. Anal. Chem., 2007, 35(2): 289-292
彭慧敏, 吴名剑, 任凤莲, 何智慧, 练文柳. 分析化学, 2007, 35(2): 289-292
4 Sapkota A, Halden R U, Dominici F, Groopman J D, Buckley T. J. Chem. Biol. Interact., 2006, 160(1): 70-79
5 Eckert E, Leng G, Gries W, Gen T. J. Chromatogr. B, 2012, 889-890: 69-76
6 Petrikovics I, Yu J C C, Thompson D E. J. Chromatogr. B, 2012, 891-892: 81-84
7 Schettgen T, Musiol A, Alt A, Kraus T. J. Chromatogr. B, 2008, 863(2): 283-292
8 Carmella S G, Chen M, Han S, Briggs A, Jensen J, Hatsukami D K, Hecht S S. Chem. Res. Toxicol., 2009, 22(4): 734-741
9 Wagner S, Scholz K, Donegan M, Burton L, Wingate J, Vlkel W. Anal. Chem., 2006, 78(4): 1296-1305
10 Logue B A, Kirschten N P, Petrikovics I, Moser M A, Rockwood G A, Baskin S I. J. Chromatogr. B, 2005, 819(2): 237-244endprint
11 Schettgen T, Musiol A, Kraus T. Rapid Commun. Mass Spectrom., 2008, 22(17): 2629-2638
12 Manini P, Andreoli R, Poli D, Palma G D, Mutti A, Niessen W M. Rapid Commun. Mass Spectrom., 2002, 16(24): 2239-2248
13 Negri S, Maestri L, Andreoli R, Manini P, Mutti A, Imbriani M. Toxicol. Lett., 2006, 162(2-3): 225-233
14 Alwis K U, Blount B C, Britt A S, Patel D, Ashley D L. Anal. Chim. Acta., 2012, 750: 152-160
15 Schettgen T, Musiol A, Alt A, Ochsmann E, Kraus T. Anal. Bioanal. Chem., 2009, 393(3): 969-981
16 Hoet P, Smedt E D, Ferrari M, Imbriani M, Maestri L, Negri S, Wilde P D, Lison D, Haufroid V. Int. Arch. Occup. Environ. Health, 2009, 82(8): 985-995
17 Paci E, Pigini D, Cialdella A M, Faranda P, Tranfo G. Biomarkers, 2007, 12(2): 111-122
18 Logue B A, Maserek W K, Rockwood G A, Keebaugh M W, Baskin S I. Toxicol. Mech. Methods, 2009, 19(3): 202-208
19 Lovreglio P, Barbieri A, Carrieri M, Sabatini L, Fracasso M E, Doria D, Drago I, Basso A, Errico M N, Bartolucci G B, Violante F S, Soleo L. Int. Arch. Occup. Environ. Health, 2010, 83(3): 341-356
Simultaneous Determination of 11 Volatile Organic Compounds
Metabolites in Human Urine Using High Performance Liquid
Chromatography Coupled with Electrospray
Ionization Tandem Mass Spectrometry
WANG Lei-Jun, LI Gang*, ZHENG Sai-Jing, FEI Ting, LIU Hong, QI Da-Wei
(Technical Center, Shanghai Tobacco Group, Shanghai 200082, China)
Abstract We developed and validated a method using high performance liquid chromatography (HPLC) coupled with electrospray ionization tandem mass spectrometry (ESI-MS/MS) to simultaneously quantify 11 urinary volatile organic compound (VOC) metabolites. The frozen urinary samples were unfrozen at room temperature and centrifuged to remove settled precipitate. 100 μL of the supernatant and 50 μL of internal standard were added and then diluted by 850 μL of water so as to be analyzed by LC-MS/MS. The compounds were separated on a XSELECT HSS T3 column using acetonitrile as mobile phase A and 15 mmol/L ammonium acetate as mobile phase B at a flow rate of 250 μL/min. The analytes were determined qualitatively and quantitatively under multi-reaction monitoring (MRM) and negative polarity mode. The limits of detection ranged from 0.5-30 μg/L and the spiked recoveries of the analytes ranged from 89.8%-123.8% with RSDs of 3.1%-14.4%. This method was applied to 22 h urine samples collected from 16 smokers and 6 non-smokers. The results showed that the contents of the metabolites in smoker′s urine were higher than those of nonsmokers, especially, smoking more than 25 cigarettes per day.
Keywords Liquid chromatography-tandem mass spectrometry; Urine; Metabolites
(Received 11 June 2014; accepted 12 September 2014)endprint

